HAK基因对玉米的遗传转化及其耐盐性研究
2013-06-01汪婷婷关春峰
季 静,汪婷婷,王 罡,吴 疆,关春峰
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
HAK基因对玉米的遗传转化及其耐盐性研究
季 静1,2,汪婷婷1,2,王 罡2,吴 疆1,关春峰2
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
用农杆菌介导法将高亲和性钾离子转运体基因(HAK)和Bar基因转入5个优良玉米自交系7922、P138、265、238和271中,并对影响其遗传转化效率因素进行了优化.经PCR和RT-PCR检测证实获得阳性植株.除草剂涂抹实验证明Bar基因已经整合进玉米基因组.用不同浓度的盐溶液处理转基因植株和对照植株,发现转基因植株叶片中的K+含量、脯氨酸和叶绿素含量均高于未转化植株,而Na+含量低于未转化植株,表明HAK基因已经整合进玉米基因组,并通过过量表达提高了植株的耐盐性.
玉米自交系;农杆菌介导;HAK;耐盐性
玉米是世界上重要的粮食作物和工业原料之一,因此玉米的遗传转化技术一直是各国科学工作者研究的热点.目前,将外源基因转入玉米的方法主要有2种:农杆菌转化法和基因枪法[1].相对于其他转化法来说,农杆菌转化法具有能完整转化较大的DNA片段、外源基因拷贝数少、整合位点比较稳定且不需要进行原生质体培养等优势[2],已成为植物基因工程中应用最为广泛的技术.虽然这项技术已被成功应用于30多种双子叶植物的转化,但是单子叶植物特别是像玉米、水稻、小麦等这些重要的农作物却一直被排除在农杆菌的天然宿主范围之外.因此,农杆菌介导玉米的遗传转化经过了一段很长的摸索时期.20世纪90年代以后,玉米转基因技术得到了迅猛发展.1991年,Gould等[3]用带有GUS和NPT Ⅱ基因的农杆菌转化玉米芽尖分生组织获得成功.1999年,国内黄璐等[4]首次用农杆菌转化玉米Ⅱ型胚性愈伤组织并获得了再生植株.由于玉米不是农杆菌的天然宿主,其转化效率受到多种因素影响,因此如何建立稳定、高效且易于再生的转化系统是玉米转化的关键.
钾离子是植物体内大量元素中含量最为丰富的,对植物的生长发育起着非常重要的作用,如作为酶的活化剂,参与植物的蛋白质合成、氮代谢、脂肪代谢、渗透调节、气孔的开闭[5],维持细胞内电荷平衡和细胞膜功能,促进植物体内营养物质的运输,以及增强植物抗逆性等[6-7].作为植物体内的主要营养元素,钾离子的含量占到植物细胞干重的0.8%~8.0%,在植物细胞内钾离子含量维持在80~200,mmol/L[8]. Ashley等[9]研究发现,植物体内钾离子的获得只能来源于土壤.大部分土壤中虽然全钾含量很高,但可供植物有效吸收的钾离子含量却很少.随着我国作物单产量的提高,土壤缺钾的问题日益严重.因此,培育高效钾吸收的作物品种或通过基因工程方法改良植物的钾营养性状已经成为当前研究的热点[10].
高亲和性钾离子转运体基因(high affinity K+transporter,HAK)是高亲和K+吸收转运体基因KUP /HAK/KT家族中的一员,该家族在植物的钾营养吸收方面起着非常重要的作用.HAK基因的表达能使植物在低钾及盐胁迫条件下提高对K+的吸收能力,维持正常的K+浓度和生理功能,保持高K+/Na+,从而提高植物的耐盐性[11].冯书阳[12]将HAK基因转入烟草中,发现该基因在烟草中能正常表达,转化后的烟草具有一定的抗盐性.但该基因目前在玉米上的遗传转化尚未见报道,因此笔者将HAK基因通过农杆菌介导法转入优良玉米自交系来提高玉米营养品质,并在盐胁迫条件下测定玉米生理指标,为获得耐盐新品种提供理论依据.
1 材料和方法
1.1 植物材料
优良玉米自交系7922、P138、265、238和271的植株在人工授粉后10~15,d后,取其1.0~1.5,mm幼胚接种于愈伤诱导培养基上,培养4~5周得到П型胚性愈伤组织,每14,d继代一次,取长势较好的П型胚性愈伤组织作为农杆菌转化的受体材料.
1.2 菌株和质粒
农杆菌菌株为EHA105,携带双元质粒pCAMBIA3300,如图1所示.质粒pCAMBIA3300的T-DNA区含有高亲和性钾离子转运蛋白基因(HAK)和乙酰转移酶基因(Bar).
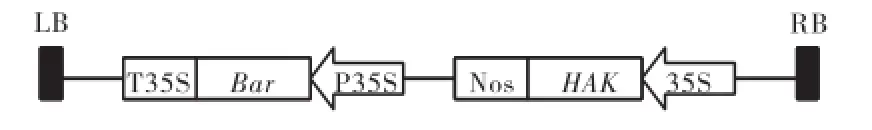
图1 pCAMBIA3300-35S-HAK质粒图谱Fig.1 Schematic representation of plasmid pCAMBIA3300-35S-HAK
1.3 培养基
研究采用了3种基本诱导培养基:MB(MS大量和B5微量)、NM(N6大量和MS微量)和NB(N6大量和B5微量),其基本成分如表1所示.

表1 实验用培养Tab.1 Medium formulation for experiment
1.4 最高筛选压力的确定
将自交系7922未转化的胚性愈伤组织分别接入含有0、2,mg/L、4,mg/L、6,mg/L、8,mg/L、10,mg/L除草剂(PPT)的继代培养基上.15,d后观察胚性愈伤组织褐化情况,统计胚性愈伤组织的褐变率,再将存活的胚性愈伤组织转入再生培养基,30,d后统计愈伤组织出苗率,根据愈伤组织的褐变率和出苗率,确定最适宜的筛选压力.
1.5 农杆菌转化
1.5.1 农杆菌的培养
从平板上挑取农杆菌单菌落接种于YEP液体培养基(含100,mg/L卡那霉素)中,28,℃、180,r/min振荡培养过夜,当农杆菌生长至对数生长期(OD600不同)时,20,℃、4,000,r/min离心10,min收集菌体,用等体积侵染培养基重悬菌体.
1.5.2 外植体的转化及筛选
挑取长势良好的玉米胚性愈伤组织,切成3,mm左右的小块,浸泡于含有100,μmol/L乙酰丁香酮(AS)的重悬液中,不停振荡.侵染5~20,min后弃去菌液,用滤纸吸干愈伤组织表面的菌液后,放入共培培养基中22,℃暗培养3,d.将愈伤组织转入延迟培养基28,℃暗培养7,d后转入筛选Ⅰ培养基中培养2周,再转入筛选Ⅱ培养基中筛选2次,每次2周.将获得的抗性愈伤组织转入再生Ⅰ培养基中25,℃暗培养3周.待体胚变白、肿胀时移入再生Ⅱ培养基中25,℃光照培养分化出苗.待小苗长出3~4片叶子,炼苗后移入花盆放于温室培养.
1.6 分子检测
1.6.1 DNA的提取
采用CTAB法提取DNA.
1.6.2 PCR检测
PCR反应体系为25,μL,扩增反应程序为:94,℃4,min;94,℃ 30,s,55,℃ 30,s,72,℃ 2.5,min,30个循环;72,℃延伸8,min.产物经0.7%琼脂糖凝胶电泳检测.引物如下.
上游:ATGTCGCTCGAGGTCGAGAAC.下游:CTATATTTCATATGTGATCCCAAC.
1.6.3 RT-PCR检测
用对照植株和转基因植株提取叶片总RNA,反转录合成的cDNA作为模板[13],用HAK基因特异性引物进行扩增,扩增出的片段大小为502,bp.扩增反应程序为:94,℃ 4,min;94,℃ 30,s,55,℃ 30,s,72,℃40,s,30个循环;72,℃延伸8,min.产物经0.7%琼脂糖凝胶电泳检测.引物如下.
上游:TATGCGAACGACAATGGA.
下游:GGTTGAAAGCCCGTAAAA.
1.7 转基因植株除草剂抗性实验
将转基因植株种子播种于花盆中,待T1代植株长出5片叶子时,将PPT质量浓度为200,mg/L的农药涂抹在转基因植株和对照植株的叶片上,7,d后观察叶片坏死情况.
1.8 转基因植株的生理指标检测
选取未转化植株和3个T1代转基因株系Z-1、Z-2、Z-3,分别用含0、100,mmol/L、200,mmol/L的NaCl的1/2,MS营养液处理植株,每3,d浇一次,处理2周后,取样测定叶片中K+、Na+、脯氨酸、叶绿素含量.叶片分别用浓H2SO4和H2O2消煮后,用火焰光度计测量K+、Na+含量[14],采用茚三酮法测定脯氨酸含量[15],叶绿素含量测定参照文献[16]进行.进行3次平行实验.
2 结果与分析
2.1 培养基对玉米愈伤组织诱导率的影响
将7922、P138、265、238和271授粉10~15,d后的幼胚分别接种于MB、NM、NB培养基上,愈伤组织诱导结果如表2所示.通过分析发现,这3种培养基对5个自交系玉米的愈伤组织诱导率都很高,但是Ⅱ型胚性愈伤组织的诱导率却有明显差异:MB培养基胚性愈伤组织诱导率显著低于NM、NB培养基(见表2),诱导出的愈伤组织多呈水渍状,易褐化;NM次之;诱导率最高的是NB培养基,且诱导出的胚性愈伤组织成浅黄色,质地松脆.

表2 培养基对玉米幼胚愈伤组织诱导率的影响Tab.2 Effect of medium on maize embryogenic callus induction ratio
2.2 幼胚大小对玉米愈伤组织诱导率的影响
取7922和P138授粉10~15,d后,大小在0.5~2.5,mm之间的幼胚接种在NB培养基上,暗培养2周以后统计愈伤组织诱导率,结果如图2所示.对于同一自交系的玉米,不同幼胚大小愈伤组织诱导率有显著差异.幼胚大小在1.0~1.5,mm时愈伤组织诱导率最高,7922为91.5%,P138为85.4%.对于不同玉米自交系相同大小的幼胚,其愈伤组织诱导率也有所差异.

图2 幼胚大小对玉米愈伤组织诱导率的影响Fig.2 Effect of the size of immature embryos on maize embryogenic callus induction ratio
2.3 最高筛选压力的确定
将7922未转化的胚性愈伤组织接入含有不同质量浓度PPT的继代培养基上,2周后观察愈伤组织的褐化情况,统计结果见表3.结果表明,随着PPT质量浓度的增大,愈伤组织的褐化率增大,出苗率降低.当PPT质量浓度为4,mg/L时,愈伤组织的褐化率接近50%;当PPT质量浓度为10,mg/L时,愈伤组织已经全部褐化死亡.当PPT质量浓度大于6,mg/L时,愈伤组织的分化能力被强烈抑制,由于筛选剂在2次筛选过程中有累加毒害作用,故将5,mg/L定为筛选剂的最高质量浓度.

表3 筛选剂PPT适宜质量浓度的确定Tab.3 Selection of suitable PPT concentration
2.4 菌液浓度及侵染时间对转化率的影响
取长势良好的7922Ⅱ型胚性愈伤组织,用菌液浓度OD600分别为0.2、0.4、0.6、0.8和1.0的EHA105的菌液分别侵染5,min、10,min、15,min和20,min,统计抗性愈伤组织获得率,见图3.结果表明当OD600为0.6、侵染时间为15,min时,抗性愈伤组织获得率最高为32.7%;当OD600较大、侵染时间较长时,抗性愈伤组织的获得率反而下降,这可能是因为农杆菌的过量生长对愈伤组织造成了更为严重的伤害,而且加大了后期抑菌的难度.本实验确立了最佳的侵染条件为在OD600为0.6时侵染15,min.
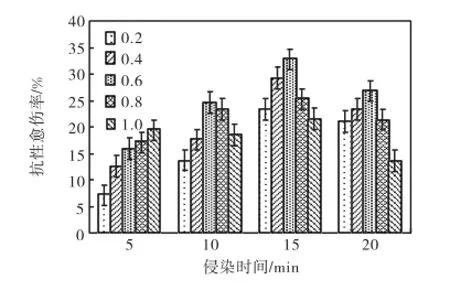
图3 菌液浓度和侵染时间对抗性愈伤率的影响Fig.3Effect of A.tumefaciens concentration and infection time on maize resistant callus ratio
2.5 共培养温度对转化率的影响
较低的共培养温度能促进农杆菌对植物细胞的转化.Salas等[17]研究了温度对T-DNA在植物细胞内整合的影响,认为虽然19,℃是T-DNA转移的最佳温度,但在25,℃时植物细胞对农杆菌的敏感度和T-DNA的整合的稳定性是最好的.因此本实验选取了中间温度,研究了在22,℃和27,℃下共培养温度对玉米转化效率的影响,发现在22,℃共培养条件下获得的抗性愈伤率明显高于27,℃的共培养条件,22,℃时农杆菌生长速度较为缓慢,这有利于后期对农杆菌的抑制.
2.6 分子检测
本实验用农杆菌转化法对5个玉米自交系进行了遗传转化,共转化684个胚性愈伤组织.经PPT筛选后获得的抗性愈伤组织在再生培养基上分化出苗,共获得114株抗性植株(见表4).经PCR检测,得到14株阳性植株,共3个自交系(见图4).对3个转基因品系的T1代植株进行的PCR检测和RT-PCR检测(见图5),证明HAK基因已经整合进玉米基因组,并能正常转录.

表4 农杆菌介导的玉米自交系的转化效率Tab.4 Efficiency of Agrobacterium-mediated transformation of maize inbred lines

图4 转基因植株的PCR检测Fig.4 PCR assay of transformed plants
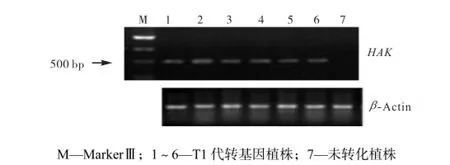
图5 T1代转基因植株的RT-PCR检测Fig.5 RT-PCR assay of T1 transformed plants
2.7 转基因植株除草剂抗性实验
用PPT质量浓度为200,mg/L的农药涂抹在T1代转基因植株和对照植株的叶片上,一周后非转基因植株叶片出现了明显的变黄枯萎,而转基因植株叶片变化较小,少数有轻微的褪绿现象发生,如图6所示.这初步说明Bar基因也同时整合进玉米基因组中并一定程度上得到了表达.

图6 转基因植株和对照植株叶片对除草剂抗性检测Fig.6 PPT resistance test in leaves of nontransformed plant and transformed plant
2.8 转基因植株的生理检测
2.8.1 转基因植株叶片中K+、Na+含量测定
在盐胁迫条件下,随着NaCl浓度逐渐升高,玉米叶片中的K+含量逐渐降低(见图7(a)),Na+含量逐渐升高(见图7(b)).但转基因植株叶片中K+含量明显高于未转化植株,而对Na+的摄入量则少于未转化植株.相对于未转化植株,转基因植株维持了较高的K+/Na+含量比(见图7(c)).这说明转基因植株在盐胁迫下对K+选择吸收性大,能维持高K+/Na+含量比,更好地保证植株的正常生长.
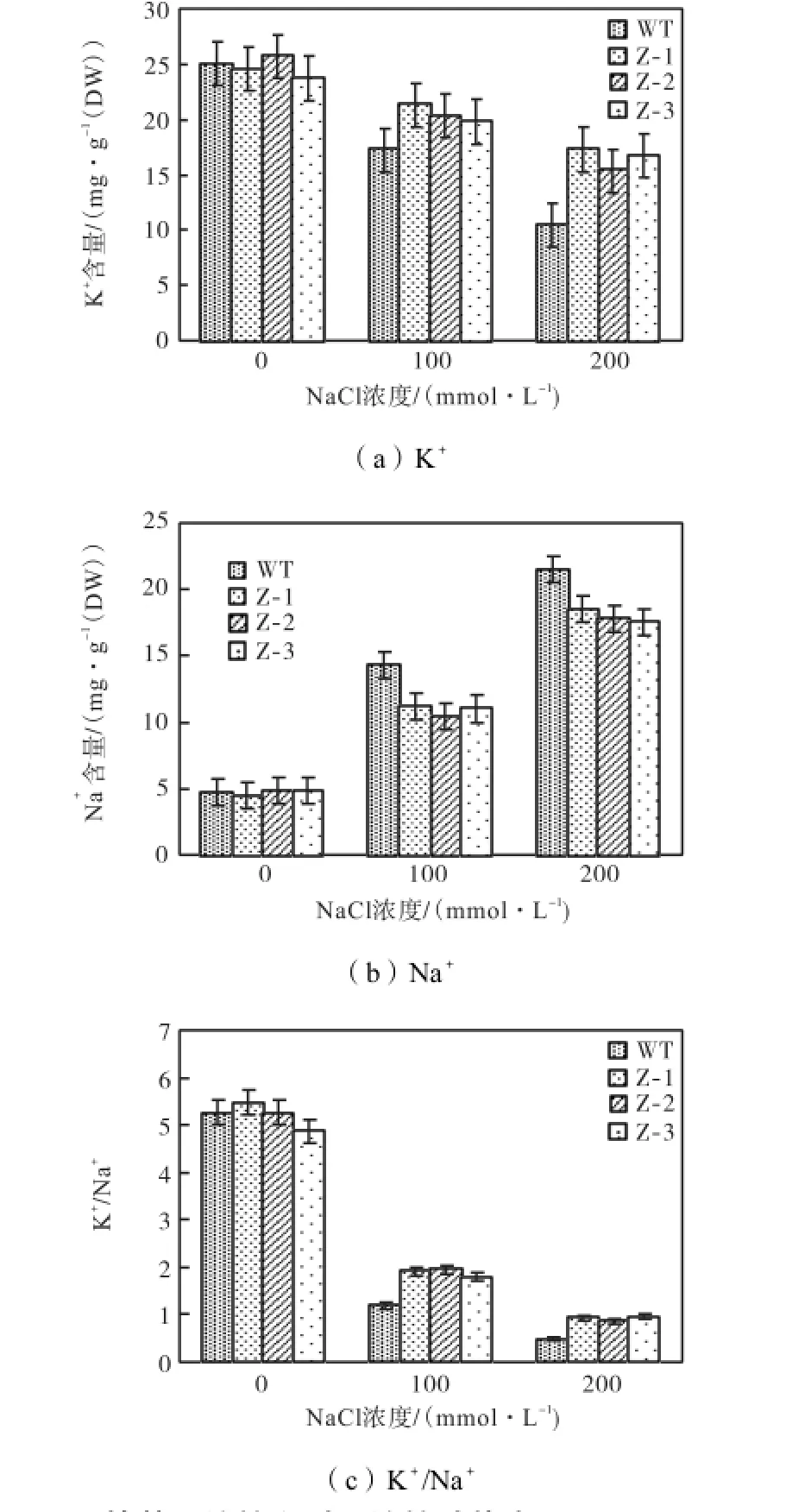
图7 转基因植株和对照植株叶片中K+、Na+及K+/Na+含量测定Fig.7K+,Na+and K+/Na+content in leaves of nontransformed plants and transformed plants
2.8.2 转基因植株叶片中脯氨酸和叶绿素含量测定
脯氨酸是一种有机小分子渗透调节物质.如图8(a)所示,在盐胁迫条件下,非转化植株和转基因植株叶片中脯氨酸含量都有所增加,且随着盐浓度的增大,游离脯氨酸的含量也增大,这说明脯氨酸的积累能增强植物的抗逆性.在200,mmol/L NaCl条件下,转基因植株体内的游离脯氨酸含量分别比未转化植株提高了67.29%、51.64%和61.70%,对高盐表现出较强的耐受性.
盐胁迫条件下,植物体内水分缺失,光合作用受到影响,叶片中叶绿素含量降低.如图8(b)所示,在盐处理条件下,虽然转基因植株叶片中叶绿素含量整体呈下降趋势,但与未转化植株相比,其叶绿素含量明显高于未转化植株,受到的影响较小,维持了较好的生理状态.

图8 转基因植株和对照植株叶片中脯氨酸和叶绿素含量测定Fig.8 Proline and total chlorophyll content in leaves of nontransformed plants and transformed plants
3 讨 论
农杆菌介导的玉米遗传转化中,不同生长阶段及不同生理状态的植物细胞对农杆菌的敏感程度不同.幼胚因其容易诱导出Ⅱ型胚性愈伤组织、再生频率高且转化率较为理想而成为首选,且Ⅱ型胚性愈伤组织的诱导率受到玉米基因型、幼胚大小、培养基条件等多种因素的影响[18-19].本实验即以幼胚诱导产生的Ⅱ型胚性愈伤组织为材料进行侵染,并对上述影响因素进行了研究.
研究表明,农杆菌侵染过程中,农杆菌菌株及菌液浓度、侵染时间和共培养时间及温度等因子对农杆菌的转化效率起着至关重要的作用[20-21].本实验对农杆菌浓度、侵染时间及共培养温度进行了优化,并确定了最高筛选压5,mg/L PPT,但再生后的植株存在阳性率较低的问题,这可能和筛选压力较低有关,然而,当筛选压较高时会严重抑制愈伤组织的分化,适当的筛选体系需要进一步的探究.
盐胁迫对植物造成的伤害主要包括离子毒害、细胞膜通透性改变、渗透压改变及对光合作用的影响[22]. 本实验研究了NaCl造成的盐渍环境对转基因植株生理活性的影响,测定了盐胁迫条件下转基因植株叶片中K+、Na+、脯氨酸和叶绿素含量.K+/Na+是植株耐盐性强弱的重要指标,植物在受胁迫时体内的脯氨酸含量会大量积累,光合作用也会因为膜结构遭到破坏而受到影响,叶绿素含量降低.本实验中在盐胁迫条件下,转基因植株叶片中K+、K+/Na+、脯氨酸和叶绿素含量明显高于未转化植株,而Na+含量低于未转化植株,说明HAK基因的表达使转基因植株在高盐条件下能有效地吸收K+,保持高的K+/Na+,减少了盐分对植株的伤害,增强了植株的耐盐性.
4 结 语
研究结果表明,大小为1.0~1.5,mm的幼胚在NB培养基上进行诱导时,胚性愈伤组织诱导率最高.转化的最适条件为农杆菌OD600为0.6时侵染15,min,22,℃暗培养3,d.经过以上条件的优化,获得了具有较强耐盐性的转基因阳性植株,证明了本体系的可行性.
[1] Huang Xueqing,Wei Zhiming. Successful Agrobacterium-mediated genetic transformation of maize elite inbred lines[J]. Plant Cell,Tissue and Organ Culture,2005,83(2):187-200.
[2] Cheng M,Fry J E,Pang S,et al. Genetic transformation of wheat mediated by Agrobacterium tumefaciens [J]. Plant Physiol,1997,115(3):971-980.
[3] Gould J,Devey M,Hasegawa O,et al. Transformation of Zea mays L. using Agrobacterium tumefaciens and the shoot apex[J]. Plant Physiol,1991,95(2):426-434.
[4] 黄 璐,卫志明. 农杆菌介导的玉米遗传转化[J]. 实验生物学报,1999,32(4),381-389.
Huang Lu,Wei Zhiming. Agrobacterium tumefaciens mediated maize transformation[J]. Acta Biologiae Experimentalis Sinica,1999,32(4):381-389(in Chinese).
[5] Pyo Y J,Gierth M,Schroeder J I,et al. High affinity K+transport in Arabidopsis:AtHAK5 and AKT1 are vital for seedling establishment and postgermination growth under low-potassium conditions[J]. Plant Physiol,2010,153(2):863-875.
[6] Xu J,Li H D,Chen L Q,et al. A protein kinase,interacting with two calcineurin B-like proteins,regulates K+transporter AKT1 in Arabidopsis [J]. Cell,2006,125(7):1347-1360.
[7] Takahashi R,Nishio T,Ichizen N,et al. Cloning and functional analysis of the K+transporter,PhaHAK2,from salt-sensitive and salt-tolerant reed plants[J]. Biotechnol Lett,2007,29(3):501-506.
[8] Maathuis F J. Physiological functions of mineral macronutrients[J]. Curr Opin Plant Biol,2009,12(3):250-258.
[9] Ashley M K,Grant M,Grabov A. Plant responses to potassium deficiencies:A role for potassium transport proteins[J]. J Exp Bot,2006,57(2):425-436.
[10] Josine T L,Ji J,Wang G,et a1. Advances in genetic engineering for plants abiotic stress control[J]. African Journal of Biotechnol,2011,10(28):5402-5413.
[11] 王 兰,苏 乔. 獐茅AlHAK1 real-time PCR定量方法的建立[J]. 中国农学通报,2009,25(12):20-24. Wang Lan,Su Qiao. Establishment of real-time PCR assay for quantitative analysis of AlHAK1 [J]. Chinese Agricultural Science Bulletin,2009,25(12):20-24(in Chinese).
[12] 冯书阳. 獐茅高亲和性K+转运蛋白基因的克隆和表达[D]. 大连:大连理工大学生命科学与技术学院,2007.
Feng Shuyang. Cloning and Characterization of a High Affinity K+Transporter Gene from Aeluropus littoralis[D]. Dalian:School of Life Science and Biotechnology,Dalian University of Technology,2007(in Chinese).
[13] Ji J,Wang G,Wang J H,et a1. Functional analysis of multiple carotenogenic genes from Lycium barbarum and Gentiana lutea L. for their effects on β-carotene production in transgenic tobacco[J]. Biotechnol Lett,2009,31(2):305-312.
[14] Josine T L,Ji J,Wang G,et a1. Salinity stress tissueregenerated Rosa chinensis Jacq. improves water and proline content[J]. Afr J Agric Res,2011,6(14):3409-3418.
[15] Monreal J A,Jimenez E T,Remesal E,et a1. Proline content of sugar beet storage roots:Response to water deficit and nitrogen fertilization at field conditions[J]. Environ Exp Bot,2007,60(2):257-267.
[16] Wang M,Wang G,Ji J,et a1. The effect of pds gene silencing on chloroplast pigment composition,thylakoid membrane structure and photosynthesis efficiency in tobacco plants[J]. Plant Sci,2009,177(3):222-226.
[17] Salas M G,Park S H,Srivatanakul M,et al. Temperature influence on stable T-DNA integration in plant cell[J]. Plant Cell Rep,2001,20(8):701-705.
[18] Frame B R,McMurray J M,Fronger T M,et al. Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts[J]. Plant Cell Rep,2006,25(10):1024-1034.
[19] Kim M J,Baek K,Park C M. Optimization of conditions for transient Agrobacterium-mediated gene expression assays in Arabidopsis[J]. Plant Cell Rep,2009,28(8):1159-1167.
[20] Sunilkumar G,Rathore K. Transgenic cotton:Factors influencing Agrobacterium-mediated transformation and regeneration[J]. Mol Breed,2001,8(1):37-52.
[21] Dillen W,DeClercq J,Kapila J,et al. The effect of temperature on Agrobacterium tumefaciens-mediated gene transfer to plants[J]. Plant J,1997,12(6):1459-1463.
[22] Yang X L,Ji J,Wang G,et al. Over-expressing Salicornia europaea(SeNHX1)gene in tobacco improves tolerance to salt[J]. African Journal of Biotechnology,2011,10(73):16452-16460.
Genetic Transformation of Maize with HAK Gene and Its Effect on Salt Tolerance
Ji Jing1,2,Wang Tingting1,2,Wang Gang2,Wu Jiang1,Guan Chunfeng2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. Research Institute of Genetic Engineering,Tianjin University,Tianjin 300072,China)
The HAK and Bar genes were transferred into five different inbred lines of maize,including 7922,P138,265,238 and 271,by Agrobacterium-mediated transformation. Factors influencing transformation efficiency were optimized. Transgenic plants, which are resistant to phosphinothricin (PPT), were acquired by PCR and RT-PCR. When treated with different concentration of NaCl, higer K+,proline and chlorophyll contents were observed in transgenic leaves than in wild type leaves,but Na+content in transgenic leaves was obviously lower than in wild type leaves. These results show that HAK gene is integrated into maize genome and transcribed normally. Over-expressing of HAK gene enhances the salt tolerance of transgenic maize.
maize inbred line;Agrobacterium-mediated;HAK;salt tolerance
Q943
A
0493-2137(2013)07-0659-07
DOI 10.11784/tdxb20130715
2011-12-10;
2012-03-28.
国家转基因生命新品种培育重大专项资助项目(2009ZX08003-019B);国家转基因生物新品种培育重大专项资助项目(2011ZX08003-005);国家自然科学基金资助项目(31271793,31271419);教育部高等学校博士学科点专项科研基金资助项目(20100032110060).
季 静(1965— ),女,博士,教授,jijingtjdx@163.com.
王 罡,wanggangtjdx@126.com.
