花榈木基因型、采种时期对体细胞胚胎的诱导
2020-12-08吴高殷韦小丽
吴高殷,韦小丽,王 晓,梁 娴
(贵州大学 a.林学院;b.贵州省森林资源与环境研究中心,贵州 贵阳 550025)
花榈木Ormosia henryi为豆科红豆属常绿乔木,我国珍贵用材树种,自然分布于我国安徽、浙江、江西、湖南、湖北、广东、四川、贵州、云南9 个省份,海拔100~1 300 m。花榈木因材质致密、纹理均匀,是制作高档家具和工艺品的重要原材料,具有较高经济价值和极大开发潜力。目前,播种繁殖仍然是花榈木繁育的主要方式,但因母树稀少且结实有大小年现象,种子采集困难,且种子繁殖不利于母树优良性状的保存。因此,开展花榈木无性快繁技术研究,提高繁殖系数,是解决花榈木种子来源不足、保持母树优良性状的重要途径。前人分别采用花榈木种子[1]、茎段[2]和下胚轴[3]为外植体,通过器官发生途径初步建立了再生体系,但再生体系获得的植株数量较少,尚未能满足其推广运用。
体细胞胚胎发生技术是一种重要的植物体外再生方法[4],可通过生物反应器进行大规模生产[4],其具有繁殖速度快[6]、产量高[7]、利于种质资源保存[4]和遗传转化[6]等优势,较器官发生是一种更加高效的无性繁殖技术[4]。它是单个体细胞或植物组织经脱分化、再分化形成再生植株的一个复杂生化过程[8],其中,胚性愈伤是胚胎形成的前体和体胚发生的关键材料,胚性愈伤经生长发育后可形成大量胚状体,其生理和形态学类似于合子胚[9],是研究胚胎起源、早期生理、分子和形态的理想模型材料[10-11]。
目前,针叶树种如落叶松[12]、红松[13]、辐射松[14]和云杉[15]等,其成熟的体胚发生再生体系已被建立,而阔叶树种体胚发生体系仅在部分树种中得以运用,如鹅掌楸[16]、龙眼[17]和咖啡[7]等。体细胞胚胎发生受诸多因素影响。其中外植体本身的状况尤其是基因型和胚的成熟度是影响体胚发生的主要因素。基因型是体胚发生的内在因子[9],不同基因型对体细胞胚胎发生的敏感度不一样[18-19],未成熟胚的采种时期影响着体胚的诱导[15]。一些研究表明,不同基因型成熟胚和不同采种时期的未成熟胚在生理上存在一定差异,对体胚诱导具有显著性影响[12],但对其相关差异的机理研究甚少。
通过对花榈木不同基因型成熟胚和不同采集期获得的未成熟胚进行愈伤诱导实验,以期筛选出花榈木高频体胚发生的基因型和采种时期,为花榈木体胚诱导筛选适宜的繁殖材料。在实验中测定不同基因型成熟胚和不同发育程度的未成熟胚诱导出的胚性愈伤组织的生化物质变化,并观察胚性愈伤的起源方式,以揭示不同基因型和不同发育程度未成熟胚诱导胚性愈伤差异的生理生化基础,探明花榈木体胚发生前期组织形态学变化。
1 材料与方法
1.1 试验材料
不同基因型的种子采集及处理:2017年11月从7 个种源地收集7 株花榈木单株成熟种子,置于4 ℃冰箱中贮藏。7 株母树基本情况及其种子表型特征见表1。实验开始前,加2 滴吐温-20,清洗花榈木种子表面杂质,晾干后使用浓H2SO4处理1 h,回收浓H2SO4,在自来水下冲洗掉种子表面的浓H2SO4。
不同发育程度的未成熟胚采集及处理:于2018年8月10日(T1)、8月20日(T2)、8月30日(T3)、9月9日(T4)和9月19日(T5)5 个时期(表2)在贵阳市花溪区杨中村采集花榈木未成熟种子(基因型为GZHX),每次采样约200 粒,带回实验室去除豆荚,取出未成熟种子(图1),加入2 滴吐温-20,在自来水下冲洗半小时。

表1 7 株母树种子的基本信息†Table 1 Seed information of seven mother trees

表2 不同采种时期对胚性愈伤组织生长及生理的影响Table 2 Effects of different seed collecting stages on growth and physiology of EC

图1 基因型GZHX 胚性愈伤的诱导Fig.1 EC induction of GZHX genotypes
1.2 方 法
1.2.1 胚性愈伤诱导
将上述种子转移至超净工作台上,75%酒精处理1 min,2% NaClO 处理8 min,无菌水冲洗5遍(其中成熟种子须在无菌水中吸胀24 h)。然后使用刀片、镊子取出成熟胚和未成熟胚,接种至培养基中进行胚性愈伤诱导。胚性愈伤诱导培养基参考Wu 等[20]的配方,为:B5+6-BA(0.2 mg/L)+2,4-D(2.0 mg/L)+蔗糖(30 g/L)+结冷胶(2.5 g/L)+谷氨酰胺(500 mg/L)。pH 值5.9±0.1,采用121 ℃高温灭菌20 min。每个处理5 次重复,每个重复接种30~50 个外植体,接种后进行暗培养,培养温度25±2 ℃。第25 天观察愈伤形态特征和统计胚性愈伤的诱导率。
1.2.2 体胚诱导
7 个基因型和5 个采种时期的胚性愈伤组织转移至体胚诱导培养基B5+KT(0.5 mg/L)+2,4-D(1.0 mg/L)中[20],每个处理4 个重复,每次重复20~30 个胚性愈伤组织。培养4 周后统计体胚诱导率。
1.2.3 胚性愈伤的生长监测
不同基因型胚性愈伤诱导过程中,监测胚性愈伤组织的质量,其取样时间参考王高[13]和范建芝[21]的方法,分别于成熟胚接种后7、11、15、19、23、27、30 和33 d 称量胚性愈伤的质量,每次称量4~7 个胚性愈伤组织。
1.2.4 胚性愈伤生理生化的测定
不同基因型成熟胚和GZHX 基因型5 个采集时期未成熟胚在胚性愈伤诱导25 d 后,分别收集其胚性愈伤组织,用蒸馏水清洗掉胚性愈伤组织上的培养基,放入10 mL 离心管,贮藏在-80 ℃冰箱。待样品收集完成后,统一测定其可溶性糖、淀粉和可溶性蛋白含量;可溶性糖和淀粉含量采用硫酸-蒽酮法进行测定[22],可溶性蛋白含量采用考马斯亮蓝法进行测定[22],每个处理测定5 个重复。
1.2.5 组织细胞学观察
GZHX 基因型愈伤组织经继代培养40 d 后,收集胚性愈伤和非胚性愈伤固定在FAA 固定液中24 h,经乙醇系列脱水和二甲苯透明等,常规石蜡切片,番红-固绿进行双重染色,在莱卡DM-3000 显微镜下进行观察和拍照。
1.2.6 数据分析
使用SPSS 18.0 软件对数据进行单因素方差分析和相关性分析,通过Turkey检验进行差异显著分析。
2 结果与分析
2.1 不同基因型和不同采种时期胚性愈伤组织的诱导
通过观察,成熟胚在培养基中培养10 d,有部分胚开始膨大和萌发。在成熟胚四周形成少量愈伤组织,胚性愈伤组织为结节状愈伤组织,在外观形态上均呈乳白色或黄白色,结构致密(图1)。胚性愈伤诱导率因基因型不同而异(图2)。基因型GZGL 胚性愈伤诱导率最高(41.07%),比AHQM 和AHXN 分别高13.06%和21.44%,但与GZHX、GZPT、ZJLQ和ZJYK差异不显著(P<0.05)。
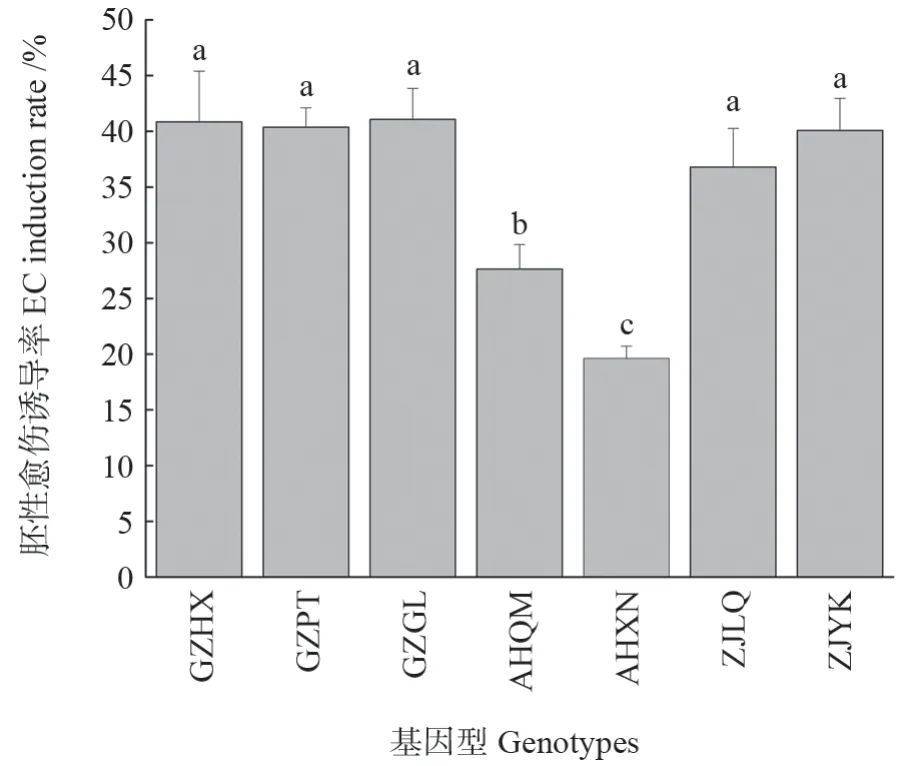
图2 7 个基因型对胚性愈伤诱导的影响Fig.2 Effects of seven genotypes on EC induction
未成熟胚在培养基中培养7~12 d,大部分未成熟胚膨大,尚未萌发;在未成熟胚周围诱导出的胚性愈伤与成熟胚诱导的胚性愈伤在质地上表现出相同的特征。胚性愈伤组织诱导率受采种时期影响较大,随采种时期的推迟呈先升高后降低的趋势(图3),T4 胚性愈伤诱导率最大(37.49 %),比T1 高10.49%,与T2、T3 和T5 差异不显著性(P<0.05)。
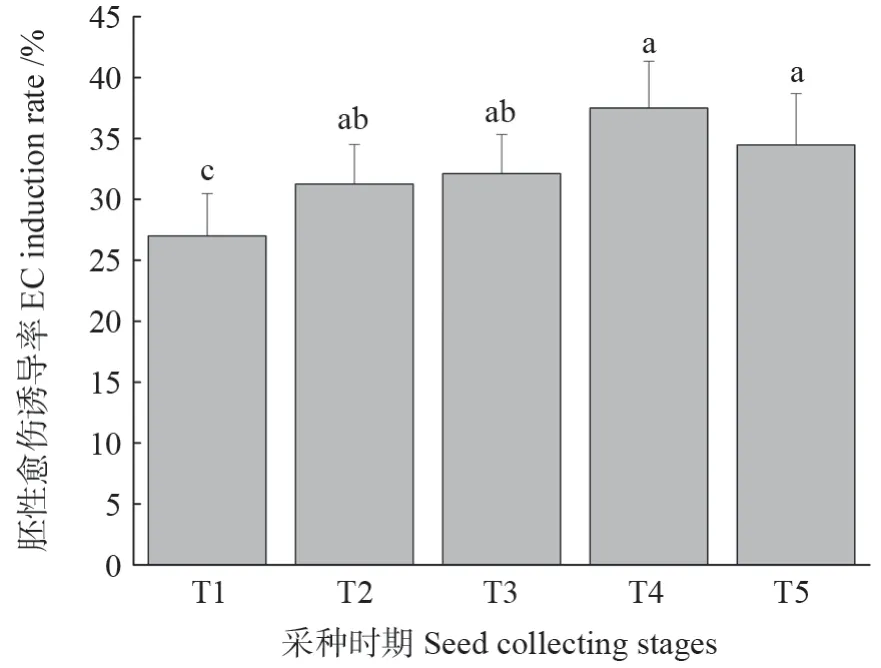
图3 5 个采种时期对胚性愈伤诱导的影响Fig.3 Effects of five seed collecting stages on EC induction
2.2 不同基因型和不同采种时期体胚诱导
胚性愈伤组织在体胚发生培养基中培养40 d,在胚性愈伤组织表面可观测到表面光滑、颗粒状的球形胚(图4),随着进一步的培养,可观察到体细胞胚的发育(图4g)。7 个基因型体胚发生诱导率具有显著性差异(图5),基因型GZPT的体胚发生诱导率最高(18.4%),比基因型GZHX、GZGL、ZJLQ、ZJYK、ANQM 分别高8%、11%、9%、10%、17%,而基因型ANXN 却观察不到体胚发生。
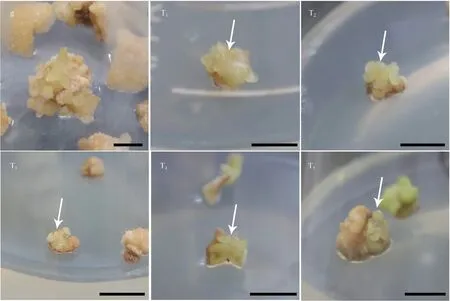
续图4Continuation of Fig.4
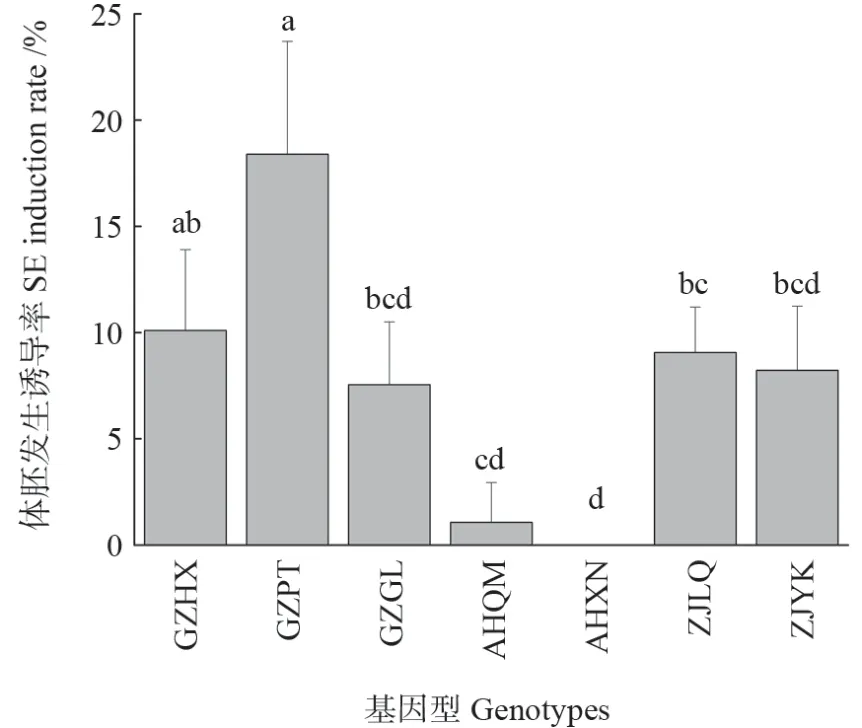
图5 7 个基因型对体胚发生诱导的影响Fig.5 Effects of seven genotypes on SE induction
5 个采种时期体胚发生诱导率呈先升高后降低的趋势(图6)。T4 体胚发生诱导率最高(14.2%),与T1、T2、T3、T5 差异不显著。
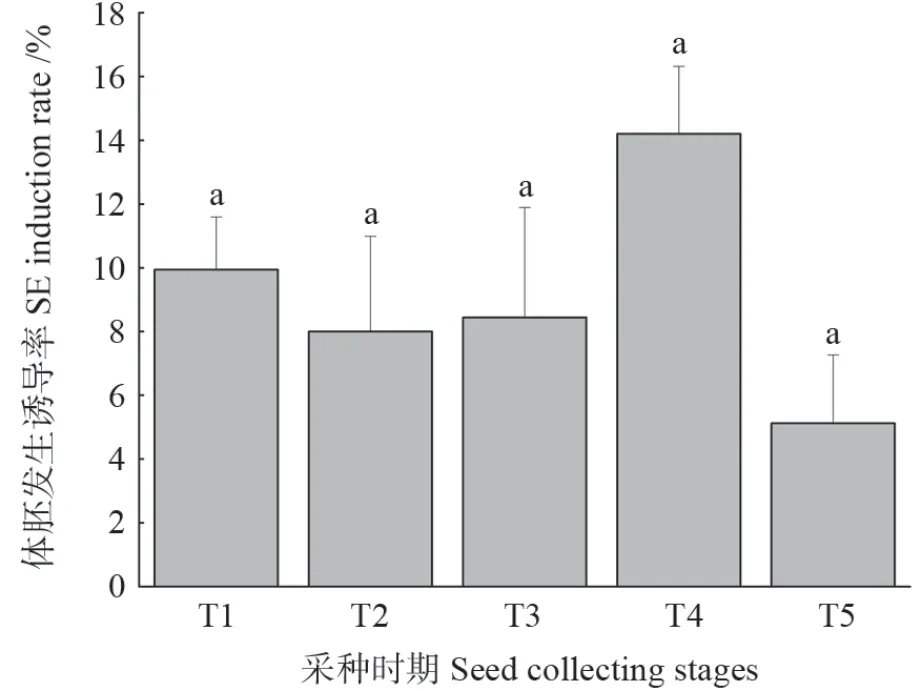
图6 5 个采种时期对体胚发生诱导的影响Fig.6 Effects of five seed collecting stages on SE induction
2.3 胚性愈伤组织生长和生化物质
2.3.1 不同基因型花榈木胚性愈伤组织生长和生化物质比较
7 个基因型胚性愈伤的重量增长随时间的增加类似“S”形曲线(图7)。其中,基因型GZPT、GZHX、ANQM 和AHXN 胚性愈伤组织的生长在15~20 d 之间斜率最大,表明生长速度最快;ZJLQ 和ZJYK 胚性愈伤生长速度在15~25 d之间最大;GZGL 胚性愈伤生长速度在18~25 d之间最大,但7 个基因型胚性愈伤的生长速度均在25~30 d 之间明显变缓。这说明不同基因型胚性愈伤组织的生长速率之间存在差异,随着生长时间的增加,胚性愈伤组织的生长速度均变缓,甚至停止生长。
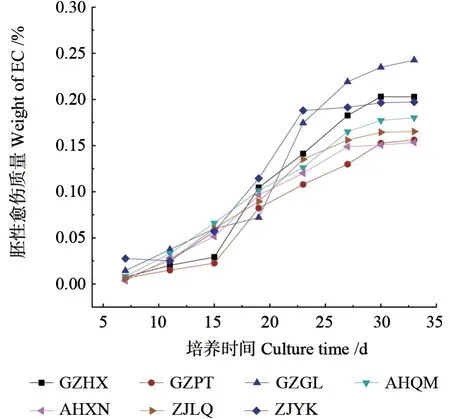
图7 7 个基因型胚性愈伤的生长曲线Fig.7 Growth curves of EC in seven genotypes
7 个基因型胚性愈伤组织可溶性蛋白、可溶性糖和淀粉含量差异显著(P<0.05)(图8)。基因型GZPT 胚性愈伤可溶性蛋白含量最高,比含量较低的基因型ZJLQ 和ZJYK 高约1.76 倍。基因型ZJLQ 胚性愈伤淀粉含量最高,比基因型GZHX、GZPT 和GZGL 分别高1.50、1.41 和1.56倍,但与AHQM、QHXN 和ZJYK 差异不显著(P<0.05)。基因型AHQM 胚性愈伤可溶性糖含量最高,而GZPT 含量最低。表明不同基因型胚性愈伤组织积累碳氮的能力不同。
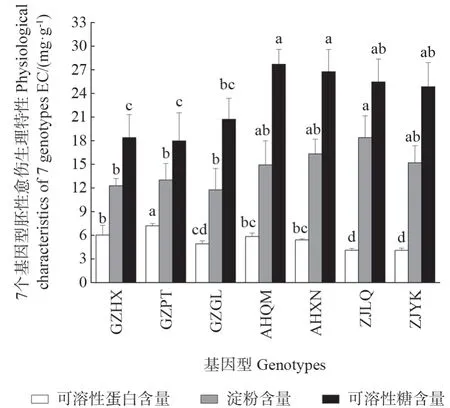
图8 7 个基因型胚性愈伤组织生化物质比较Fig.8 Comparison of biochemical substances of seven genotypes EC
2.3.2 不同采集时间花榈木胚性愈伤组织生长和生化物质比较
培养25 d 后,5 个采种时期胚性愈伤组织的重量增长差异不显著。但5 个采种时期未成熟胚诱导的胚性愈伤可溶性蛋白、淀粉、可溶性糖差异显著(P<0.05)(表2)。
T2 的胚性愈伤组织可溶性蛋白含量最大,是含量最低的T5 的1.41 倍。T1 诱导的胚性愈伤的可溶性糖和淀粉含量均最高。结果表明采种前期未成熟胚诱导出的胚性愈伤组织对碳氮积累能力较强且具有更高的生理活性。
2.4 相关性分析
对体胚发生诱导率与不同基因型种子特征和胚性愈伤生理特性的相关性分析,结果见表3。由表3得出,体胚诱导率与胚性愈伤诱导率呈极显著正相关,与基因型呈极显著负相关,与种子厚度的呈显著相关,与其他参数不具有相关性。由此可见,花榈木在不同基因型胚性愈伤组织的生长、生理特性及种子特征上虽然具有差异,但是它们的一些特性对体胚发生的相关性不大。这表明体胚发生诱导率是一个较为复杂的过程。
对体胚发生诱导率与不同采种时期种子特征和胚性愈伤生理特性的相关性分析,结果见表4。由表4得出,体胚发生诱导率仅与采种时期呈极显著负相关,与其他因子不具有相关性,特别是与胚性愈伤组织诱导率不具有相关性,这与不同采种时期胚性愈伤组织诱导率差异不显著有关。
2.5 愈伤组织结构及胚性愈伤的起源
观察发现,花榈木愈伤组织初期有两种愈伤类型,一种为乳白色,块状和硬实的愈伤组织是非胚性愈伤组织;另一种为黄白色和紧密的愈伤组织是胚性愈伤组织。通过组织学观察可见非胚性愈伤组织细胞较大、排列松散、空泡现象较多、染色浅、细胞质少、细胞核小甚至观察不到(图9a);而胚性愈伤组织细胞小、排列紧密、空泡现象较少、细胞质浓厚、细胞核明显的愈伤为胚性愈伤组织(图9b)。胚性愈伤在组织内部和组织周围均可观察得到,一种是起源于组织内部的胚性愈伤组织,由多细胞组织构成,四周有多层排列致密的薄壁细胞(图9c);另一种是起源于组织外部的胚性愈伤,与母体组织相连(图9d)。随着愈伤组织的进一步发育,在愈伤组织的表面有球状胚的分化(图9f)。此外,愈伤组织在继代过程中,在同一块愈伤组织上能够同时观察到胚性愈伤和非胚性愈伤组织,胚性愈伤从非胚性愈伤上长出(图9e)。
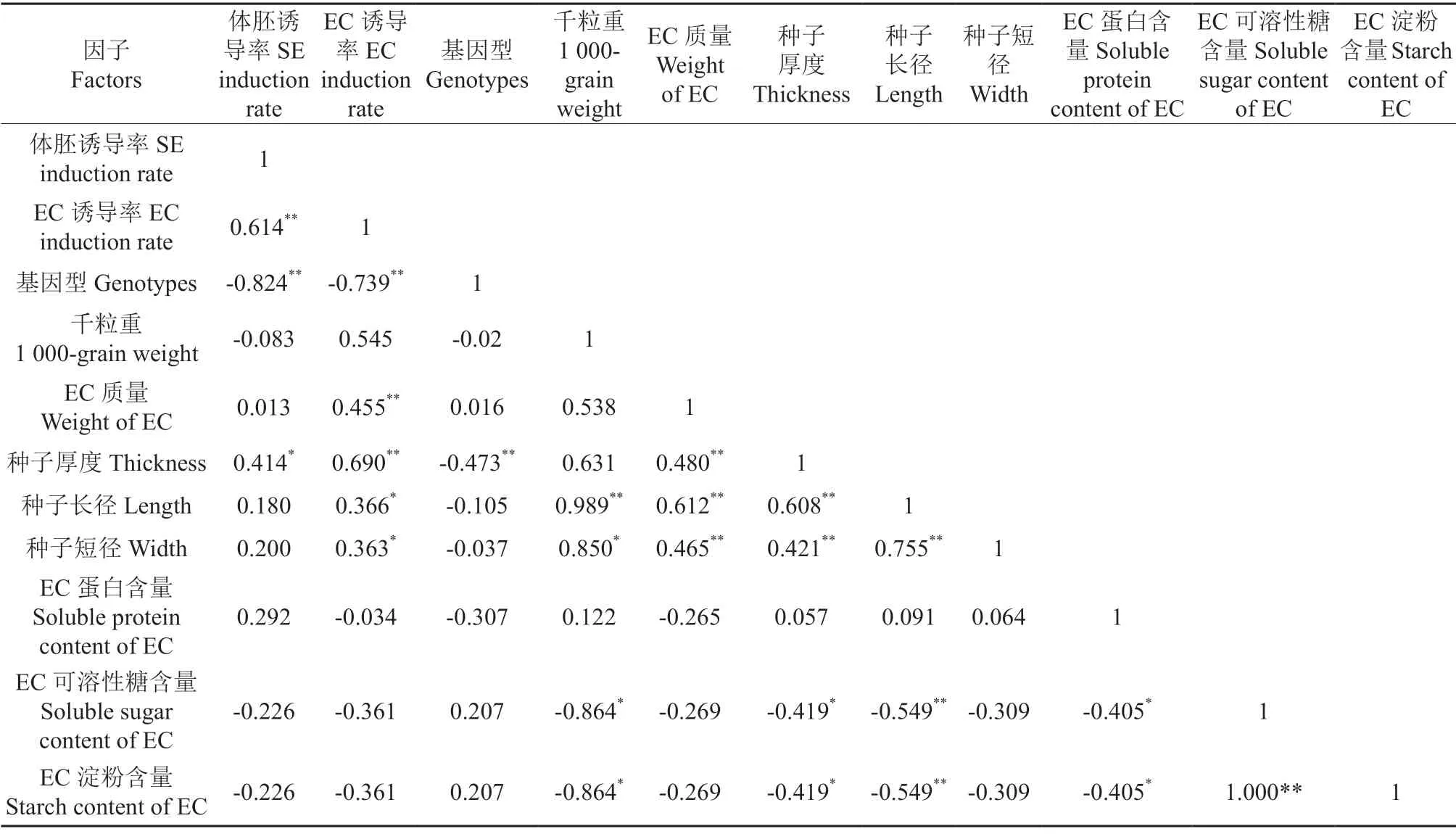
表3 体胚发生诱导率与不同基因型种子特征和胚性愈伤生理特性的相关性分析†Table 3 Correlation analysis of somatic embryogenesis induction rate with seed Characteristics of different genotypes and physiological characteristics of embryogenic callus
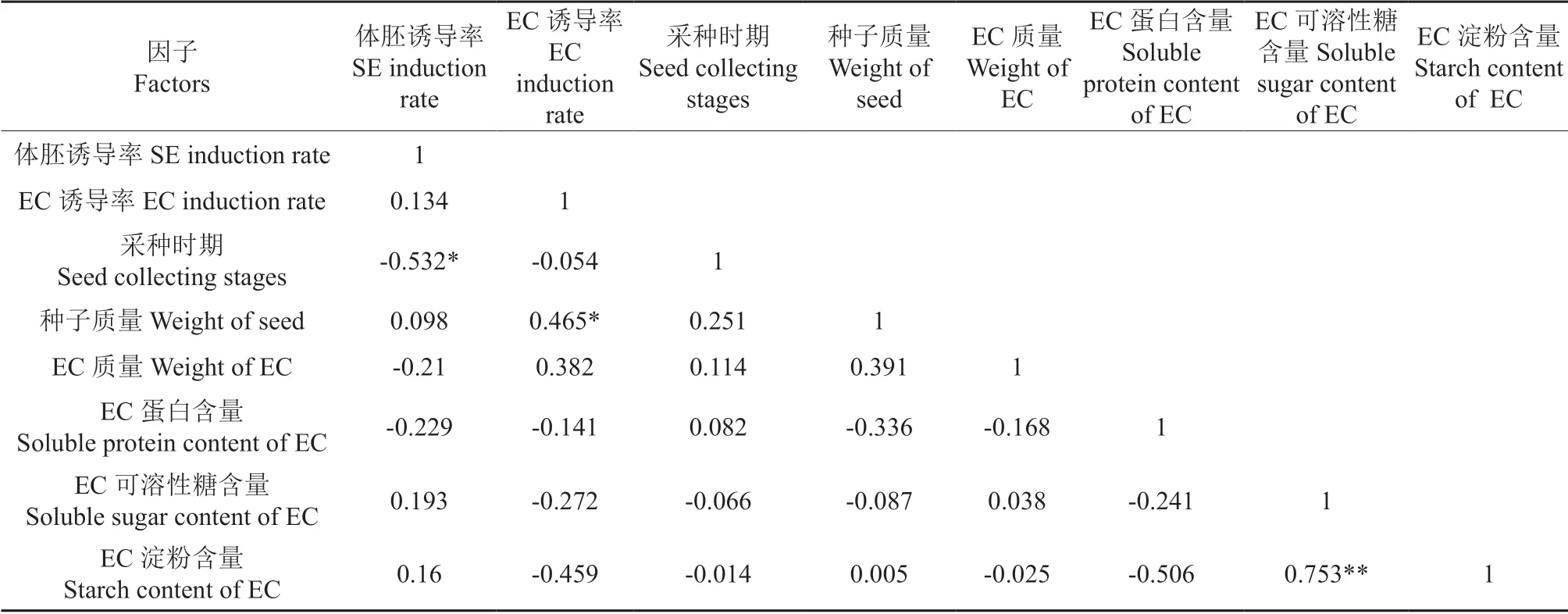
表4 体胚发生诱导率与不同采种时期种子特征和胚性愈伤生理特性的相关性分析Table 4 Correlation analysis of somatic embryogenesis induction rate with seed characteristics of collecting stages and physiological characteristics of embryogenic callus
3 讨 论
基因型对体外繁殖是一个重要的因子,特别是对体胚发生诱导[23-24]。在一些树种改良中,体胚发生这一生物技术的应用是依赖于树种基因型的[25]。展示7 株母树的种子除了在千粒重和表型上具有明显差异外,其胚性愈伤组织诱导率和体胚诱导率也存在差异。其中,贵州和浙江种源地采集的成熟胚胚性愈伤诱导率均在35%以上,而安徽种源地成熟胚胚性愈伤诱导率却均低于30%,基因型AHXN 尚未观察到体胚。Fehér[26]和Sultan[27]认为不同基因型的差异与它们的环境有着错综复杂的关系,环境对植物的形态、功能和发育有显著的影响;导致基因型在不同的条件下表现型是不同的[28],且植物克隆能力的大小是自然选择的结果,以应对外界不良环境使得后代得以繁衍。这些差异可能是造成体胚发生诱导率不同的原因。Hu 等[18]和Correia 等[23]报道可通过改变和优化培养条件来减小不同基因型体胚发生诱导率之间的差异;此外,为了获得更高频体胚发生诱导率,还可扩大对基因型的筛选范围。
胚性愈伤组织生理生化变化受外界因素影响较大。在花榈木7 个基因型中,胚性愈伤可溶性蛋白含量在贵州种源(GZHX、GZPT 和GZGL)较 安 徽(ANQM 和ANXN) 和 浙 江(ZJLQ 和ZJYK)种源高,而胚性愈伤可溶性糖和淀粉含量在安徽和浙江种源却高于贵州种源。这种生理上的差异可能是由于它们处于不同气候和不同地域条件下引起差异基因表达,从而导致碳、氮代谢具有差异的原因。

图9 细胞组织结构Fig.9 Histologial studies
7 个基因型成熟胚诱导出的胚性愈伤在培养基中生长速率呈先慢后快再慢的趋势,生长曲线呈“S”形,这与范建芝[21]研究北美乔松中两个细胞系愈伤生长曲线结果一致。北美乔松两个细胞系愈伤生长速率最大值均在5~10 d 之间;红松愈伤最大生长速率在12 d 左右,20 d 后增长趋于停滞[21];而花榈木不同基因型胚性愈伤组织最大生长速率的时间不同,但均在15~25 d 之间,表明花榈木胚性愈伤生长速率比北美乔松和红松慢。一般情况下,以外植体生长速率变缓为最佳继代时间,北美乔松和红松胚性愈伤最佳继代时间为2~3 周,而花榈木最佳继代时间为25 d。
大量研究表明未成熟胚是体胚发生诱导较为理想的外植体,未成熟胚的成熟度显著影响体胚发生响应。本实验得出体胚发生诱导率随未成熟胚采种时期的推迟呈先升高后降低的趋势,T4 体胚诱导率达到最大值,这表明不同发育时期未成熟胚在相同培养条件下产生不同的胚性反应。选择适宜的采种时期可获得更高体胚发生频率,这在杉木[18]和辐射松[14]中有类似报道。Hu 等报道从卵裂多胚胎到明显胚胎阶段的未成熟合子胚胎对胚性愈伤组织的诱导反应最为敏感。未成熟胚体胚发生的响应可能与其生理状况[29]和形态建成[30]有关。
花榈木愈伤组织有两种类型,一种是外植体诱导出的愈伤组织进入胚性途径为胚性愈伤,而另一些细胞形成非胚性愈伤组织。两种愈伤在外观形态和组织结构上具有较大的差异。这两种类型的愈伤组织是源于不同细胞类型还是细胞内外微环境触发了不同形态发生?其原因尚未清楚。类似的研究在树番茄[23]、冬青栎[31]和杉木[18]等中均有发现。胚性愈伤经生长发育后在形态学上类似于合子胚[9],最终发育成与母本性状一致的再生植株,而非胚性愈伤却不能[32]。本试验发现非胚性愈伤组织表面能够观察到黄白色、致密的胚性愈伤组织;这表明在适宜条件下,非胚性愈伤组织可以诱导出胚性愈伤组织。从花榈木胚性愈伤的细胞结构观察到胚性愈伤组织的起源方式即有内起源,又有外起源,这与项伟波[33]研究香榧胚性愈伤组织的起源方式一样;崔凯荣等[34]认为体细胞胚胎发生起源方式可能与培养细胞在特定培养条件下是否是胚胎预决定细胞有关。尽管植物细胞可塑性强具有全能性的特点,但同种外植体在相同环境条件下却具有不同的发育命运。虽然细胞预决定和细胞全能性可以部分解释体胚发生起源机制,但细胞的起源仍然是现代生命科学中未解的最大谜团之一,要真正揭示植物细胞胚胎发生的起源机制还需要进一步的深入研究。而花榈木胚性愈伤组织的内起源和外起源可为今后探索细胞起源的机理提供参考。
4 结 论
本研究表明花榈木7 个基因型成熟胚和5 个采种时期未成熟胚对胚性愈伤诱导和体胚诱导具有显著影响,且它们诱导出的胚性愈伤在生理生化上具有较大的差异;其中,胚性愈伤诱导率以基因型GZGL 和T4 最高;体胚发生诱导率以GZPT 和T4 最高。筛选出体胚高频诱导率的基因型,并发现未成熟胚的采种时期对体胚诱导率有一个窗口期,这可为花榈木体胚诱导筛选适宜的繁殖材料提供参考。
