细菌药物钝化酶基因分布及其表达诱导与抑制机制的研究
2013-05-31吴亦斐孙爱华赵金方葛玉梅
吴亦斐,孙爱华,赵金方,葛玉梅,严 杰
(1.浙江大学医学院病原生物学系,浙江 杭州 310058;2.浙江医学高等专科学校,浙江 杭州 310053;3.浙江中医药大学附属第一医院检验科,浙江 杭州 310006)
细菌耐药性及耐药细菌的流行是当前人类面临的重大医学问题之一[1-3]。金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯菌是临床常见病原菌[4-6]。临床标本中鲍曼不动杆菌和阴沟肠杆菌分离率虽较低,但这两种细菌耐药率较高且耐药性较强[7-8]。β-内酰胺类(青霉素类和头孢菌素类)和氨基糖苷类是临床常用抗生素,无论是国内还是国外不同国家和地区分离的金黄色葡萄球菌及上述肠道细菌临床菌株,对这两类抗生素耐药率很高[1-2,9-10],其耐药机制主要是产生药物钝化酶[11]。尽管有不少国外文献报道了药物钝化酶基因在临床菌株中的分布,但国内对此研究报道甚少。
感染是病原微生物与宿主相互作用及信息交换和应答的过程,细菌耐药也不例外。二元信号传导系统(TCSS)是细菌接受环境信号并作出适应性反应的物质基础,通常由接受并传递信号跨膜组氨酸激酶和调控靶基因胞浆应答调节因子组成[12],氯氰碘柳胺(closantel)可通过抑制组氨酸激酶激活而阻断细菌信号传导[13]。我们认为,细菌通过TCSS感受环境中抗生素并上调药物钝化酶基因表达,应当是细菌耐药的主要机制。本研究中,我们检测了金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯菌等临床菌株β-内酰胺类、氨基糖苷类和大环内酯类钝化酶基因及其分布,同时对抗生素上调及氯氰碘柳胺抑制药物钝化酶基因表达的作用进行了初步的研究。
1 材料与方法
1.1 临床耐药菌株来源及耐药性检测 133株对β-内酰胺类、氨基糖苷类或大环内酯类抗生素耐药的菌株由浙江大学医学院附属第二医院、浙江省人民医院、宁波市妇女儿童医院检验科提供。各菌株经VITEK2型全自动细菌检测分析系统及其配套的细菌鉴定卡GPI进行鉴定,其中金黄色葡萄球菌30株、大肠埃希菌63株、肺炎克雷伯菌28株、鲍曼不动杆菌8株、阴沟肠杆菌4株。采用2011年美国临床及实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)推荐的微量肉汤稀释法测定上述菌株耐药性。
1.2 E-test根据2011年美国CLSI介绍的实验步骤,采用E-test测定上述临床菌株对青霉素、头胞噻肟和链霉素的最低抑菌浓度(minimal inhibitory concentration,MIC),E-test纸片为法国bioMérieux公司产品。质控标准菌株金黄色葡萄球菌 ATCC25923、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853购自北京中国生物制品药品检定所。
1.3 细菌基因组DNA制备 采用细菌基因组DNA提取试剂盒(GENEray)提取各受试菌株基因组DNA,紫外分光光度法测定其浓度和纯度[14]。
1.4 药物钝化酶基因检测 采用PCR法。根据文献报道的引物序列[15-19],委托上海Invitrogen公司合成各引物(表1)。采用高保真PCR试剂盒(TaKaRa)检测各菌株中药物钝化酶基因片段,反应总体积 100 μl,内含 2.5 mol/L dNTP、200 nmol/L 各引物、20 mol/L MgCl2、2.5U EX-Taq DNA 聚合酶、100 ng DNA模板和1×PCR缓冲液(pH 8.3)。PCR参数:94℃ 5 min;94℃ 30 s、52℃ 30 s、72℃ 120 s,30个循环;72℃ 10 min。采用溴乙锭预染色的1.5%琼脂糖凝胶电泳检测PCR结果。
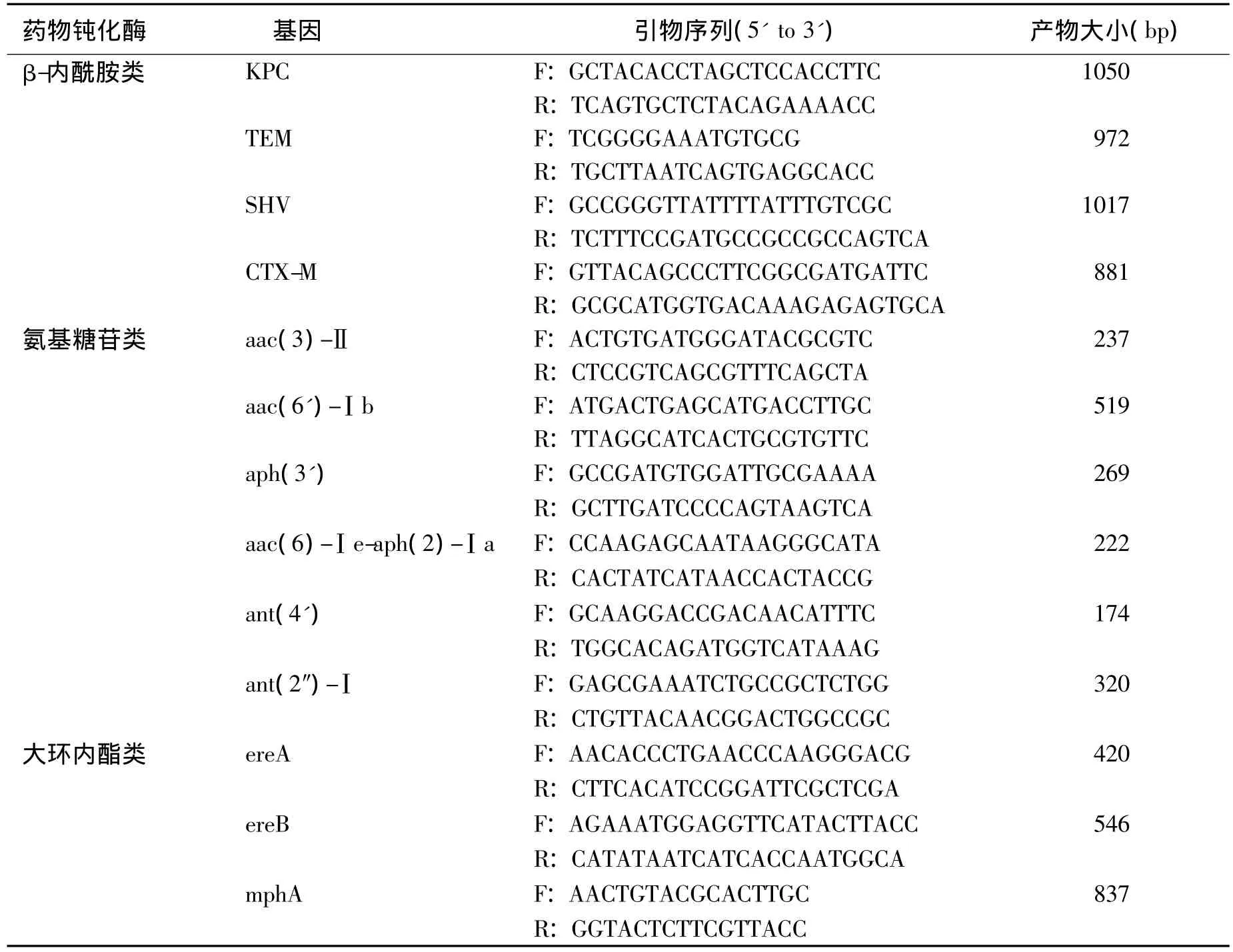
表1 PCR中使用的引物及其序列Table 1 Primers and their sequences used in PCR
1.5 扩增产物测序及分析 采用PCR产物纯化试剂盒(BioColor)回收各靶基因扩增片段,采用T-A克隆试剂盒(TaKaRa)将其克隆至pMD-19T质粒中,然后电转化入E.coli DH5α(Invitrogen)并在LB培养液(Oxoid)中扩增,氨苄西林和蓝白斑双重筛选后委托上海Invitrogen公司测序[14]。采用BLAST软件对测序结果进行分析和比较。
1.6 抗生素诱导及组氨酸激酶阻断 有4株大肠埃希菌分别仅含KPC、TEM、SHV或CTXM β-内酰胺类钝化酶基因,有1株大肠埃希菌和1株鲍曼不动杆菌分别仅含aac(6')-Ⅰb和aac(3)-Ⅱ氨基糖苷类钝化酶基因。另两种氨基糖苷类钝化酶基因aph(3')和aac(6)-Ⅰeaph(2)-Ⅰa仅发现于金黄色葡萄球菌。上述菌株新鲜培养物中加入1/4 MIC的青霉素、头胞噻肟或链霉素37℃作用1 h,观察其诱导β-内酰胺类或氨基糖苷类钝化酶基因表达的作用。上述菌株中先加入100 μmol/L组氨酸激酶阻断剂氯氰碘柳胺(Sigma)[13],37℃作用30 min,然后按上法加入青霉素、头胞噻肟或链霉素37℃作用1 h,以观察氯氰碘柳胺抑制抗生素诱导β-内酰胺类或氨基糖苷类钝化酶基因表达上调的作用。
1.7 细菌总RNA制备及cDNA合成 上述药物诱导、组氨酸激酶阻断、未药物诱导及组氨酸激酶阻断的各菌株培养物5000 r/min离心15 min(4℃),取沉淀用0.01 mol/L PBS洗涤并离心2次,取细菌沉淀采用 TRIzol试剂(Life Technologies)提取总RNA,采用分光光度法测定总 RNA提取物的浓度和纯度[14]。参照PrimeScript反转录试剂盒(TaKaRa)说明书,将等量各细菌总RNA逆转录得到cDNA。逆转录产物用去离子水稀释5倍后作为实时荧光定量RT-PCR模板。
1.8 实时荧光定量 RT-PCR 采用 Primer Premier 6.0软件设计各药物钝化酶编码基因实时荧光定量RT-PCR引物,16S rRNA编码基因为内参照(表2)。引物委托上海Invitrogen公司合成。采用SYBR Premix Ex TaqTM荧光定量PCR试剂盒(TaKaRa)在LightCycler 480实时荧光定量PCR仪(Roche)上进行扩增。反应体系 20 μl,内含 0.2 μmol/L 各引物和 2 μl稀释逆转录产物为模板。反应参数:95℃ 30 s,95℃ 5 s、60℃ 20 s,40个循环。获得的实时荧光定量PCR结果用ΔΔCt相对定量法进行定量[20],采用 t检验进行统计分析,P <0.01 认为差异有显著性。

表2 实时荧光定量RT-PCR中使用的引物及其序列Table 2 Primers and their sequences used in real-time fluorescent quantitative RT-PCR
2 结果
2.1 E-test结果 各菌株青霉素、头胞噻肟或链霉素的 MIC 分别为≥32 μg/ml、4 ~ ≥32 μg/ml和≥32 μg/ml。
2.2 PCR及其产物测序结果 在4种β-内酰胺类、6种氨基糖苷类、3种大环内酯类钝化酶基因中,可检出所有β-内酰胺类钝化酶基因(KPC、TEM、SHV、CTX-M)、4 种氨基糖苷类钝化酶基因(aac(6')-Ⅰb、aac(3)-Ⅱ、aph(3')、aac(6)-Ⅰe-aph(2)-Ⅰa)、1 种大环内酯类钝化酶基因(mphA)(图1)。与GenBank中公布的序列(基因/登录号:KPC-2/NC_014312.1、TEM-1/NC_014843.1、SHV-5/NC_004998.1、CTX-M-14/NC_014615.1、aac(3')-Ⅱ/NC_014615.1、aac(6')-Ⅰ b/NC_005327.1、aph(3')/NC_013294.1、aac(6)-Ⅰe-aph(2)-Ⅰa/NC_013344.1、mphA/NC_014231.
1)比较,上述药物钝化酶基因扩增产物核苷酸序列相似性高达99.9% ~100%。
2.3 大肠埃希菌药物钝化酶基因种类及携带模式 63株耐药菌株中,检出4种β-内酰胺类钝化酶基因(KPC、TEM、SHV、CTX-M)、2 种氨基糖苷类钝化酶基因(aac(6')-Ⅰb、aac(3)-Ⅱ)和1种大环内酯类钝化酶基因(mphA);除5株(7.9%,5/63)仅携带 KPC、TEM、SHV、CTX-M 或 aac(6')-Ⅰb 基因外,其余 58 株(92.1%,58/63)均联合携带β-内酰胺类+氨基糖苷类钝化酶基因、β-内酰胺类+氨基糖苷类+大环内酯类钝化酶基因;其中16株(25.4%,16/63)同时携带三类药物钝化酶基因;TEM+CTX-M]+aac(3)-Ⅱ +mphA、13株(20.6%,13/63)同时携带两类药物钝化酶基因[TEM+CTX-M]+aac(6')-Ⅰb而成为优势模式(表3)。
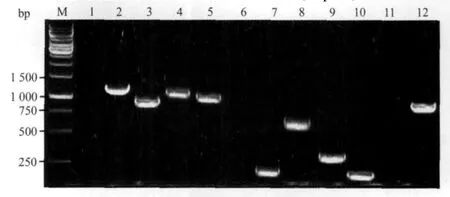
图1 不同药物钝化酶基因扩增条带Fig.1 Amplification fragments of different inactive enzymeencoding genes
2.4 金黄色葡萄球菌药物钝化酶基因种类及携带模式 30株耐药菌株中,6株(20.0%,6/30)未检出药物钝化酶基因。其余24株(80.0%,24/30)菌株中,检出2种β-内酰胺类钝化酶基因(TEM、CTX-M)、3种氨基糖苷类钝化酶基因(aph(3')、aac(6)-Ⅰe-aph(2)-Ⅰa、aac(3)-Ⅱ)。除4株同时携带多个β-内酰胺类+氨基糖苷类钝化酶基因外,其余均仅携带氨基糖苷类钝化酶基因,其中10株(41.7%,10/24)和6株(25.0%,6/24)分别携带单个氨基糖苷类钝化酶基因aph(3')和aac(6)-Ⅰeaph(2)-Ⅰa而成为优势模式(66.7%,16/24)、4株(16.7%,4/24)同时携带两个氨基糖苷类钝化酶基因[aph(3')+aac(6)-Ⅰe-aph(2)-Ⅰa](表4)。
2.5 肺炎克雷伯菌药物钝化酶基因种类及携带模式 28株耐药菌株中,检出4种β-内酰胺酶基因(SHV、TEM、CTX-M、KPC)、2 种氨基糖苷类钝化酶基因(aac(6')-Ⅰb、aac(3)-Ⅱ)和1种大环内酯类钝化酶基因(mphA)。除1株仅携带单个β-内酰胺类钝化酶基因SHV外,其余均携带两类或三类药物钝化酶基因,其中8株(28.6%,8/28)同时携带β-内酰胺类+氨基糖苷类钝化酶基因[TEM+SHV]+[aac(6')-Ⅰb+aac(3)-Ⅱ]、5 株(17.8%,5/28)同时携带 2个β-内酰胺类+2个氨基糖苷类+大环内酯类钝化酶基因[TEM+SHV]+[aac(6')-Ⅰb+aac(3)-Ⅱ]+mphA而成为优势模式(表5)。

表3 63株大肠埃希菌药物钝化酶基因种类及携带模式Table 3 Types of drug inactive enzyme genes and carrying model of 63 E.coli isolates

表4 24株金黄色葡萄球菌药物钝化酶基因种类及携带模式Table 4 Types of drug inactive enzyme genes and carrying model of 24 S.aureus isolates

表5 28株肺炎克雷伯菌药物钝化酶基因种类及携带模式Table 5 Types of drug inactive enzyme genes and carrying model of 28 K.pncumoniae isolates
2.6 鲍曼不动杆菌药物钝化酶基因种类及携带模式 8株耐药菌株中,检出2种β-内酰胺类钝化酶基因(TEM、CTX-M)、1种氨基糖苷类钝化酶基因(aac(3)-Ⅱ),其中5株(62.5%,5/8)同时携带β-内酰胺类基因TEM+氨基糖苷类钝化酶基因aac(3)-Ⅱ而成为优势模式(表6)。
2.7 阴沟肠杆菌药物钝化酶基因种类及携带模式 4株耐药菌株中,检出1种β-内酰胺类钝化酶基因(TEM)、2种氨基糖苷类钝化酶基因(aac(6')-Ⅰb、aac(3)-Ⅱ)、1 种大环内酯类钝化酶基因mphA。除1株携带单个大环内酯类钝化酶基因mphA外,其余均同时携带两类或三类药物钝化酶基因(表7)。

表6 8株鲍曼不动杆菌药物钝化酶基因种类及携带模式Table 6 Types of drug inactive enzyme genes and carrying model of 8 A.baumanii isolates

表7 4株阴沟肠杆菌药物钝化酶基因种类及携带模式Table 7 Types of drug inactive enzyme genes and carrying model of 4 E.cloacae isolates
2.8 不同钝化酶基因携带频率 上述133株受检菌株中,有6株未检出药物钝化酶基因。在127株检出药物钝化酶基因菌株中,4个β-内酰胺类钝化酶基因出现频率从高至低依次为TEM(87/127)、CTX-M(59/127)、SHV(30/127)和KPC(3/127),4个氨基糖苷类钝化酶基因出现频率从高至低依次为aac(3)-Ⅱ(74/127)、aac(6')-Ⅰb(51/127)、aph(3')(16/127)和aac(6)-le-aph(2)-la(10/127)。大环内酯类钝化酶基因mphA出现频率为41/127。
2.9 抗生素诱导及组氨酸激酶阻断剂抑制药物钝化酶基因表达的效果 在4株分别仅含 KPC、TEM、SHV或 CTX-M β-内酰胺类钝化酶基因的大肠埃希菌中,除β-内酰胺类钝化酶基因KPC外,其余3种β-内酰胺类钝化酶基因(TEM、SHV、CTX-M)在加入1/4 MLC的青霉素或头胞噻肟后表达水平显著上调(P<0.01);加入组氨酸激酶阻断剂氯氰碘柳胺后,上述青霉素或头胞噻肟诱导药物钝化酶基因表达上调的现象消失(P<0.01)(图2)。1株仅含aac(6')-Ⅰb氨基糖苷类钝化酶基因的大肠埃希菌、1株仅含aac(3)-Ⅱ氨基糖苷类钝化酶基因的鲍曼不动杆菌、2株分别含aph(3')和aac(6)-Ⅰe-aph(2)-Ⅰa氨基糖苷类钝化酶基因的金黄色葡萄球菌菌液中加入1/4 MLC的链霉素后作用1 h,各靶基因表达水平显著上调(P<0.01),但上述钝化酶基因表达水平上调可被氯氰碘柳胺所抑制(P<0.01)(图3)。
3 讨论
与欧美国家或地区比较,亚洲地区分离的金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯菌对β-内酰胺类和氨基糖苷类抗生素耐药率一直较高[2,21]。我国分离的金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯菌临床菌株对β-内酰胺类和氨基糖苷类抗生素耐药率分别高达45%~95%、55% ~ 75% 和 35% ~ 70%[9,10,22]。目前认为,细菌耐药机制主要有产生药物钝化酶、受体突变、抗生素摄取减少和外排,其中产生药物钝化酶是细菌高耐药性的主要原因[11]。因此,系统地检测临床耐药菌株所含药物钝化酶基因对于了解细菌耐药机制具有重要意义。
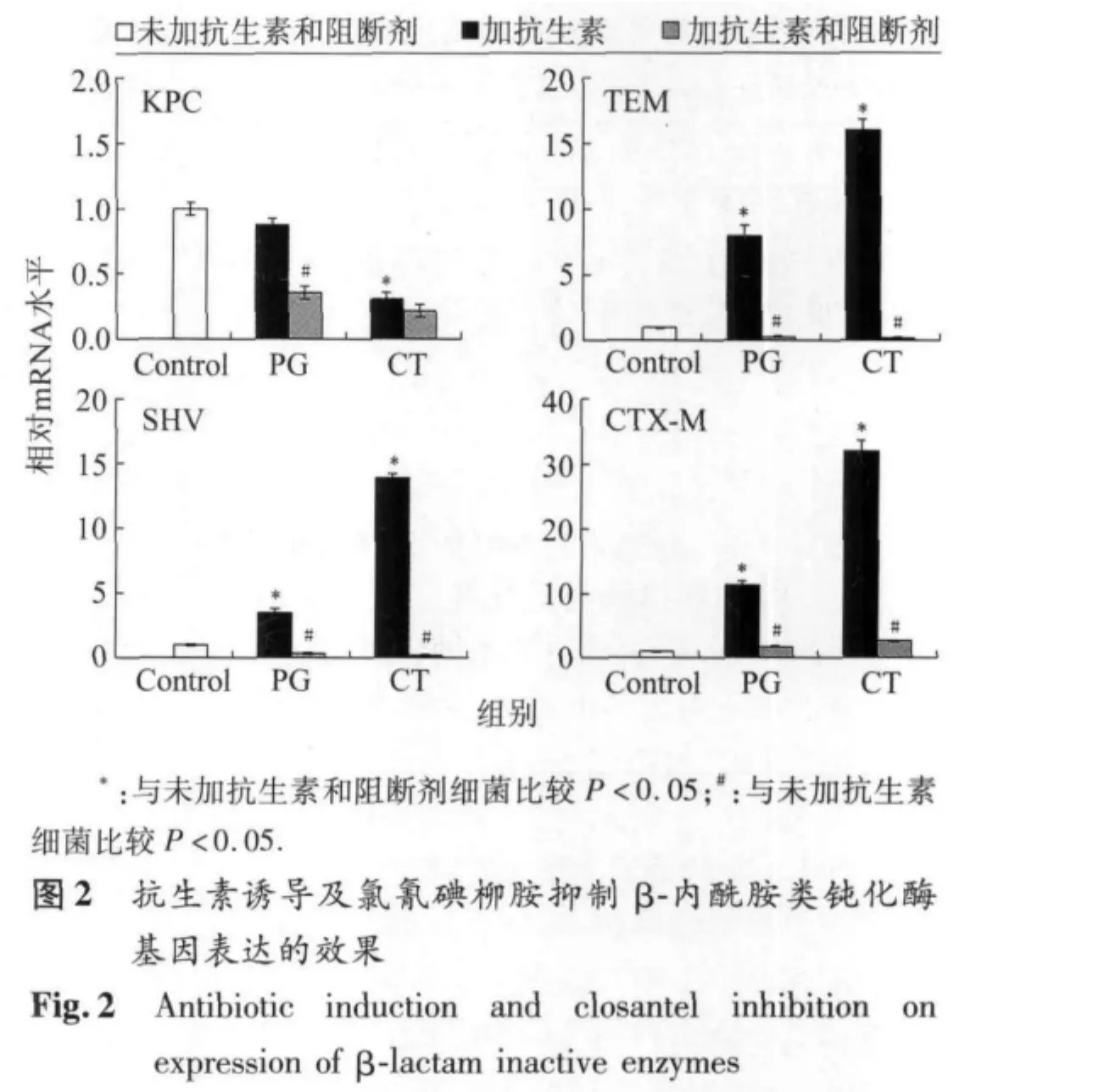
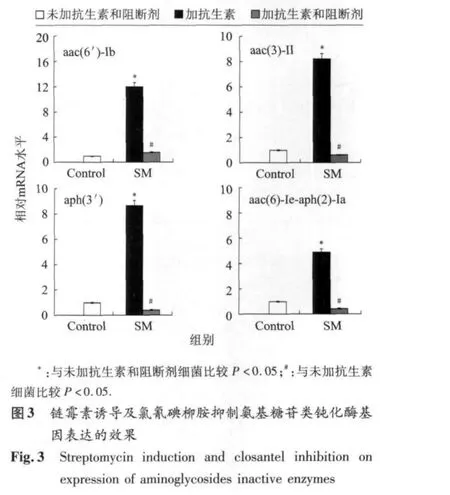
本研究中,我们检测了4种常见β-内酰胺类、6种氨基糖苷类、3种大环内酯类钝化酶基因,但在受检的30株金黄色葡萄球菌、63株大肠埃希菌、28株肺炎克雷伯菌、8株鲍曼不动杆菌和4株阴沟肠杆菌中,可检出所有β-内酰胺类钝化酶基因(KPC、TEM、SHV、CTX-M),但仅能发现4种氨基糖苷类钝化酶基因(aac(6')-Ⅰb、aac(3)-Ⅱ、aph(3')、aac(6)-Ⅰe-aph(2)-Ⅰa)和1种大环内酯类钝化酶基因(mphA),表明上述细菌携带另两种氨基糖苷类钝化酶基因ant(4')和ant(2″)-Ⅰ、大环内酯类钝化酶基因ereA和ereB的频率不高。
我们的PCR实验结果显示,检出药物钝化酶基因的24株金黄色葡萄球菌中,仅4株携带β-内酰胺类钝化酶基因(TEM、CTX-M),但有20株分别携带单个氨基糖苷类钝化酶基因aph(3')(16 株)或 aac(6)-Ⅰe-aph(2)-Ⅰa(4 株)(表4),这与以往认为革兰阳性的金黄色葡萄球菌应携带β-内酰胺类钝化酶基因的观念有较大差别。我们的实验结果还显示,无论是大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌和阴沟肠杆菌,除少数菌株携带单个药物钝化酶基因外,大多同时携带2~5种、两类或三类药物钝化酶基因(表3,5~7),表明这些革兰阴性肠道杆菌耐药机制较金黄色葡萄球菌更为复杂。在受检的大肠埃希菌中,优势基因携带模式为[TEM+CTX-M]+aac(3)-Ⅱ+mphA(25.4%)和[TEM+CTX-M]+aac(6')-Ⅰb 13 株(20.6%),肺炎克雷伯菌则为[TEM+SHV]+ [aac(6')-Ⅰb+aac(3)-Ⅱ](28.6%)和[TEM+SHV]+[aac(6')-Ⅰb+aac(3)-Ⅱ]+mphA(17.8%)。
众所周知,在信号传导过程中,激酶大多磷酸化被激活,细菌组氨酸激酶也不例外。组氨酸激酶一般工作机制是,胞外区接受信号后,通过跨膜区使胞内区变构,胞内区ATP结合位点与ATP后特定组氨酸被磷酸化,氯氰碘柳胺抑制组氨酸的机制是阻断其胞内区组氨酸磷酸化[23-24]。我们曾发现,肺炎链球菌TCSS与细菌耐药性产生密切相关[23,25]。令人感兴趣的是,除β-内酰胺类钝化酶基因KPC外,我们发现加入低浓度(1/4 MIC)的青霉素或头胞噻肟能使 TEM、SHV、CTX-M β-内酰胺类钝化酶基因表达水平显著上调(P<0.01),1/4 MLC的链霉素也能诱导大肠埃希菌、金黄色葡萄球菌、鲍曼不动杆菌4种氨基糖苷类钝化酶基因表达水平显著上调(P<0.01),加入氯氰碘柳胺后除上述诱导药物钝化酶基因表达上调的现象消失(P<0.01),提示上述抗生素有可能作为信号分子激活耐药相关TCSS而上调药物钝化酶基因表达水平,由于组氨酸激酶阻断剂氯氰碘柳胺能抑制上述药物钝化酶基因表达水平升高,表明抗生素可能具有激活组氨酸激酶的功能。
[1]LIVERMORE D M.Fourteen years in resistance[J].Int J Antimicrob Agents,2012,39(4):283-294.
[2]LESTARI E S,SEVERIN J A,VERBRUGH H A.Antimicrobial resistance among pathogenic bacteria in Southeast Asia[J].Southeast Asian J Trop Med Public Health,2012,43(2):385-422.
[3]SUN A H,FAN X L,GU Yi,et al.Predominant porB1A and porB1B genotypes and correlation of gene mutations with drug resistance in Neisseria gonorrhoeae isolates in Eastern China[J].BMC Infect Dis,2010,10:323-331.
[4]FARREL D J,CASTANHEIRA M,MENDES R E,etal.In vitro activity ofceftaroline against multidrug-resistant Staphylococcus aureus and Streptococcus pneumoniae:a review of published studiesandtheAWARE SurveillanceProgram(2008-2010) [J].Clin Infect Dis,2012,55(Suppl 3):S206-214.
[5]YU Yunsong,LV Fangfang,SONG Xiulan(俞云松,吕芳芳,宋秀兰,等),et al.Encoding genes and genotypes of β-lactamases produced by a multiple resistant Klebsiella pneumoniae[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报医学版),2002,31(6):457-460.
[6]ZHANG Wei,LIU Kaizhong(张 维,柳开忠).Mechanisms of carbapenems resistance in Acinetobacter and progress oftreatment [J].Journal of Zhejiang University:Medical Sciences(浙江大学学报医学版),2010,39(5):542-547.(in Chinese)
[7]MEZZATESTAM L,GONA F,STEFANIS.Enterobacter cloacae complex:clinical impact and emerging antibiotic resistance [J].Future Microbiol,2012,7(7):887-902.
[8]BEREKET W,HEMALATHA K,GETENET B,et al.Update on bacterial nosocomial infections [J].Eur Rev Med Pharmacol Sci,2012,16(8):1039-1044.
[9]ZHUO Chao,Su Danhong,NI Yuxing,et al(卓超,苏丹虹,倪语星,等).CHINNET 2009 surveillance of antimicrobial resistance in E.coli and Klebsiella spp in China [J].Chinese Journal of Infection and Chemotherapy(中国感染与化疗杂志),2010,10(6):430-435.(in Chinese)
[10]JIANG Wei,CHANG Dong,HUANG Zhihong(蒋伟,常 东,黄志红,等),et al.Analysis of current drug resistance in bacterial isolates in clinic[J].Chinese Journal of Nosocomiology(中华医院感染学杂志),2002,12(9):646-653.(in Chinese)
[11]DAVIES J.Inactivation of antibiotics and the dissemination of resistance genes[J].Science,1994,264(5157):375-382.
[12]CASINO P, RUBIO V, MARINA A. The mechanism of signal transduction by twocomponent systems[J].Curr Opin Struc Biol,2010,20(6):763-771.
[13]KUMAGAIY,CHENG Z,LIN M,etal.Biochemical activities of three pairs of Ehrlichia chaffeensis two-component regulatory system proteins involved in inhibition of lysosomal fusion[J].Infect Immun,2006,74(9):5014-5022.
[14]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular Cloning:A LaboratoryManual[M].2nd edition,New York:Cold Sping Harbor Labooratory Press,1989,1.21-1.52,2.60-2.80,7.3-7.35,9.14-9.22.
[15]YIGIT H,QUEENAN A M,ANDERSON G J,et al.Novel carbapenem-hydrolyzing beta-lactamase,KPC-1,from acarbapenem-resistantstrain of Klebsiella pneumoniae[J].Antimicrob Agents Chemother,2001,45(4):1151-1161.
[16]YU Y,JI S,CHEN Y,et al.Resistance of strains producing extended-spectrum beta-lactamases and genotype distribution in China [J].J Infect,2007,54(1):53-57.
[17]NUESCH-INDERINEN M T,HACHLER H,KAYSER F H.Detection of genes coding for extended-spectrum SHV beta-lactamases in clinical isolates by a moleculargenetic method,and comparison with E test[J].Eur J Clin Microbiol Infect Dis,1996,15(5):398-402.
[18]JOS A M,van KLUNDERT D,VLIEGENTHART J S.PCR detection of genes coding for aminoglycoside-modifyingenzymes.In:Persing DH,Smith TF,Tenover FC,White TJ,editors.Diagnostic Molecular Microbiology Principles and Applications.Washington,DC:American Society for Microbiology,1993,547-552.
[19]SUTCLIFFE J,GREBE T,TAIT-kAMRADT A,et al.Detection of erythromycin-resistant determinants by PCR [J].Antimicrob Agents Chemother,1996,40(11):2562-2566.
[20]PFAFFL M W,HORAG G W,DEMPFLE L.Relative expression software tool(REST)for group-wise comparison and statistical analysis of relative expression results in real-time PCR [J].Nucleic Acids Res,2002,30(9):e36.
[21]JEANA SS,HSUEHPR.Highburdenof antimicrobial resistance in Asia [J].International Journal of Antimicrobial Agents,2012,37(4):291-295.
[22]KONG Haishen,YANG Qing,CHEN Xiao(孔海深,杨 青,陈 晓,等),et al.Mohnarin report 2010:Surveillance of bacterial resistance in East China[J].Chinese Journal of Nosocomiology(中华医院感染学杂志),2011,21(23):4915-4920.(in Chinese)
[23]SUN Aihua,FAN Huan,XIA Xiaoping(孙爱华,樊 欢,夏 肖 萍,等),et al.Recombinant expression ofStreptococcuspnumoniaeciaH/R genes and their correlation with β-lactam antibiotic resistance[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报医学版),2008,37(6):605-611.(in Chinese)
[24]FAN Huan,YAN Jie,SUN Aihua(樊 欢,严杰,孙 爱 华).Correlation oftwo-component signaling system ComD/ComE and β-lactam antibiotic resistance of Streptococcus pneumoniae[J].Chinese Journal of Microbiology and Immunology(中华微生物学和免疫学杂志),2010,30(11):1038-1043.(in Chinese)
[25]SUN Aihua,FAN Huan,XIA Xiaoping(孙爱华,樊 欢,夏 肖 萍,等),et al.Recombinant expression ofStreptococcuspnumoniaeciaH/R genes and their correlation with β-lactam antibiotic resistance[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报医学版),2008,37(6):605-611.(in Chinese)
