fliY基因在空肠弯曲菌致病性相关趋化和定植中的作用
2013-05-31楼宏强葛玉梅张金良赵金方
楼宏强,葛玉梅,张金良,严 杰,赵金方
(1.浙江省金华职业技术学院医学院,浙江 金华 321007;2.浙江大学医学院病原生物学系,浙江 杭州 310058;3.浙江中医药大学附属第一医院检验科,浙江 杭州 310006)
食源性感染是当前威胁人类健康和生命安全的重要公共卫生问题。空肠弯曲菌(Campylobacter jejuni)经肠道感染,引起以腹泻为主的急性肠炎,也可导致反应性关节炎、Reiter's和Guillain-Barrre综合征等并发症,故该菌是重要的食源性病原菌[1-3]。不少病原菌从消化道进入人体后,依赖鞭毛动力定向穿越胃肠黏膜表面黏液层到达合适的寄生部位,此过程称之为趋化(chemotaxis),是病原菌实现定植(colonization)并致病的前提[4-6]。空肠弯曲菌也依赖鞭毛运动到达空肠及回肠黏膜细胞表面定植,然后大量繁殖引起疾病[7-9],但其鞭毛运动控制机制尚未完全明了。
业已证实,FliY是细菌鞭毛马达开关蛋白(flagellar motor switch protein),在病原菌侵袭相关鞭毛运动中发挥关键作用[10-12]。在空肠弯曲菌染色体中含有编码FliY蛋白的基因(fliY)[13],但其与细菌趋化和定植关系尚无研究报道。本研究中,我们构建了空肠弯曲菌NCTC11168株fliY基因敲除突变株,采用空肠弯曲菌体外趋化模型和小鼠定植试验,以了解fliY基因在控制空肠弯曲菌鞭毛运动中的作用及其对细菌趋化和定植的影响。
1 材料与方法
1.1 菌株来源及培养 空肠弯曲菌空肠亚种NCTC11168株由浙江大学医学院病原生物学系提供,采用含8%绵羊血和1.5%琼脂的胰酶大豆肉汤琼脂平板在5%O2、10%CO2、85%N2气体条件下37℃培养72 h。
1.2 引物 本研究中使用的引物均委托上海Invitrogen公司合成,其序列见表1。
1.3 fliY基因扩增、克隆及测序 采用细菌基因组DNA提取试剂盒(GENEray)提取空肠弯曲菌空肠亚种NCTC11168株基因组DNA,分光光度法测定其浓度[14]。根据 GenBank中 fliY基因序列(accession No.:NC_002163)及其限制性内切酶图谱分析结果,设计含合适限制性内酶切位点的引物。采用 PCR试剂盒(TaKaRa)扩增全长fliY基因片段,PCR总体积100 μl,内含 2.5 mol/L dNTP、250 nmol/L 引物fliY-F 和 fliY-R(表 1)、15 mol/L MgCl2、2.5 U EX-Taq酶、100 ng DNA模板、1×PCR缓冲液(pH 8.3)。扩增产物用溴乙锭预染色的1.5%琼脂糖凝胶电泳进行检测。采用PCR产物纯化试剂盒(BioColor)及 T-A克隆试剂盒(TaKaRa)回收目的扩增片段并克隆入pMD19-T中形成 pMD19-TfliY,转化于 E.coli DH5α 中并扩增,碱变性法提取重组质粒,双酶切初步鉴定后由上海Invitrogen公司测序[14]。
1.4 fliY基因原核表达及表达产物提纯pMD19-Tfli和表达载体pET42a(Novagen)分别双酶切,琼脂糖凝胶电泳分离后切胶回收。将回收的fliY基因片段与线性化pET42a用T4DNA连接酶(TaKaRa)连接,转化于表达宿主菌 E.coli BL21DE3(Novagen)中形成 E.coli BL21DE3pET42a-fliY。该工程菌在含0.5 mmol/L IPTG的LB培养基中37℃振荡培养4 h,诱导目的重组蛋白rFliY表达,Ni–NTA亲和层析法提纯rFliY。采用10%分离胶的SDS-PAGE和BioRad凝胶图像分析系统检查rFliY表达和提纯效果。

表1 本研究中使用的引物及其序列Table 1 Primers and their sequences used in this study
1.5 rFliY抗血清制备 1 mg提纯的rFliY与等体积弗氏完全佐剂混匀,背部皮下多点注射免疫2只SPF级新西兰家兔,间隔1周免疫1次,共4次。末次免疫10 d后采集心血分离血清。采用免疫扩散法测定抗血清效价。
1.6 fliY基因敲除突变株的构建 含卡那霉素基因盒(Kanr)的pGKBLe24质粒及用于构建自杀质粒的pBluescript-Ⅱ-SK由浙江大学医学院病原生物学系提供。以空肠弯曲菌NCTC11168株基因组DNA为模板,分别采用引物U-F和U-R、D-F和D-R(表1)扩增fliY基因上游450 bp的同源臂(5'arm)和下游401 bp的同源臂(3'arm)片段,T-A克隆形成pMD19-T5'arm和 pMD19-T3'arm后测序。pMD19-T5'arm和pBluescript-Ⅱ-SK分别用 Xho I和 Hind III(TaKaRa)双酶切,琼脂糖凝胶电泳后用DNA片段胶回收试剂盒(TaKaRa)回收。在T4 DNA连接酶(TaKaRa)作用下,5'arm与pBluescript-Ⅱ-SK连接形成pBluescript-Ⅱ-SK5'arm。pMD19-T3'arm和 pBluescript-Ⅱ-SK5'arm分别用 Hind III和Xba I(TaKaRa)双酶切,琼脂糖凝胶电泳后按上法回收。在T4 DNA连接酶作用下,3'arm与pBluescript-Ⅱ-SK5'arm连接形成 pBluescript-Ⅱ-SK5'arm-3'arm。以 K-F和 K-R(表1)为引物,用PCR扩增pGKBLe24中的Kanr片段(kan),T-A克隆形成 pMD19-Tkan后测序。pMD19-Tkan和pBluescript-Ⅱ-SK5'arm-3'arm用 Hind III酶切,琼脂糖凝胶电泳后按上法回收。在T4 DNA连接酶作用下,kan片段与pBluescript-Ⅱ-SK5'arm-3'arm连接形成自杀质粒pBluescript-Ⅱ-SK5'arm-kan-3'arm,再次测序。将自杀质粒转化入E.coli DH5α中,在含 100 μg/ml氨苄青霉素和 50 μg/ml卡那霉素的LB液体培养基中扩增,采用碱变性法提取自杀质粒[14]。参照Hinds和Wassenaar介绍的方法[15,16],制备空肠弯曲菌 NCTC111682株感受态细胞并与2μgpBluescript-Ⅱ-SK5'arm-3'arm混合,冰浴10 min后进行电转化(18000 V,200 Ω,25 μF electric pulse)。转化产物接种于含50 μg/ml卡那霉素的MH血平板上,筛选出fliY基因敲除的菌落并获得纯培养。自杀质粒及fliY-突变株构建策略见图1。

图1 自杀质粒及fliY-突变株构建策略Fig.1 Strategy for generation of suicide plasmid and fliY-mutant
1.7 fliY-突变株的鉴定 fliY-突变株接种于含50 μg/ml卡那霉素的8%绵羊血胰酶大豆肉汤中,5%O2、10%CO2、85%N2气体条件下37℃培养24、48、72 h,5000 r/min 离心 15 min(4℃),细菌沉淀用MH培养液连续10倍稀释后各取0.05 ml均匀涂布于50 μg/ml卡那霉素的8%绵羊血胰酶大豆肉汤平板上,按上法培养72 h后进行CFU计数,实验中用等量野生株作为对照。按上述方法提取fliY基因敲除突变株(fliY-)基因组DNA,采用引物C-F和C-R进行PCR扩增,用溴乙锭预染色的1.5%琼脂糖凝胶电泳检测扩增产物,T-A克隆后测序。采用新鲜培养的fliY-突变株和野生株按上法离心,细菌沉淀用去离子水重悬,超声破碎细菌,10000 r/min离心15 min(4℃)后取上清,用BCA试剂盒(Thermo Scientific)测定上清标本中的蛋白浓度。等量fliY-突变株和野生株总蛋白SDS-PAGE后电转至 PVDF膜(Millipore)上,以 1∶500稀释的兔抗rFliY血清为一抗、HRP标记羊 抗兔 IgG(Jackson ImmunoReseach)为二抗,采用Western Blot检测fliY-突变株中FliY蛋白表达情况。
1.8 菌落迁徙试验 采用Brondsted等介绍的半固体平板法[17]。fliY-突变株和野生株在MH培养液中37℃培养12 h,各培养物用MH培养液稀释至 OD600=0.1,取 5 μl滴加于含0.4%琼脂的半固体 MH培养基表面,37℃培养48 h后,每份标本测量50个菌落迁移环直径。
1.9 细菌趋化试验 新鲜培养的FliY-突变株和野生株5000 r/min离心15 min(4℃),取沉淀的细菌用等体积PBS重悬,再次离心后取沉淀用上述PBS配制浓度为5×108CFU/ml的细菌悬液。用上述 PBS配制0.8%琼脂,细菌悬液37℃水浴预热10 min后与等体积加热溶解后的0.8%琼脂(42℃)混合,倾注平板。将含0.4 mol/L 脱氧胆酸钠(SDC,Sigma)或10%牛胆汁(Sigma)的8 mm直径滤纸片紧贴于平板表面。实验中以含等量PBS滤纸片作为对照。各平板置于 5%O2、10%CO2、85%N2气体条件下37℃孵育3 h后观察结果,滤纸片周围出现圆形的细菌聚集环为趋化试验阳性。
1.10 小鼠空肠定植试验 体重(20±1)g的BALB/c-ByJ小鼠由浙江大学医学实验动物中心提供。将小鼠分为2组,每组6只,先灌喂5%碳酸氢钠500 μl以中和胃酸,然后分别灌喂1×107CFU的FliY-突变株和野生株,常规饲养5 d后处死小鼠,收集空肠组织标本。标本称重匀浆后PBS连续稀释,取0.1 ml涂布于MH 血平板上,5%O2、10%CO2、85%N2气体条件下培养72 h后进行CFU计数[18]。
1.11 统计学分析 菌落、细菌聚集环直径(mm)以及小鼠空肠内容物空肠弯曲菌计数结果用mean±SD表示,采用SPSS 16.0软件中的t检验进行分析和比较,P<0.05认为差异有显著性。
2 结果
2.1 PCR扩增及测序结果 从空肠弯曲菌NCTC11168株、fliY-突变株DNA模板中分别扩增获得预期大小的 fliY基因(840 bp)、5'side-arm-kan-arm-3'side(2080 bp)片段(图2)。测序结果显示,所克隆的fliY基因、5'side-armkan-arm-3'side片段与 GenBank(accession No.:NC_002163)中公布的完全相同(图3)。
2.2 rFliY表达和提纯效果及rFliY抗血清效价 在IPTG诱导下,E.coli BL21DE3pET32a-fliY能表达rFliY,Ni-NTA亲和层析法提取的rFliY显示为单一的蛋白条带(图4)。兔抗rFliY血清免疫双扩效价为1∶4。
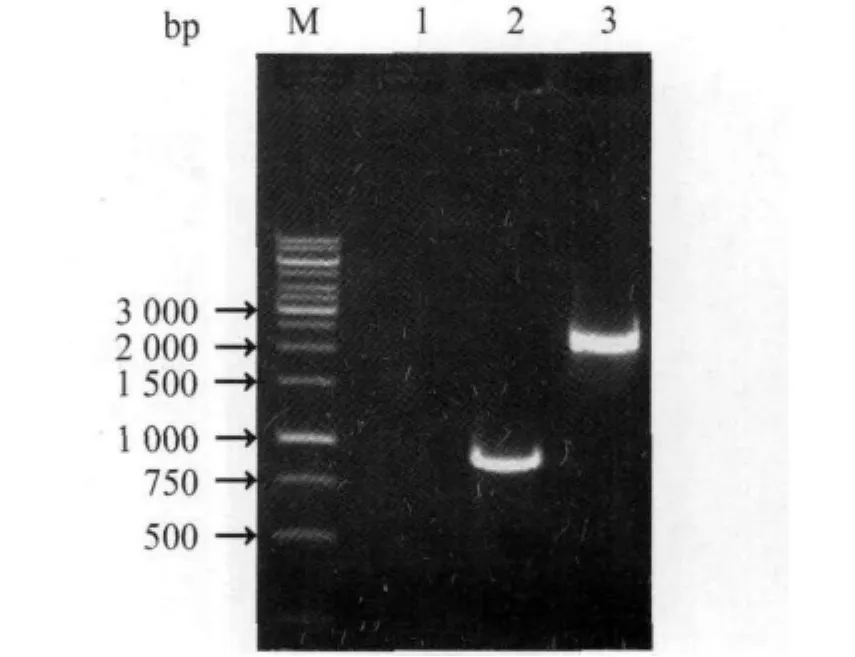
图2 fliY基因扩增和fliY-突变株PCR鉴定结果Fig.2 Amplification of fliY gene and identification of fliY-mutant by PCR

图3 空肠弯曲菌fliG-突变株测序结果Fig.3 Sequencing result of fliG- mutant of C.jejuni
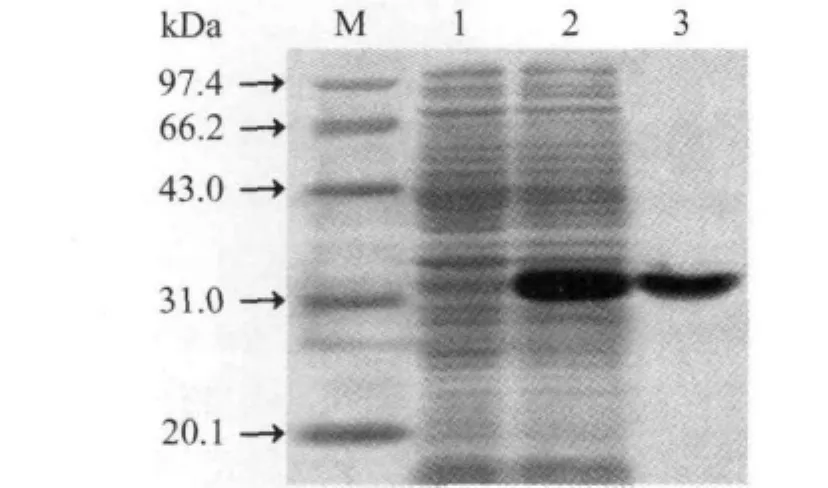
图4 rFliY重组表达和提纯效果Fig.4 Sequencing result of fliY- mutant of C.jejuni
2.3 fliY-突变株鉴定结果 fliY-突变株生长曲线与野生株相似,但Western Blot检测结果显示fliY-突变株FliY蛋白缺失(图5)。
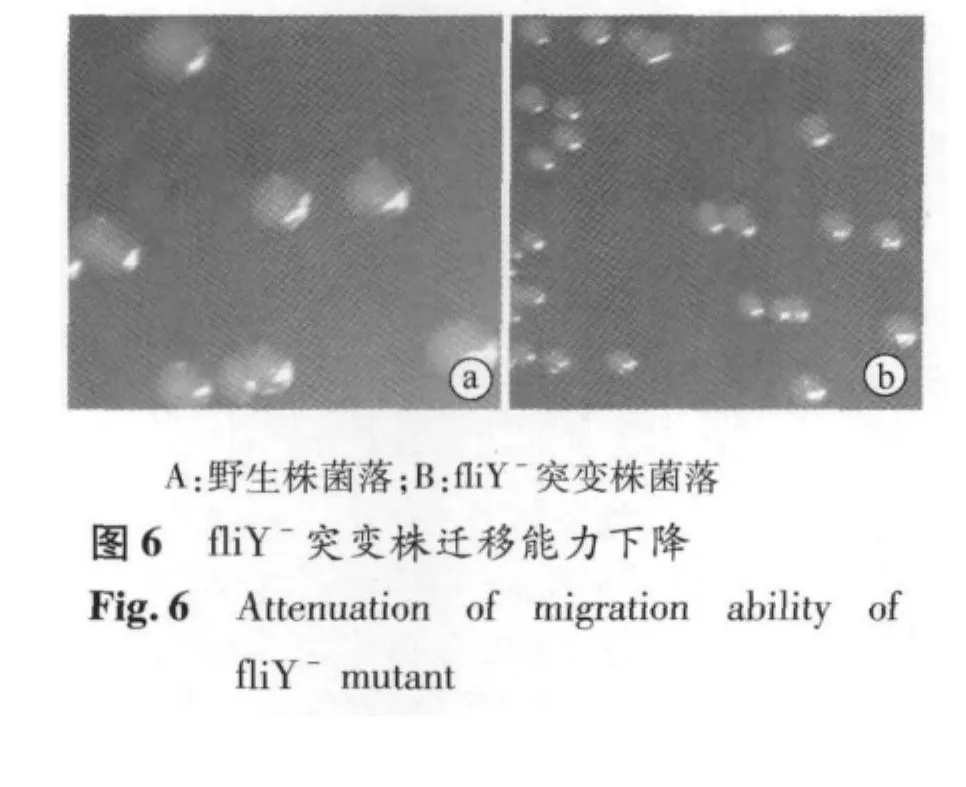
2.4 fliY-突变株迁移能力改变 空肠弯曲菌NCTC11168株fliY基因被敲除后,在半固体平板上迁移能力下降,表现为fliY-突变株菌落直径明显低于野生株(P<0.05,图6)。
2.5 fliY-突变株趋化能力下降 与野生株比较,FliY-突变株对脱氧胆酸钠和牛胆汁趋化能力显著下降(P <0.05,表2)。
2.6 fliY-突变株小鼠空肠定植能力下降 与野生株比较,FliY-突变株空肠组织标本中CFU值明显减少(P <0.05,图7)。

3 讨论
不少病原菌有其特定的寄生部位,如霍乱弧菌寄生于人小肠、幽门螺杆菌寄生于人胃和十二指肠、空肠弯曲菌寄生于人空肠。究其原因,是上述病原菌在与宿主长期相互作用过程中 ,逐渐发展出特化了的合适定植部位[5,19]。以往一直认为黏附是病原菌致病的第1步,但至少对上述肠道病原菌而言,为到达合适定植部位的定向趋化运动,才是致病的第一步。

表2 fliY-突变株趋化能力下降Table 2 Reduction ofchemotactic ability of fliY-mutant
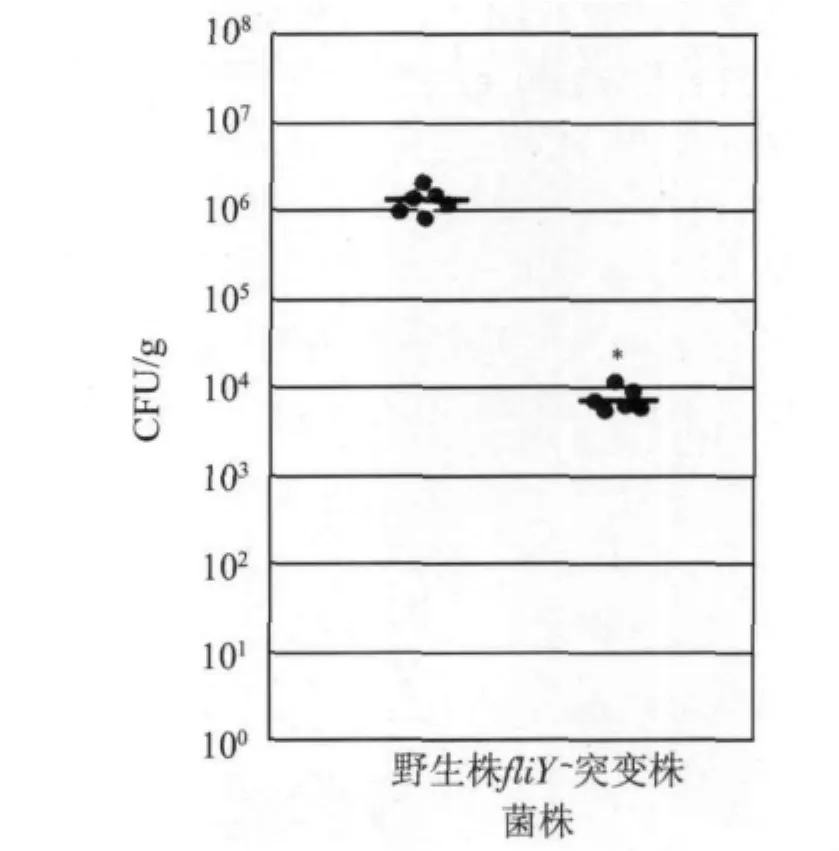
图7 fliY-突变株小鼠空肠定植能力下降Fig.7 Attenuation of colonization ability on mouse jejunum of fliY-mutant
细菌能通过二元信号系统(two-component signaling system,TCSS)调控感受环境变化作出适应性反应[20]。不少细菌定植趋化运动受趋化相关TCSS(Che-TCSS)调控,通常呈MCPs→Ches→Flis/Mots 三级调控模式[6,21]。MCPs 即接受甲基趋化蛋白(methyl-accepting chemotaxis protein),是接受外界趋化信号的受体,Fli家族蛋白调控鞭毛运动形式和方向,Mot家族蛋白为鞭毛运动提供能量[8,22-23]。Fli家族蛋白中,以FliY最为重要[10-12],其次是FliG和FliM[24-25],但 fliY基因与空肠弯曲菌趋化和定植的关系迄今未见研究报道。
基因敲除是目前了解靶基因功能较为直接和可靠的方法。常用的基因敲除技术有抗性基因插入靶基因使之失活(inactivation)或抗性基因替换靶基因(deletion)。自杀质粒是用于失活或替换靶基因的工具,含有一定长度的插入部位或靶基因上下游序列(同源臂)及抗性基因,将自杀质粒导入靶细胞后,由于同源臂与野生型相应序列相同,因而有一定的概率进行重组交换,在抗生素作用下,仅有靶基因被抗性基因插入或替换的突变株被筛选出来。pBlueskrit-Ⅱ-SK质粒曾被成功地用于构建敲除空肠弯曲菌靶基因的自杀质粒[26],本研究中,我们也采用pBlueskrit-Ⅱ-SK构建自杀质粒,用于敲除空肠弯曲菌fliY基因。PCR扩增及测序结果显示,fliY-突变株DNA模板中可扩增出序列正确的5'side-arm-kan-arm-3'side片段(图2和图3),由于5'side和3'side各120 bp序列只可能存在于细菌基因组 DNA中,Western Blot也未检测到FliY蛋白(图5),故可确定fliY-突变株构建成功。由于fliY-突变株生长曲线与野生株相似,表明fliY基因敲除不影响细菌生长,故fliY-突变株可用于后继fliY基因与空肠弯曲菌趋化和定植关系的研究。
我们以往的研究中发现,在十余种受试物中,仅有脱氧胆酸钠和牛胆汁是空肠弯曲菌趋化的信号分子[8]。本研究中体外试验结果显示,fliY-突变株在半固体平板上迁移能力(图6)、对脱氧胆酸钠和牛胆汁趋化能力(表2)均明显低于野生株(P<0.05),表明fliY基因敲除使空肠弯曲菌运动能力显著下降。fliY-突变株小鼠空肠定植试验结果也显示,FliY-突变株空肠组织标本中CFU值明显低于野生株(P<0.05,图7),表明 fliY基因敲除不仅影响了空肠弯曲菌运动能力,同时也使该菌定植空肠黏膜的能力也显著下降。综上所述,空肠弯曲菌fliY基因产物作为鞭毛马达开关蛋白[10-13],通过调控鞭毛运动而在细菌感染早期向宿主易感部位趋化过程中发挥了重要作用,从而对细菌定植空肠产生了重大影响。
[1]ALLOS B M.Campylobacterjejuniinfections:update on emerging issues and trends[J].Clin Infect Dis,2001,32(8):1201-1206.
[2]ZIBAUER M,DORRELL N,WREN B W,et al.Campylobacter jejuni-mediated disease pathogensis:an update [J].Trans R Soc Trop Med Hyg,2008,102(2):123-129.
[3]Van DOORN PA,RUTS L,JACOBS BC.Clinical features,pathogenesis,and treatment of Guillain-Barr syndrome[J].Lancet Neurol,2008,7(10):939-950.
[4]SZURMANT H, ORDAL GW. Diversity in chemotaxis mechanisms among bacteria and archaea[J].Microbiol Mol Biol Rev,2004,68(2):301-309.
[5]TERRY K,WILLIAMS S M,CONNOLLY L,et al.Chemotaxis plays multiple roles during Helicobacter pylori animal infection [J].Infect Immun,2005,73(2):803-811.
[6]MARICONDA S,WANG Q,HARSHEY R M.A mechanical role forthe chemotaxissystem in swarming motility [J].Mol Microbiol,2006,60(6):1590-1602.
[7]YOUNGK T,DAVISLM,DIRITA V J.Campylobacter jejuni:molecular biology and pathogenesis.Nature Rev Microbiol,2007,5(9):665-679.
[8]LI Zhifeng,ZHAO Jinfang,LOU Hongqiang,et al(李志峰,赵金方,楼宏强,等).Prokaryotic expression of Campylobacter jejuni mcp1/2/3 genes and relationship among the expressed products and bacterialchemotactic behavior [J].Chinese Journal of Microbiology and Immunology(中华微生物学和免疫学杂志),2009,29(7):607-611.(in Chinese)
[9]LOU Hongqiang,LIAO Shumei,HU Ye,et al(楼宏强,廖苏梅,胡 野,等).Targeting knock out of Leptospira interrogans flagellum-associated fliN gene and pathogenic function alteration of the mutant[J].ChineseJournalofMicrobiologyand Immunology(中华微生物学和免疫学杂志),2009,29(8):677-682.(in Chinese)
[10]LIAO S M,SUN A H,OJCIUS D M,et al.Inactivation of the fliY gene encoding a flagellar motorswitch protein attenuates mobility and virulence of Leptospira interrogans strain Lai[J].BMC Microbiol,2009,9:253-263.
[11]SENESI S,CELANDRONI F,SALVETTI S,et al.Swarming motility in Bacillus cereus and characterization of a fliY mutant impaired in swarm cell differentiation [J].Microbiology,2002,148(Pt6):1785-1794.
[12]RAJAGOPALA S V,TITZ B,GOLL J,et al.The protein network of bacterial motility[J].Mol Syst Biol,2007,3:128.
[13]PARKHILL J,WREN B W,MUNQALL K,et al.The genome sequence offood-bornepathogen Campylobacter jejuni reveals hypervariable sequence[J].Nature,2000,403(6770):665-668.
[14]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning,a latoratory manual[M].New York:Cold Spring Harbor Laboratory Press,1989,1.21-1.52,2.60-2.80,7.30-7.35,9.14-9.22.
[15]WASSENAAR T M,FRY B N,van der ZEIJST B A.Genetic manipulation of Campylobacter:evaluation of natural transformation and electrotransformation[J].Gene,1993,132(1):131-135.
[16]HINDS J,MAHENTHIRALINGAM E,KEMPSELL K E, etal.Enhanced genereplacementin mycobacteria [J].Microbiology,1999,145(Pt 3):519-527.
[17]BRONDSTED L,ANDERSEN M T,PARKER M,et al.The HtrA protease of Campylobacter jejuni is required for heat and oxygen tolerance and for optimal interaction with human epithelial cells[J].Appl Environ Microbiol,2005,71(6):3205-3212.
[18]RUAN Ping,SUN Aihua,ZHAO Xing,et al(阮萍,孙爱华,赵 欣,等).Contribution of motA gene in pathogenesis-associated chemotaxis and colonization of Campylobacter jejuni[J].Chinese Journal of Microbiology and Immunology(中华微生物学和免疫学杂志),2010,30(3):195-200.(in Chinese)
[19]PEI Z,BURUCOA C,GRIGNON B,et al.Mutation in the peb1A locus of Campylobacter jejuni reduces interactions with epithelial cells and intestinal colonization of mice[J].Infect Immun,1998,66(3):938-943.
[20]KORETKE K K,LUPAS A N,WARREN P V.Evolution of two-component signal transduction[J].Mol Biol Evol,2000,17(12):1956-1970.
[21]WANG Yuan,LOU Hongqiang,WANG Huan,et al(王 媛,楼宏强,王 欢,等).CheA/CheY signaling system responsible for chemotaxis in vitro and colonization in vivo of Campylobacter jejuni[J].Chinese Journal of Microbiology and Immunology(中华微生物学和免疫学杂志),2011,31(3):201-207.(in Chinese)
[22]KIRSTICH C J,ORDAL G W.Analysis of chimeric chemoreceptor in Bacillus subtilis reveals a role for CheD in the function of MepC HAMP domain[J].J Bacteriol,2004,186(17):5950-5955.
[23]HOSKING E R,MANSON M D.Clusters of charged residues at the C terminus of MotA and N terminus of MotB are important for function of the Escherichia coli flagellar motor[J].J Bacteriol,2008,190(15):5517-5521.
[24]LOWENTHAL A C,HILL M,SYCURO L K,et al.Functionalanalysis ofthe Helicobacterpylori flagellar switch proteins [J].J Bacteriol,2009,191(23):7147-7156.
[25]BROWN P N,TERRAZAS M,PAUL K,et al.Mutational analysis of the flagellar protein FliG:sites of interaction with FliM and implications for organization ofthe switch complex [J].J Bacteriol,2007,189(2):305-312.
[26]BACHTIAR B M,COLOE P J,FRY B N.Knockout mutagenesis of the kpsE gene of Campylobacter jejuni 81116 and its involvement in bacterium-host interactions [J]. FEMS Immunol Med Microbiol,2007,49(1):149-154.
