基底节脑梗死后抑郁患者的1H-MRS分析
2013-05-31郑水红
周 蕾,楼 敏,郑水红,李 捷
(1.浙江大学医学院附属第二医院神经内科,浙江 杭州 310009;2.浙江省金华市中医院神经内科,浙江 金华 321000;3.浙江省金华市中医院影像中心,浙江 金华 321000)
脑梗死后抑郁(post-stroke depression,PSD)是脑梗死常见的并发症之一,通常在脑梗死后3~6个月时达到高峰[1];严重影响患者的预后,增加脑梗死患者的死亡率[2-3]。磁共振波谱分析(magnetic resonance spectroscopy,MRS)作为一种活体检测细胞水平代谢变化的非侵入性的、功能性成像方法[4],其观察到的代谢改变明显早于脑内形态学改变,已被广泛应用到多种疾病的诊断和研究中。因此,作者拟研究脑梗死后抑郁患者的磁共振波谱的变化,及其与抑郁、神经功能评分、日常生活能力的相关性,以便为早期诊断 PSD提供依据,并为其病因学探讨提供线索。
1 资料与方法
1.1 研究对象和分组 回顾性收集2009年4月至2011年4月期间在金华市中医院神经内科住院的首次左侧基底节梗塞患者。纳入标准:①符合第四届全国脑血管疾病会议制定的脑梗死诊断标准,且梗塞灶仅累及左侧基底节;②首次诊断脑梗死,且发病在1周内;③年龄≥40岁;④发病前无抑郁或其他神经系统疾病;⑤受教育程度≥5年,无严重失语,不影响量表的评估;⑥患者为右利手;⑦签署知情同意书。排除标准:①有额叶病灶;②合并脑出血或梗塞后出血转化;③意识不清持续>7天;④伴随其他中枢神经系统疾病并影响抑郁评分;⑤伴随有内科疾病并判定可能影响生存;⑥精神障碍或家族史阳性者;⑦酒精依赖;⑧MRI检查禁忌。
符合纳入标准入组PSD组的患者符合国际疾病分类第10版抑郁发作诊断标准,同时HAMD抑郁量表(24项版)[5]评分≥20分,NPSD组HAMD评分≤8分,正常组HAMD评分≤8分。选择性别、年龄、教育年限相匹配的社区健康志愿者10例作为正常对照组,志愿者无脑血管意外病史;右利手;签署知情同意。排除标准同病例组。
1.2 磁共振扫描以及分析 脑梗死患者在发病1周内、正常对照组入组后进行第1次磁共振扫描,脑梗死患者在发病后1个月再次行磁共振扫描。
1.2.1 磁共振常规扫描 采用 GE公司的Signa 1.5T HDX型超导型磁共振扫描仪,梯度场23 mT/m,切换率120 T/m/s.8通道头颅线圈,矢状位T1W1自旋回波序列(SE):扫描序列T1加权(TR 1415 ms/TE 27 ms/TI 740 ms),T2加权(TR 3800 ms/TE105 ms),FLAIR(TR 8402 ms/TE127 ms/TI 2100 ms),DWI(TR 6000 ms TE 98 ms,B 值0 s/mm2和1000 mm2),扫描层厚5 mm,间隔0.5 mm,矩阵256×192,NEX2次。层厚5 mm,间距0.5。
1.2.2 磁共振波谱成像(MRS) 采用多体素波谱扫描,选取DWI所示梗塞面积的最大层面,将MRS的感兴趣区放置在左前额叶白质及左侧基底节梗塞区(尽量避开骨骼,脑沟,脂肪区,防止脑脊液的干扰影响测量MRS额叶定位图),其容积恒定为1 cm3(梗死中心区)。扫描前机器自动匀场,CHESS(CHEmical Shift Selective)水抑制,STEAM(stimulated echo acquision mode)激励回波探测法定域;PRESS(point resolved spectroscopy)点分解频谱分析法序列,TR 1000 ms,TE 144 ms,层厚8 mm,间隔2 mm,Fov 24 cm ×24 cm,矩阵128×128,扫描时间5 min。
使用Probe 2000多体素1H-MRS软件包进行分析。主要监测的代谢物质及化学位移如下:N-乙酰门冬氨酸(NAA)(1.97),含胆碱类化合物(Cho)(3.11),肌酸(Cr)(2.93)。软件包自动测出每个代谢物的信率比(SMR),降下面积,测得NAA/Cr、Cho/Cr比值。所有数据均在SUNADW 4.3工作路上进行相位校准。1H-MRS结果由1名有经验的放射科医师测定,并且经3名有经验的放射科医师共同读片确认结果。左前额叶白质定位及波谱图如图1所示。
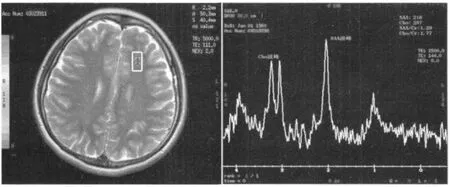
图1 图1 正常对照组左前额叶白质波谱图Fig.1 Magnetic resonance spectroscopy of left frontal white matter in health control:left image shows the set of ROI in the left prefrontal white matter
1.3 神经功能评分和抑郁障碍的评定 分别在患者发病1周内、发病后1月、6月时评定神经功能评分和抑郁量表。抑郁障碍的评定:抑郁评分由2名经过培训的心理科医师执行,入组PSD组的患者符合国际疾病分类第10版抑郁发作诊断标准,同时HAMD评分≥20分,NPSD组HAMD评分≤8分,正常组HAMD评分≤8分。美国国立卫生院神经功能缺损评分(NIHSS)评分:由2名神经科医师评价。最低0分,最高45分,分值越高功能缺损越严重。
1.4 日常生活能力量表(ADL)评分 由2名神经科医师评价,总分14分为完全正常,≥16分有不同程度的功能下降,最高56分。单项分1分为正常,2~4分为功能下降。凡有2项或2项以上≥3,或总分≥22,为功能有明显障碍。
1.5 统计学方法 应用SPSS 13.0统计软件。对计量资料的各组1H-MRS值、NIHSS值、ADL值用Shapiro-Wilk(W检验)法进行正态性检验,本研究数据符合正态性分布,采用()表示;三组间比较用单因素方差分析(ANOVA)LSD-t检验法,两组间比较用独立样本t检验,并采用偏相关分析法(Partial)研究多变量时两变量之间的相关性,P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料及统计结果 共纳入22例符合标准的首次左侧基底节梗塞患者,其中男12例,女10例,年龄 (52±7)岁;教育年限(9.4±5.2)年。22例患者第1周时新发现PSD 2例,1个月时新发现PSD 3例,6个月时新发现5例PSD患者,故10例患者入PSD组;其余12例入NPSD组,两组患者性别、年龄、教育年限差异无统计学意义。纳入10例正常对照组,其性别、年龄、教育年限和脑梗死组无统计学差异。
2.21H-MRS资料及临床评分 如表1所示,1周时,PSD组患者的NIHSS和ADL评分均较NPSD组严重(P值分别为 P=0.027、P=0.043)。MRS分析发现,在左前额叶白质区PSD患者的NAA/Cr较正常组降低(P=0.000),但PSD和NPSD患者间NAA/Cr无显著差异(P=0.287);PSD患者的Cho/Cr较正常组升高(P=0.009),且PSD患者的Cho/Cr较NPSD患者亦明显升高(P=0.009)。在左侧基底节梗塞区,PSD患者的NAA/Cr较正常组降低(P=0.000),且PSD患者的NAA/Cr较NPSD患者亦明显降低(P=0.016);PSD患者的Cho/Cr较正常组升高(P=0.000),且 PSD患者的Cho/Cr较NPSD患者亦明显升高(P=0.003)。
1周后,2例PSD患者接受了西酞普兰药物治疗,故在1月后统计时,剔除了此2例,以排除药物对MRS结果的影响。如表2所示,1月时,PSD组患者的 NIHSS、ADL评分均较NPSD组严重(P值分别为 P=0.011、P=0.023)。MRS分析发现,在左前额叶白质区PSD患者的Cho/Cr较NPSD患者明显升高(P=0.004),NAA、NAA/Cr较NPSD 者低(P 值分别为P=0.045、P=0.03)。在基底节区,PSD患者的NAA、NAA/Cr较NPSD患者降低(P值分别为 P=0.019、P=0.001),Cho、Cho/Cr较NPSD患者明显升高(P值分别为P=0.015、P=0.000),其中PSD与NPSD患者比 NAA/Cr、Cho/Cr差异显著(P<0.01)。
2.31H-MRS资料与临床评分的相互关系如表3所示,1周时PSD患者NIHSS、ADL与左前额叶 NAA、Cho、NAA/Cr、Cho/Cr均无显著相关(P>0.05)。1月时患者左前额叶NAA/Cr与NIHSS呈显著负相关(r=-0.551,P=0.032),Cho与 ADL 呈正相关(r=0.766,P=0.025),Cho/Cr与 ADL 呈正相关(r=0.682,P=0.005)。
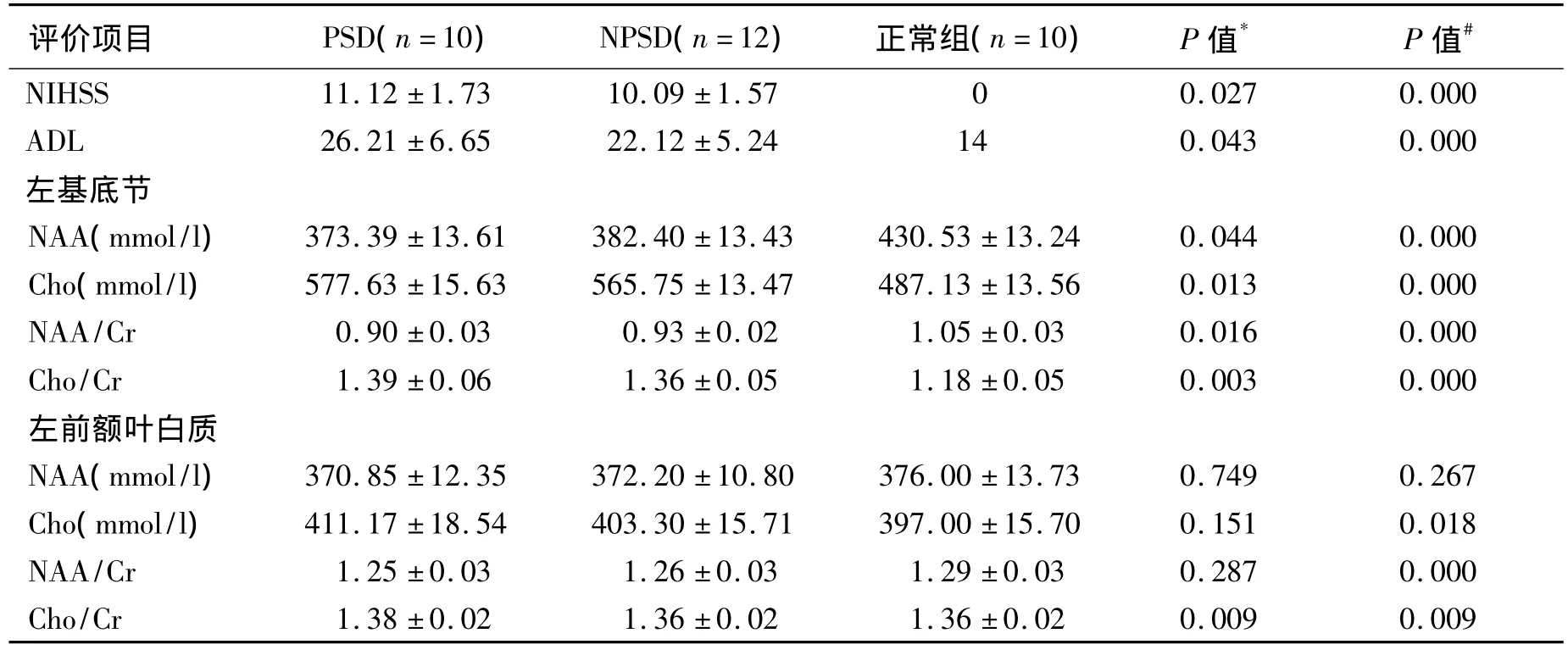
表1 脑梗死1周时各组MRS结果和NIHSS、ADL评分比较Table 1 Metabolic changes of1H-MRS,NIHSS and ADL at one week after cerebral infarction

表2 脑梗死1月时各组MRS结果和NIHSS、ADL评分比较Table 2 Metabolic changes of1H-MRS,NIHSS and ADL at one month after cerebral infarction

表3 10例PSD患者1周时、1月时左前额叶各代谢物与NIHSS、ADL的相关性分析Table 3 Relationshipsbetween NIHSS,ADL and metabolic changes of1H-MRS on left prefrontal white matter
3 讨论
脑梗死患者抑郁障碍的发生率较高,故近年来PSD已成为众多神经及精神科学者研究的焦点。不同的PSD发病率可能与病例选择、研究时间、诊断标准、评定方法等的不同有关,国内外文献报道PSD的总发生率从18%至79%不等,但多在30% ~50%左右[6-8],且 PSD高发期在脑梗死后3~6个月。以往国内外文献报道,基底节梗塞患者发生抑郁的比例升高。李永峰[9]等从病程、性别、年龄、发病部位等方面观察抑郁的发病率,结果发现基底节梗死的患者抑郁患病率最高(21%)。我们以首发左侧基底节脑梗死患者为研究对象,发现其发生抑郁的比例达45%,与国内外文献报道相符,提示脑梗死的部位对是否发生PSD可能有一定影响。
原发性内源性机制可能是基底节梗塞发生抑郁的主要原因。脑损伤直接破坏情绪调节的神经环路可致PSD的发生[10]。Kim等发现,抑郁的发生与额颞叶-基底节-脑干腹侧这一通路损害有关[11]。Hama[12]等发现情感性抑郁的程度与左侧额叶损伤有关,而淡漠性抑郁的程度则与双侧基底节损伤有关。基底节梗塞后神经功能损伤、日常生活能力下降、自我价值的下降都已证实与抑郁的发生有关[13]。前额叶功能的缺损被认为是精神异常的病理生理基础,因为此区域富含与其他大脑皮质、边缘系统和皮质下区的传人和传出纤维,左半球脑梗死比右半球及脑干部位脑梗死更易发生抑郁;左半球又以邻近额极的脑梗死损害更易发生抑郁[14-16]。因此,我们选择以左前额叶白质、基底节作为质子磁共振波谱技术(1H-MRS)的感兴趣区,以脑梗死后1周、1个月、6个月为观察点进行动态监测。
我们的监测结果发现,左前额叶白质和基底节的NAA、NAA/Cr值在脑梗死后持续降低,而且PSD患者的NAA、NAA/Cr值较NPSD者降低更显著。NAA主要存在于神经元胞体及轴索,代表神经元及神经结构的完整性,可作为神经元的标志物,反映神经元的丧失和功能异常[17-18]。而Cr主要作为内参照,对信号强度作标准化。Wardlaw19]研究就发现,NAA的减少与脑梗死的严重程度及临床预后有关,基底节的NAA下降反映了脑梗死后神经细胞的死亡,而左前额叶白质的NAA下降表明脑梗死后白质神经纤维的功能障碍或迟发性损伤。研究发现,原发性抑郁症患者基底节和前额叶白质的NAA明显下降,提示NAA的下降可能参与了抑郁的发生。
我们也发现,左侧基底节脑梗死后,左侧基底节和左前额叶白质Cho、Cho/Cr持续上升,而PSD患者的上升更明显,较NPSD者显著升高。Cho峰反映脑内总胆碱的储藏量,包括游离胆碱、磷脂酰胆碱以及神经递质乙酰胆碱等。胆碱富含于神经胶质细胞中,参与细胞膜的合成,当神经胶质细胞增生及脱髓鞘改变时可见其增高。而乙酰胆碱作为重要的神经递质,是情绪紊乱的病理生理基础,影响记忆、认知和精神状态。胆碱信号升高可能反映神经元细胞膜结构的改变,但是其与脑内乙酰胆碱神经递质的关系还不清楚。脑梗死后能量代谢障碍造成髓鞘、磷脂酰胆碱或磷脂酰肌醇等的分解,由此增加了非膜性结合池的胆碱成分,脑梗死患者Cho、Cho/Cr的升高在很多研究中也得到证实。研究发现[20-21],白质 Cho/Cr的升高在抑郁症尤其是老年抑郁症的发病中起作用,白质在很多生化过程如轴浆运输、神经递质的释放中有重要的作用,这些生化过程的紊乱可造成脑功能失调。对于老年抑郁症患者的研究发现,左前额叶背外侧白质Cho/Cr明显增高,也发现,抑郁症患者存在广泛的皮层下区域Cho/Cr增高,经过抗抑郁治疗后 Cho/Cr恢复正常[22]。由此我们推测,PSD可能与基底节梗塞后Cho/Cr增高有关。
我们的研究还进一步发现,PSD患者的神经功能缺损和日常生活能力较NPSD者更差,且其1个月时的NIHSS与左前额叶的NAA/Cr明显相关,ADL与Cho、Cho/Cr相关,提示脑梗死不但损伤了梗塞区的神经元,影响了神经功能和日常生活能力,同时也破坏了神经环路,导致与神经心理活动相关的各种神经递质的合成与代谢以及神经递质的传导障碍。以往认为,PSD仅是对躯体功能缺损的一种简单情绪创伤反应,卒中后对自我价值的不肯定,造成情绪低落、自责等抑郁症状。我们的结果提示,基底节梗塞后抑郁的发生有其神经递质的变化基础,这就使预测脑卒中后PSD的发生成为可能。另一方面,躯体功能缺损与抑郁相互影响,躯体功能缺损加重抑郁程度,而抑郁一旦发生也对肢体功能的恢复不利[16,23]。Townend 等[24]研究结果就显示,发病1个月时NIHSS评分的改善与情绪评分的好转密切相关。因此,磁共振波谱分析在一定程度上可预测脑梗死后PSD
的发生,并可能为早期诊断PSD提供依据,从而对患者的康复、以及早期干预治疗具有指导意义,得开展大样本的临床研究来进一步验证。
[1]HUFF W,STECKELR,SITER M.Poststroke depression:risk factors and effects on the course of the stroke[J].Nervenarzt,2003,74:104-114.
[2]RAMASUBBU R,PATTEN S B.Effect of depression on stroke morbidity and mortality[J].Can J Psychiatry,2003,48:250-257.
[3]KAPPELLE L J,VANDERWORP H B.Treatment or prevention of complications of acute ischemic stroke[J].Curt Neurol Neurosci Rep,2O04,4:36-41.
[4]STANLEY J. In vivo magnetic resonance spectroscopy and its application to neuropsychiatric disorders[J].Can J Psychiatry,2002,47:315-326.
[5]ZHANG Zuoji(张 作 记).Manual of Behavior Medical Science Measure Table(行为医学量表手册) [M/CD].Beijing:TheChinaMedical Science Electronic Audio and Video Publishing House,2005:225-227.(in Chinese)
[6]PAOLUCCI S,GANDOLFO C,PROVINCIALI L,et al.The italian multicenter observational study on post-stroke depression(DESTRO)[J].J Neurol,2006,253(5):556-562.
[7]TOSO V,GANDOLFO C,PAOLUCCI S,et al.Poststroke depression:research methodology of a large multicentre observational study(DESTR0)[J].Neurol Sci,2004,25(3):138-144.
[8]HACKETT M L,YAPA C,PARAG V,et al.Frequency of depression after stroke:a systemic review of observational studies[J].Stroke,2005,36:1330-1340.
[9]LI Yongfeng(李永峰).Prevalence rate and impact factors of ischemic post-stroke depression [J].Chinese Journal of Modern Drug Application(中国现代药物应用),2011,5(7):18.(in Chinese)
[10]BEBLO T,WALLESCH C,HERRMANN M.The crucial role of frontostriatal circuits for depressive disorders in the post acute stage after stroke[J].Neuropsychiatry Neuropsychol Behav Neurol,1999;12:236-46.
[11]KIM J S,CHOI K S.Post-stroke depression and emotional incontinence corelation with lesion[J].Neurology,2000,54(9):1805-1810.
[12]HAMA S,YAMASHITA H,SHIGENOBU M.et al.Post-stroke affective or apathetic depression and lesion location:left frontal lobe and bilateral basal ganglia [J].Eur Arch Psychiatry Clin Neutosei,2007,257:149-152.
[13]LI Xi,WANG Ping,HE Xinhong,et al(李曦,王萍,何新红,等).Post-stroke depression and Related factor study [J].Chinese Journal of Rehabilitation Medicine(中国康复医学杂志),2006,21(2):175-176.(in Chinese)
[14]ROBINSON R G.Neuropsychiatric consequences of stroke [J].Annu Rev Med,1997,48:217-229.
[15]ROBINSON R G,LIPSEY J R,et al.Two-year longitudinal study of post-stroke mood disorders:comparison ofacute-onsetwith delayed-onset depression [J].Am J Psychiatry,1996,143:1238-1244.
[16]SINGH A,BLACK S E,HERRMANN N,et al.Functional and neuroanatomic correlations in poststroke depression:The Sunnybrook Stroke Study[J].Stroke,2000;3l:637-644.
[17]GIMUD M,WALKER P,Guy F,et al.Cerebral metabolism after transient ischemic attack.A1HMR spectroscopy study[J].Neural Res,1999,21:563-565.
[18]YAMAMURO M,Katayama Y,IGMASHI H,et al.H and 31P-magnetic resonance spectroscopy of cerebral infarction in rats[J].Nippon Ika Daigaku Zasshi,1997,64(2):131-138.
[19]WARDLAW J M,MARSHALL I,Wild J,et al.Studies ofacute ischemic stroke with proton magnetic resonance spectroscopy:relation between time from onset,neurological deficit,metabolite abnormalities in the infarct blood flow and clinical outcome[J].Stroke,1998,29:1618-1624.
[20]MACFALL J R,PAYNE M E,Provenzale J E,et al.Medial orbital frontal lesions in late-onset depression[J].Bid Psychiatry,2001,49:803 -806.
[21]AUER D P,PUTA B.Reduced glutamate in the anterior cingulated cortex in depression:An in vivo proton magnetic resonance spectroscopy study[J].Biol Psychiatry,2000,4:305-313.
[22]HUANG Yanyan,WU Xiaoyan,ZHU Zhen,et al(黄延焱,吴晓琰,朱 珍,等).Analysis of Poststroke depression treatment by proton magnetic resonance spectroscopy [J].Chinese Journal of Gerontology(中国老年学杂志),2005,25(1):48-50.(in Chinese)
[23]CAROTA A,BERNEY A,AYBEK S,et al.A prospectivestudy ofpredictors ofpost-stroke depression [J].Neurology,2005,64:428-433.
[24]TOWNNEND B S,WHYTE S,DESBOROUGH T,et al.Longitudinal prevalence and determinants of early mood disorderpost-stroke[J].J Clin Neurosci,2007,14:429-434.
