舟山海域常见经济物种组氨酸二肽的提取和鉴定
2020-12-26王春月李艳荣黄莉莉李炜男严小军
王春月,李艳荣,潘 晨,黄莉莉,李炜男,陈 建,廖 智,严小军
(1.浙江海洋大学海洋科学与技术学院,海洋生物蛋白质工程实验室,浙江舟山 316022;2.宁波海洋研究院,浙江宁波 315800)
组氨酸二肽(Histidine-containing dipeptide)是广泛分布于生物体内且具有重要生理活性的一类小分子肽,其主要成员包括肌肽(Carnosine,Car,β-alanyl-L-histidine,C9H14N4O3)、鹅肌肽(Anserine,Ans,βalanyl-L-1-methylhistidine,C10H16N4O3)、鲸肌肽 (Ophidine/Balenine,β-alanyl-L-3-methylhistidine,C10H16N4O3)、高肌肽(Homocarnosine,Hcar,γ-amino-butyryl-histidine,C10H16N4O3)、N-乙酰肌肽(Acetyl-carnosine,C11H16N4O4) 等[1]。早在1900 年,俄罗斯化学家GULEWITCH,et al[2]在牛肉类提取物中首次发现肌肽。随后,一系列肌肽同系物被发现,由于肌肽及其同系物中均含有组氨酸残基,因此,这一类二肽被统称为组氨酸二肽[3-6]。组氨酸二肽在生物体内具有多种生理活性,已报道的包括酸碱平衡[7]、自由基清除[7]、金属螯合离子[8]、抗氧化[9-10]、抗痛风[11]等活性;此外,组氨酸二肽在糖尿病[12-13]、心血管疾病[14]、解毒[15]、神经医学[16]、营养学等领域也具有重要的应用价值。因此,对生物体内组氨酸二肽的研究一方面有助于了解该物种的营养价值;另一方面也有助于从中开发组氨酸二肽为来源的各类特殊食品和保健品。
目前市场上销售的组氨酸二肽制品主要来源包括化学合成和天然生物提取。其中化学合成法生产的组氨酸二肽由于生产过程中很难避免化学污染,且成本较高,因而限制了其应用[17];而生物体内组氨酸二肽的提取主要来源于金枪鱼、鲣鱼和鲔鱼等深海鱼类的肌肉组织,但这些深海鱼存在捕捞难、价格贵等缺点,同样限制了组氨酸二肽的生产和应用。组氨酸二肽主要存在于动物肌肉以及神经组织,特别是在畜禽类[18]、哺乳动物类[19]以及部分高经济价值洄游性鱼类肌肉中[20],组氨酸二肽的研究较为深入。但整体而言,目前对水产类经济物种的组氨酸二肽相关研究尚不多见。
舟山海域作为我国最大的渔场,海洋渔业资源丰富。为进一步了解舟山海域常见经济物种体内组氨酸二肽的含量,选择35 种舟山海域常见经济水产物种以及金枪鱼、鲣鱼和三文鱼;同时,采用鸡胸肉组织作为参照。首先通过超滤法开展肌肉组织中组氨酸二肽的提取,之后采用邻苯二甲醛(o-phthalaldehyde,OPA)显色法和高效液相色谱-质谱联用法(LC-NS/MS)两种方法对组氨酸二肽总量及不同同系物进行定量分析和比较;进一步采用经典的DPPH 法对上述物种的组氨酸二肽提取物开展了抗氧化活性分析。研究结果表明,舟山海域常见经济物种的肌肉组织中,多数均含有组氨酸二肽类物质,但组成成分存在差别;同时,发现显色法和液-质联用法对组氨酸二肽的定量分析结果在部分物种中存在差异。不同物种的组氨酸二肽提取物的抗氧化活性也存在明显差异。上述研究结果为深入了解舟山海域常见经济物种的营养价值,以及开发组氨酸二肽为来源的特殊食品和保健品提供了科学依据。
1 材料和方法
1.1 样品采集
35 种舟山海域常见经济物种主要采自舟山市嵊泗群岛海域或购自舟山市沈家门东河菜场,并经形态学鉴定确定其物种学名(表1);金枪鱼、鲣鱼和三文鱼购自浙江大洋世家股份有限公司;其中,硬骨鱼类26种,甲壳类7 种,软体动物类6 种。鸡胸肉(作为参照组)采自舟山本地饲养的三黄鸡。

表1 所有样品,学名及其采集地Tab.1 All samples,scientific names and collection locations
1.2 组氨酸二肽的提取
参照文献[21]方法,对上述物种首先提取其新鲜肌肉组织,经冷冻干燥充分脱水后,于肌肉干组织样品中加入去离子水进行匀浆处理;之后经冰浴超声(4 ℃,10 min)。超声处理后,对样品进行离心(4 ℃,12 000 g,15 min)。取上清液备用。沉淀部分继续加入1 mL 去离子水搅拌均匀,再经匀浆、超声、离心提取2 次;将3次所得上清液混合,以0.22 μm 水相滤膜过滤;之后进行超滤(截留分子量3 kD),收集滤过液冷冻干燥后待测。
1.3 邻苯二甲醛法测定肌肽和鹅肌肽含量
首先采用邻苯二甲醛(o-Phthalaldehyde,OPA)法[22]对样品中的组氨酸二肽进行检测。取待测样品10 μL,加入10 μL 三氯醋酸(TCA)加入20 μL 1 moL·L-1的NaOH,5 min 后加入20 μL 1%的OPA,1 min 后加入20 μL 1 moL·L-1的HCl。30 min 后测定630 nm 处吸光值(OD630)。肌肽,鹅肌肽标准品由上海强耀公司采用固相化学合成法合成。预先配制浓度分别为226、113、56.5、28.25、14.13、7.06、3.53 和1.7 μg·mL-1的肌肽标准品溶液和浓度分别为240、120、60、30、15、7.5、3.75 和1.88 μg·mL-1的鹅肌肽标准品溶液,按照上述方法测定吸光值,绘制标准曲线。
1.4 液质联用法测定肌肽、鹅肌肽和高肌肽含量
采用液相色谱-质谱联用仪(LC-MS/MS,赛默飞世尔科技公司)开展分析。取待测样品与乙腈1:1 混合后上样液-质联用仪。色谱条件为:采用UltiMate 3000 液相色谱仪,色谱柱为Acquity UPLC BEH Amide(17 μm,waters),柱温为35 ℃。流动相A 为乙腈/水(体积比3∶7),流动相B 为乙腈/水(体积比8∶2),为了促进离子化效果,A、B 流动相中均加入0.1% 氨水。洗脱时间为20 min,洗脱梯度为:0~10 min,100%~60% B;10~11 min,60%~40% B;11~11.5 min,40%~100% B;11.5~20 min,100% B。进样量为3 μL,流速为0.15 mL·min-1。质谱条件为:采用Q-Exactive 四级杆-静电场轨道阱高分辨质谱仪,全扫描正离子模式下(质量范围:m/z 150~500),分辨率70 000,自动增益控制(AGC)目标值3e6;喷雾电压为350 KV,离子传输管温度为275 ℃,鞘气压30 arb,辅助气压10 arb,气化室温度350 ℃。在样品运行前对仪器进行正离子校正。
1.5 抗氧化实验
采用经典的DPPH(1,1-二苯基-2-三硝基苯肼)法[23],检测组氨酸二肽提取物的抗氧化活性。取上述物种肌肉组织组氨酸二肽提取物的冻干粉末样品溶于去离子水,样品终浓度为1 mg·mL-1;以无水乙醇做参比,于519 nm 波长下测吸光度。根据以下公式计算样品对DPPH 自由基的清除率:清除率=(A0+A1-A2)/A0×100%;式中,A0 为对照组的吸光值;A1 为空白组的吸光值;A2 为实验组的吸光值。对照组分别为维生素C、肌肽和鹅肌肽标准品,终浓度为1 mg·mL-1,按照相同的方法测得吸光值并与样品组进行比较。
2 结果
2.1 OPA 法鉴定结果
采用OPA 显色法首先对肌肽,鹅肌肽标准品进行了标准曲线绘制,结果如图1,由图可见,肌肽和鹅肌肽2 种标准品对OPA 具有明显的显色反应且呈浓度依赖性,其回归方程分别为y=0.014 15 x-0.031 04(肌肽)和y=0.013 89 x-0.005 54 (鹅肌肽);线性范围分别为1.70~226 μg·mL-1(肌肽)和1.88~240 μg·mL-1;线性关系良好,R2值在0.999 以上。

图1 采用OPA 显色法绘制的肌肽(A)与鹅肌肽(B)标准曲线Fig.1 The standard curves of carnosine (A) and carnosine (B) were drawn by OPA colorimetry
OPA 法检测结果如图2。所有检测物种肌肉组织中均可检测出组氨酸二肽,其中鸡胸肉含量最高,为28.07 μg·mg-1干组织,其次为厚壳贻贝(24.17 μg·mg-1)和秋刀鱼(21.43 μg·mg-1)。在26 种鱼类肌肉中,组氨酸二肽含量在4.21~21.43 μg·mg-1干组织间,不同鱼类之间差异很大。在7 种甲壳类物种肌肉组织中,组氨酸二肽含量在4.81~8.66 μg·mg-1之间,其中哈氏仿对虾组氨酸二肽含量最高;6 种软体动物肌肉组织中,组氨酸二肽含量范围在7.22~24.17 μg·mg-1之间。其中,厚壳贻贝的组氨酸二肽含量最高;2 种头足类生物中,中国枪乌贼组氨酸二肽含量为9.37 μg·mg-1,曼氏无针乌贼组氨酸二肽含量为15.34 μg·mg-1。

图2 OPA 法鉴定不同物种的组氨酸二肽含量.Fig.2 The content of histidine-containing dipeptides in different species was determined by OPA method
2.2 LC-MS 法鉴定结果
考虑到组氨酸二肽含有不同的同系物,其中以肌肽,鹅肌肽和高肌肽最为常见,因此,进一步采用液-质联用法对上述物种肌肉组织中的组氨酸二肽的不同同系物进行分析。分别采用肌肽(分子量227.11)、鹅肌肽(分子量241.12)和高肌肽(分子量241.12)作为标准品。3 种组氨酸二肽标准品的二级质谱鉴定结果如图3,由图3 可见,三种组氨酸二肽标准品的特征峰明显,且与其母离子断裂后的碎片峰质量一致。

图3 组氨酸二肽标准品的二级质谱图Fig.3 Secondary mass spectrum secondary mass spectrum of histidine-containing dipeptides standard
所测39 个物种的3 种组氨酸二肽含量如图4 所示。多数硬骨鱼类的肌肉组织中均含有肌肽和鹅肌肽,且鹅肌肽含量显著高于肌肽(P<0.05);仅少数物种,如带鱼Trichiurus lepturus,小黄鱼Larimichthys polyactis,龙头鱼Harpadon nehereus、蛇鳗和日本鲭Scomber japonicus 肌肉组织中可鉴定到高肌肽的存在,且含量较低。此外,有14 个物种未能通过液-质联用法鉴定到组氨酸二肽,包括斑条躄鱼Antennarius striatus、大弹涂鱼Boleophthalmus pectinirostris、刺鲳Psenopsis anomala 3 种鱼类以及软体动物和甲壳类生物。
所检测物种中,鸡胸肉的肌肽和鹅肌肽的总含量最高,其中肌肽含量为6.97 μg·mg-1;鹅肌肽含量为21.11 μg·mg-1;其次为金枪鱼Thunnus tonggol(肌肽:0.014 μg·mg-1;鹅肌肽:7.06 μg·mg-1)、短尾大眼鲷Priacanthus macracanthus(肌肽0.02 μg·mg-1;鹅肌肽:4.13 μg·mg-1)、鲣鱼Katsuwonus pelamis(肌肽:1.12 μg·mg-1;鹅肌肽:4.66 μg·mg-1)等。
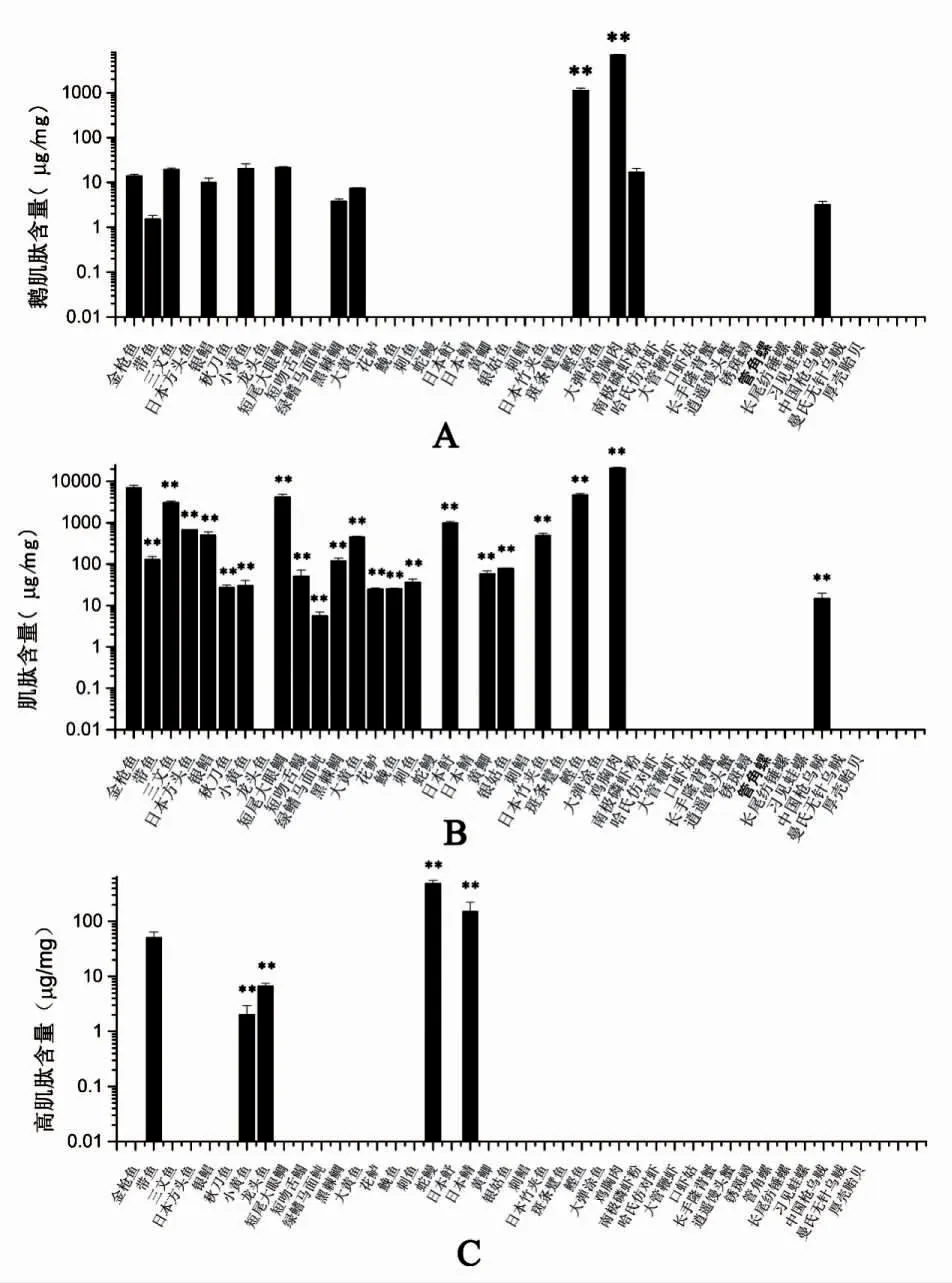
图4 LC-MS 法鉴定的不同物种肌肉组织中肌肽、鹅肌肽和高肌肽含量Fig.4 The contents of carnosine,anserine and homocarnosine in muscle tissues of different species identified by LC-MS method
2.3 DPPH 抗氧化实验结果
不同物种的组氨酸二肽提取物的DPPH 清除能力如图5 所示,其中,作为对照组的维生素C(1 mg·mL-1)的清除率为74.00%;肌肽标准品(1 mg·mL-1)的清除率为17.18%;鹅肌肽标准品(1 mg·mL-1)的清除率为13.73%。多数物种的组氨酸二肽提取物在1 mg·mL-1浓度下都具有明显的DPPH 清除能力,仅大黄鱼Larimichthys crocea 和蛇鳗未能鉴定到DPPH 清除能力。多数物种的DPPH 清除能力显著低于维生素C(P<0.05),但明显高于肌肽和鹅肌肽标准品(P<0.05)。其中,银鲳Pampus argenteus、银姑鱼Pennahia argentata 和厚壳贻贝Mytilus coruscus 的组氨酸二肽提取物具有较高的DPPH 清除率,分别为65.20%、63.52%和62.64%,仅次于维生素C。其次为鸡胸肉54.38%和秋刀鱼Cololabis saira 49.64%。
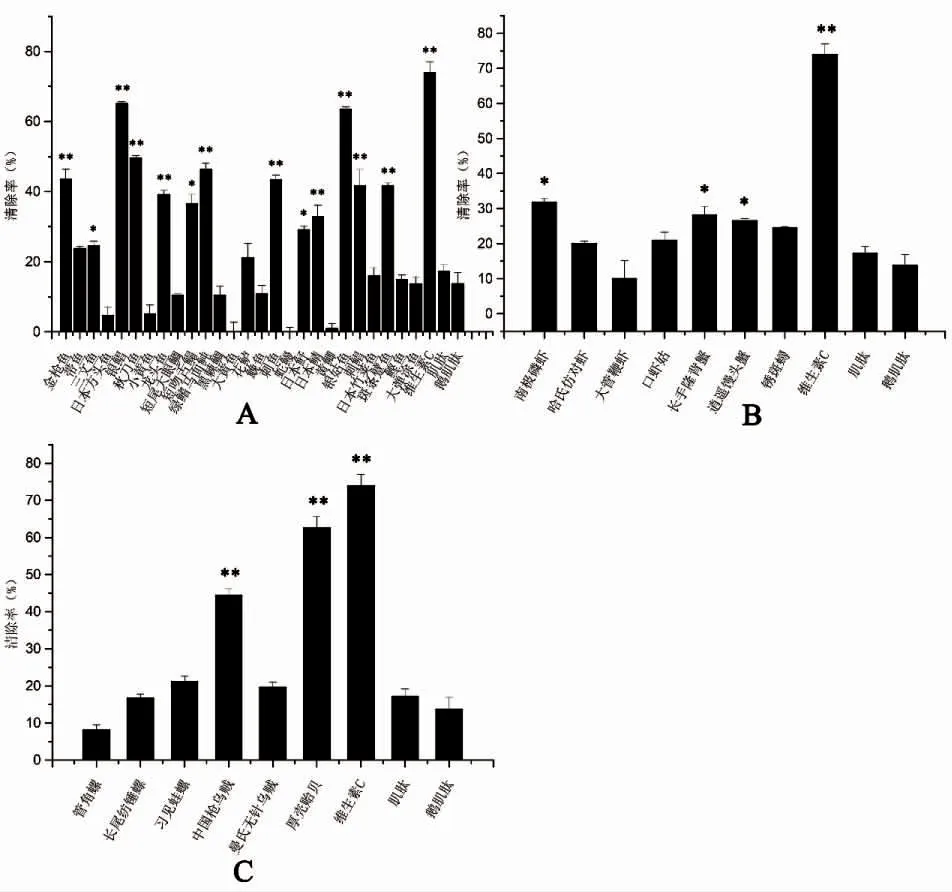
图5 不同物种组氨酸二肽提取物的DPPH 抗氧化实验结果Fig.5 DPPH antioxidant results of histidine dipeptide extracts from different species
3 讨论
目前,针对组氨酸二肽含量的研究主要集中在哺乳动物类。不同哺乳动物组氨酸二肽的含量差异极大,含量最高的为海洋哺乳动物,如蓝鲸Balaenoptera musculus(组氨酸二肽含量12~14 μg·mg-1湿组织)[24],含量最低的为鼠(约0.24 μg·mg-1湿组织)[25]。鱼类中,目前已知组氨酸二肽含量在金枪鱼(属于鲈形目旗鱼科)肌肉组织中含量最高(约15 μg·mg-1湿组织),其次为鲑形目(4~10 μg·mg-1湿组织);而在鲤形目和鲱形目中,基本检测不到组氨酸二肽[20,26];其他物种中,已知在鸟类(雁形目和鸡形目)以及爬行动物(有鳞目)中含有较高的组氨酸二肽[27];但是在甲壳类动物和软体动物中,关于组氨酸二肽含量研究尚未见报道。
组氨酸二肽的含量测定目前已有包括显色法,高效液相色谱法以及质谱法等多种方法[28]。其中,利用OPA 试剂与组氨酸二肽发生颜色反应并用以定量检测是最为简便的方法,可鉴定组氨酸二肽的总含量。该方法由ALEKSANDER,et al[22]发明,其原理在于OPA 与组氨酸二肽反应可发生从砖红色到紫色最终变为蓝色的显色反应。利用该方法,对所39 个物种进行检测,结果表明所测物种的肌肉组织中均含有不同浓度的组氨酸二肽,其浓度范围介于4~28 μg·mg-1干组织之间。其中,本研究采用OPA 法测得的鸡胸肉组织中组氨酸二肽含量(28.07 μg·mg-1)与PEIRETTI,et al[21]采用液-质联用法测得的鸡胸肉中组氨酸二肽含量(25.30 μg·mg-1)基本一致,也与DU,et al[29]所测结果接近;同时,本研究进一步采用了液-质联用法测定鸡胸肉组织中的组氨酸二肽含量,结果表明,鸡胸肉组织中含有肌肽和鹅肌肽总量为28.08 μg·mg-1,与OPA 法所测数据无显著差异(P>0.1)。上述结果表明,采用OPA 法检测组氨酸二肽含量具有一定的可靠性。但从其他物种的检测结果来看,两种检测方法(OPA 法和液-质联用法)所获得的结果存在较大差异且无明显相关性。除少数物种(如短尾大眼鲷Priacanthus macracanthus)外,采用OPA 法所测结果明显比液-质联用法测定结果要高(约8.8 倍),这可能与OPA 法测定的是组氨酸二肽的总量,而液-质联用法测定的三种组氨酸二肽同系物的含量所导致。此外,考虑到OPA 法利用的是显色反应,而动物肌肉组织中,除了组氨酸二肽,尚有其他物质,包括组氨酸二肽的组成单体(丙氨酸和组氨酸)以及亮氨酸等[22],也可能与OPA 试剂发生颜色反应从而干扰到测定结果。因此,液-质联用法相对于OPA 法,对组氨酸二肽进行测定具有更好的特异性和准确度;但OPA 法因其操作简便,检测成本较低,因此也可作为组氨酸二肽的粗略鉴定技术。
目前,多数已报到的哺乳动物组氨酸二肽主要成分是肌肽,但是在鱼类中,其主要成分为鹅肌肽,鸟类中同样以鹅肌肽为主,而在蛇类和鲸类中则以鲸肌肽(蛇肌肽)为主[27]。从本研究结果来看,采用液-质联用法,在鱼类和鸡胸肉组织中,所测定的组氨酸二肽主要成分为鹅肌肽,肌肽含量平均仅为鹅肌肽含量的十分之一。部分鱼类中仅检测到鹅肌肽,而未能检测到肌肽,如鲳鱼,海鲈鱼和鮸鱼。高肌肽是肌肽的-丙氨酸被-氨基丁酸取代后的产物,目前研究尚不多见。在所检测的物种中,仅少数物种含有高肌肽,包括带鱼,小黄鱼,龙头鱼、蛇鳗和日本鲭肌肉组织。这表明高肌肽在所测鱼类样品中并非广泛存在。但值得注意的是,在龙头鱼,蛇鳗和日本鲭中,仅检测到高肌肽的存在,而未能检测到肌肽与鹅肌肽的存在。这表明,鱼类中,组氨酸二肽家族的不同成员在不同物种中的分布差异较大,推测可能与不同物种的生活习性和生理特征有关。
目前,此前已有报道表明组氨酸二肽在生物体内具有抗氧化活性。DPPH 清除率结果表明,所测物种的组氨酸二肽提取物均具有明显的DPPH 清除能力,但该活性与组氨酸二肽的含量之间并无明显的相关性。同时我们也注意到,多数物种的组氨酸二肽提取物在同等浓度下,其抗氧化活性要强于肌肽和鹅肌肽标准品。这可能是因为组氨酸二肽提取物中含有其他具有抗氧化活性的小分子物质所导致。已知海洋生物中富含各种抗氧化活性物质,包括牛磺酸[30],抗氧化肽[31],类胡萝卜素(虾青素)[32],以及部分脂肪酸分子[33]等。在本研究中,我们发现,甲壳类和软体动物类,尽管未能在液-质联用法中检测到组氨酸二肽的存在,但其提取物仍表现出较强的DPPH 清除率,表明上述物种中可能存在其他抗氧化活性的物质。
通过上述研究,对舟山海域常见的35 种水产物种进行了组氨酸二肽含量测定和提取物的抗氧化活性分析,为了解常见海洋生物的组氨酸二肽不同成员的含量以及基于该含量的营养价值判断奠定了基础。
