乙型肝炎病毒慢性感染与其表面抗原基因突变的相关性*!
2013-05-16王卫华宋建新
王卫华, 宋建新
华中科技大学同济医学院附属同济医院感染科,武汉 430030
乙型肝炎病毒(hepatitis B virus,HBV)慢性感染过程中存在病毒免疫逃逸,可能与其从免疫耐受到免疫激活状态过程中,T、B细胞抗原表位在面临免疫选择压力时发生改变,从而使其躲过免疫系统监视有关。在HBV感染自然史的不同时期中,乙肝表面抗原滴度存在显著差异[1-5],这一现象可以推测,表面抗原在HBV感染中有重要意义,其基因突变可能在慢性HBV感染的发病机制和感染自然史中发挥着潜在作用。
1 材料与方法
1.1 血清样本及资料收集
收集2009年9月至2011年12月武汉同济医院收治的慢性乙肝患者280例。患者年龄范围18至70岁,其中男性175例,女性105例。入选要求:①HBsAg阳性病史大于半年。②排除甲肝、丙肝、丁肝、戊肝、艾滋病等病毒感染;排除自身免疫性肝病、淤血性肝病、酒精性肝病、代谢性肝病、药物性肝病引起的肝炎;排除脂肪肝;③HBV荧光定量>1×103拷贝/mL;④从未接受核苷类似物及干扰素等抗病毒治疗。所有患者血清样本均于-80℃保存,用于后续的HBV基因组DNA荧光定量检测。
1.2 DNA提取及荧光定量
本实验采用上海复星长征医学科学有限公司生产的HBV核酸定量检测试剂盒(PCR-荧光探针法)进行检测。按照说明书处理样本及对照品,并配置试剂。随后进行荧光定量PCR扩增,50℃反应2 min,然后在94℃保温5min,接着按照93℃30s~60℃90s的程序循环40次。在60℃时设定荧光定量PCR仪收集FAM荧光通道的信号。最后进行质量监控,并按仪器及软件要求进行结果保存和数据分析。
1.3 HBV表面抗原基因克隆
根据欲扩增的HBV表面基因序列,通过Primer Premier 5.0软件设计引物,进行巢式PCR扩增。根据S基因最保守的区域,我们设计一套外侧和内侧引物。外侧引物的上游序列为5′-GGGTCACCATATTCTTGGGAAC-3′,下 游 序 列 为 5′-GGGGGTTGCGTCAGCAAACAC-3′;内侧引物上游 序 列 为 5′-ACTTTCCTGCTGGTGGCTCC-3′,下游序列为 5′-CCCAAAGACAAAAGAAAATTGG-3′。使用SanPrep柱式DNA胶回收试剂盒回收扩增产物,与pMD19-T Vector(大连宝生物工程有限公司)连接,构建T载体克隆,随后将连接产物转化已制备好的大肠埃希菌DH5α感受态细胞进行扩增。最后用B型小量质粒快速提取试剂盒抽提质粒。
1.4 DNA测序
以PCR产物作为模板DNA测序,使用ABI PRISM3730DNA自动分析仪,按操作规程进行HBV DNA上下游序列双向测定,测序结果用Chromas软件转化为FASTA格式,与GenBank上登记的HBV DNA标准序列比较。
1.5 突变位点及抗原表位分析
为了便于分析,本研究将乙肝表面抗原的突变重点放在表面抗原区,共研究了15个抗原表位,其中包含两类T细胞表位,即辅助性T细胞(Th)表位,包括 17-31 区域、37-51 区域、67-81 区 域、139-146区域、165-179区域和176-190区域;细胞毒性T淋巴细胞(CTL)表位,包括14-22区域、41-49区域、95-109区域、150-158区域、190-197区域和196-206区域。还有B细胞抗原表位,包括93-106区域、106-130区域和124-147区域。
1.6 统计分析
所有数据均使用SPSS 12.0软件进行统计分析。对两组或多组间的分类变量或者连续变量进行比较,分类资料采用卡方检验,连续变量采用Mann-Whitney检验和Kruskall-Wallis检验等非参数检验。研究对象的HBV DNA水平将数据转换为对数形式(lg)后进行分析。所有结果采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组患者临床资料
280例慢性HBV感染者基因型均为HBV B基因型或C基因型,未发现其他基因型。将处于HBV感染自然史各时期的患者分为:免疫耐受(IT)组(n=76)、免疫清除(IC)组(n=75),不活跃(IN)组(n=66)和 HBeAg阴性肝炎(ENH)组(n=63)。患者基本特征在表1中列出。患者中男性(65%)较多,乙肝病毒 B基因型毒株(76.4%)较多。在HBeAg阳性的两组中,处于免疫耐受期的患者年龄比免疫清除期的小,同时HBV DNA含量较高而ALT值较低。在HBeAg阴性的群体中,ENH组的病毒滴度以及ALT值均高于IN组。
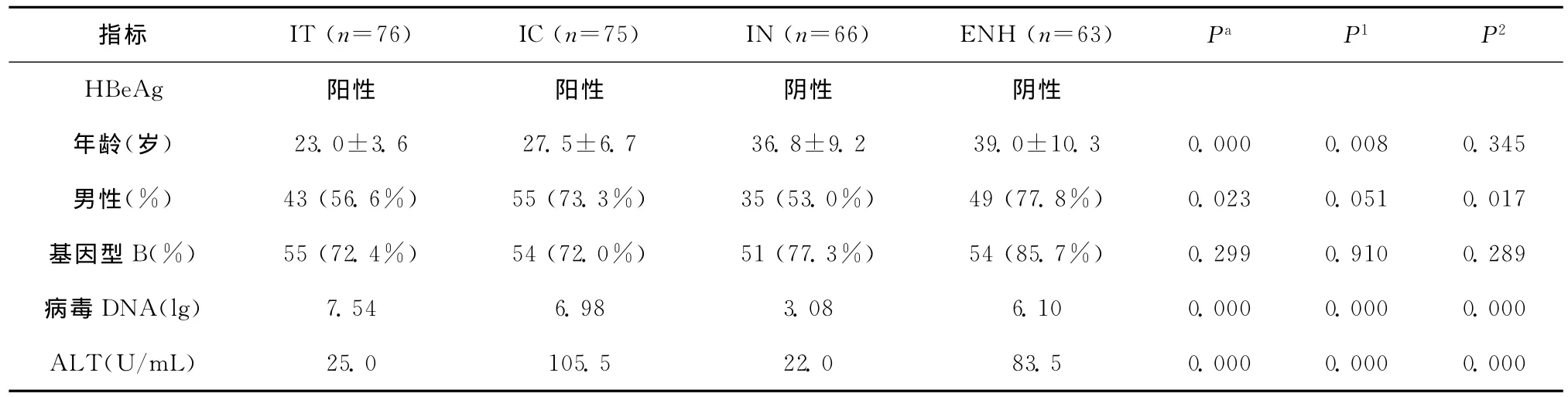
表1 各组患者临床资料Table 1 Clinical data of the patients in different groups
2.2 Th抗原表位突变分析
各组HBV表面抗原Th抗原表位突变中,在4组间比较时具有统计学差异的是17-31、37-51、67-81等区域(P<0.05),其余的 139-146、165-179、176-190等区域未发现显著性差异(P>0.05),如表2所示。而进一步的两组之间的数据分析显示,这些差异主要来自HBeAg阳性的样本,即IT和IC组,以及HBeAg血清学转换前后的两组(IC和IN组)。在HBeAg阴性的两组中差异没有统计学意义。在17-31区域,最主要的突变发生在L21S,该突变在4组中的突变率分别为1.6%、10.0%、12.5%和16.0%。在37-51区域,IT 组发现1个G44E 突 变 (1.6%);IC 组 发 现 了 N40S 突 变(5.0%),同时 44 位点(G44E,G44V)突变率达13.3%,47位点(T47K、V47E、T47A)突变率达到8.3%;IN组中N40S、G44E和47位点突变率分别为27.5%、17.5%和7.5%;ENH 组 N40S和 GEE4突变率分别为20.5%和6.8%。在67-81区域,IT组只发现I68T突变(1.6%),在IC组发现3个I68T突变(5.0%),IN组和ENH组I68T突变率分别为17.5%和11.4%。
2.3 CTL抗原表位突变分析
各组乙肝表面抗原CTL抗原表位突变中,在4组间比较时具有统计学差异的是14-22、41-49区域(P<0.05),其余的95-109、150-158、190-197、196-206等区域未发现显著性差异(P>0.05),如表2所示。进一步的分析同样显示差异主要来自于HBeAg阳性的样本,其他的几组样本间差异无统计学意义。在14-22区域,最主要的突变仍然是L21S,4组突变率分别为1.6%、11.8%、12.5%和15.9%。41-49区域的突变情况与Th抗原表位37-51区域的突变情况一致。
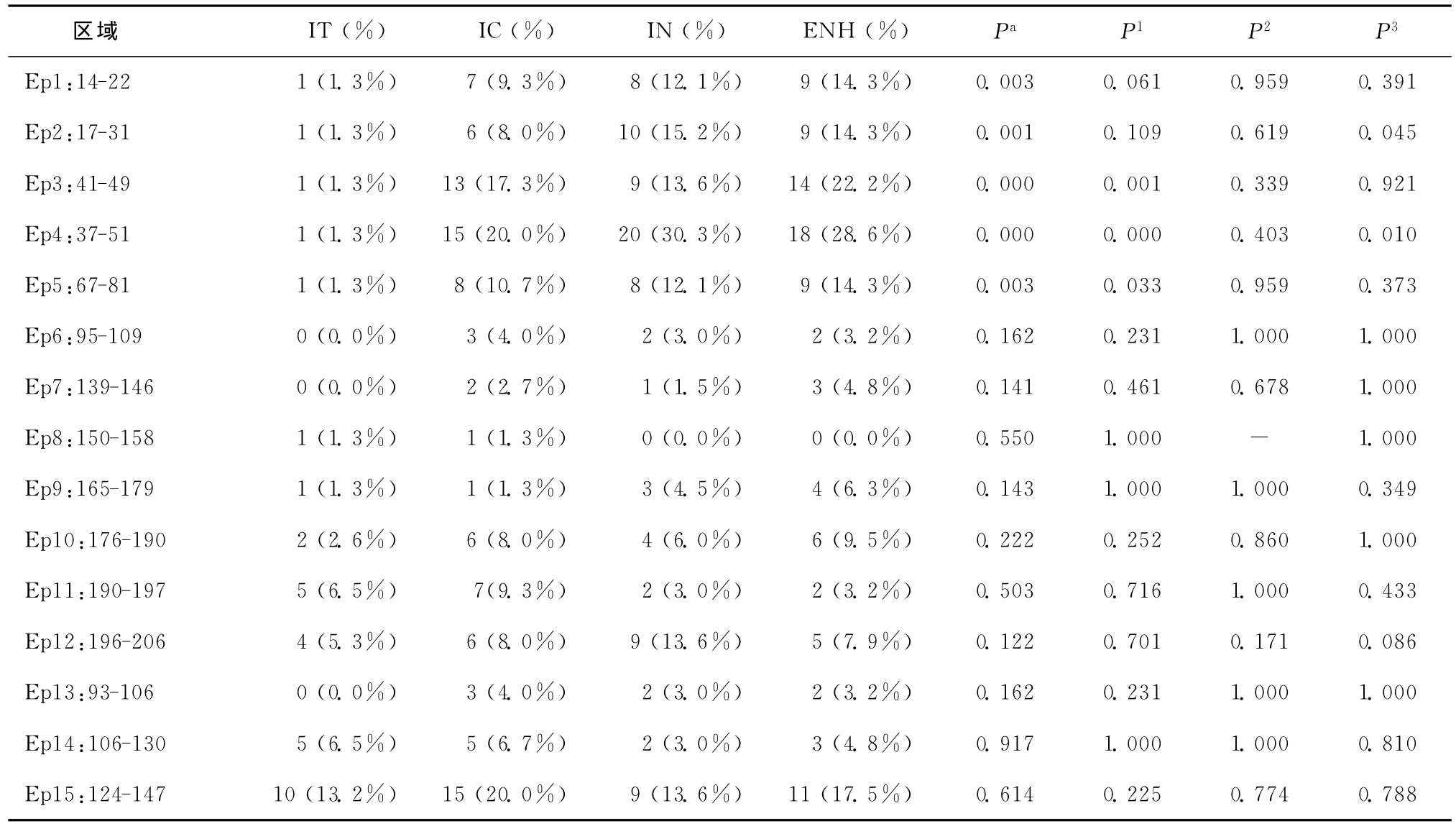
表2 乙肝表面抗原各免疫抗原表位的突变情况Table 2 Mutations of the immune antigen epitopes of the hepatitis B surface antigen
2.4 B细胞抗原表位突变分析
经过统计学分析,这4组患者的乙肝表面抗原B细胞抗原表位突变差异无统计学意义(P>0.05)。4组中,均发现乙肝表面抗原免疫逃逸突变的存在。在IT组中发现T126S、Q129H、M133L;IC组中发现 Q101K、T126S、M133L、M133I和M133T;IN组中发现M133L和M133T;ENH组中发现T126S、M133L逃逸突变。
3 讨论
在早期的 HBV感染中,HBV准种(quasispecies)没有或者只受到很小程度的宿主免疫选择压力[6-7]。在十几岁的慢性乙型肝炎患者,机体会进入一个相对活跃的免疫病毒清除期以控制病毒复制[8]。以往对HBV慢性感染史的研究发现,病毒的突变体与疾病的进展相关[9],包括核苷酸和结构的变化,如插入、缺失和删除。普遍认为对于病毒免疫逃逸的机制,其突变主要发生在MHC-Ⅰ细胞毒性T细胞表位内[10],随着研究的深入人们发现HBV核心抗原中突变累积出现在MHC-Ⅱ辅助性细胞表位内[11]。除了核心蛋白,以前的研究也发现了在乙肝病毒S蛋白中HLA-Ⅰ类限制性抗原表位和“a”抗原决定簇内部的突变存在很高的变异率[12-14]。对于乙肝表面抗原的研究发现突变累积与MHC-Ⅰ类抗原表位相关,40和47位密码子的突变频率大约为83%[12]。然而,以往的研究往往集中于相对后期的感染,例如,在发展为肝硬化或肝癌(通常是40岁后),或在活动期肝炎或HBeAg血清转换后(通常围产期感染的大多发生在20岁后),或者是集中于相对前期的感染,即从免疫耐受期过渡到免疫清除期的阶段,而很少有文献报道在整个HBV感染自然史中表面抗原免疫逃逸突变分布情况。
在本项研究中,我们基于HBV感染自然史中4个时期来研究表面抗原内逃逸突变分布。按照HBV感染自然史将收集的病例分为4个时期,分别是免疫耐受期、免疫清除期、不活动期和HBeAg阴性肝炎阶段。研究乙肝表面抗原Th抗原表位突变,在4组间比较时发现具有统计学差异的是17-31、37-51、67-81 等区域 (P<0.05),其余的 139-146、165-179、176-190等区域未发现显著性差异(P>0.05)。而进一步的两两比较发现,这些差异主要来自于HBeAg阳性的样本,即IT和IC组,以及在HBeAg血清学转换前后的两组中(IC和IN)。HBeAg阴性的两组间没有差异。在各组乙肝表面抗原CTL抗原表位突变中,4组间比较时差异具有统计学意义的是14-22、41-49区域(P<0.05),其余的95-109、150-158、190-197、196-206等区域未发现差异具有统计学意义(P>0.05)。进一步的分析同样显示差异主要来自于HBeAg阳性的样本,其他的几组样本间差异无统计学意义。这显示了在HBV感染自然史中,表面抗原CTL、Th抗原表位内突变主要发生在免疫清除期阶段,在不活跃期和HBeAg阴性肝炎期并没有显著的增加,表明在免疫清除期的免疫压力对于乙肝表面抗原具有重要的意义。此外,在B细胞抗原表位区域,发现了Q101K、P120S、T126S、Q129H、M133L、M133I、和 M133T等7个乙肝表面抗原免疫逃逸突变,这些突变在B、C基因型中的分布频率,与全球提交的HBV序列预测的逃逸突变在各个基因型中的分布频率几乎完全一致,证明了HBV免疫逃逸突变在慢性乙肝中广泛存在。说明在HBV感染的各个时期均可能影响表面抗原检测,引起免疫球蛋白、疫苗保护失活的免疫逃逸突变的存在,这需要引起我们足够的重视。
[1] Brunetto M R,Oliveri F,Colombatto P,et al.Hepatitis B surface antigen serum levels help to distinguish active from inactive hepatitis B virus genotype D carriers[J].Gastroenterology,2010,139(2):483-490.
[2] Chan H L,Wong V W,Wong G L,et al.A longitudinal study on the natural history of serum hepatitis B surface antigen changes in chronic hepatitis B[J].Hepatology,2010,52(4):1232-1241.
[3] Jaroszewicz J,Calle Serrano B,Wursthorn K,et al.Hepatitis B surface antigen (HBsAg)levels in the natural history of hepatitis B virus(HBV)-infection:a European perspective[J].J Hepatol,2010,52(4):514-522.
[4] Nguyen T,Thompson A J,Bowden S,et al.Hepatitis B surface antigen levels during the natural history of chronic hepatitis B:aperspective on Asia[J].J Hepatol,2010,52(4):508-513.
[5] Su T H,Hsu C S,Chen C L,et al.Serum hepatitis B surface antigen concentration correlates with HBV DNA level in patients with chronic hepatitis B[J].Antivir Ther,2010,15(8):1133-1139.
[6] Chang M H,Hwang L Y,Hsu H C,et al.Prospective study of asymptomatic HBsAg carrier children infected in the perinatal period:clinical and liver histologic studies[J].Hepatology,1988,8(2):374-377.
[7] Chen D S.Natural history of chronic hepatitis B virus infection:new light on an old story[J].J Gastroenterol Hepatol,1993,8(5):470-475.
[8] Chen D S.From hepatitis to hepatoma:lessons from type B viral hepatitis[J].Science,1993,262(5132):369-370.
[9] Chen B F,Liu C J,Jow G M,et al.High prevalence and mapping of pre-S deletion in hepatitis B virus carriers with progressive liver diseases[J].Gastroenterology,2006,130(4):1153-1168.
[10] Pircher H,Moskophidis D,Rohrer U,et al.Viral escape by selection of cytotoxic T cell-resistant virus variantsinvivo[J].Nature,1990,346(6285):629-633.
[11] Hosono S,Tai P C,Wang W,et al.Core antigen mutations of human hepatitis B virus in hepatomas accumulate in MHC class II-restricted T cell epitopes[J].Virology,1995,212(1):151-162.
[12] Tai P C,Banik D,Lin G I,et al.Novel and frequent mutations of hepatitis B virus coincide with a major histocompatibility complex class I-restricted T-cell epitope of the surface antigen[J].J Virol,1997,71(6):4852-4856.
[13] Ogura Y,Kurosaki M,Asahina Y,et al.Prevalence and significance of naturally occurring mutations in the surface and polymerase genes of hepatitis B virus[J].J Infect Dis,1999,180(5):1444-1451.
[14] Chen W N,Oon C J.Mutation"hot spot"in HLA class I-restricted T cell epitope on hepatitis B surface antigen in chronic carriers and hepatocellular carcinoma[J].Biochem Biophys Res Commun,1999,262(3):757-761.
