1,5-二咖啡酰奎宁酸减轻MPP+所致PC12细胞损伤的机制研究*
2013-05-16肖海兵李建英刘人恺李雯飞杨志刚林勤郁杨春水
肖海兵, 李建英, 曹 旭, 刘人恺, 李雯飞, 杨志刚, 林勤郁, 杨春水
1深圳市第六人民医院(南山医院)神经内科,深圳518052
2香港大学深圳医院神经内科,深圳 518053
3深圳市人民医院神经内科,深圳 518020
帕金森病(Parkinson’s disease,PD)是一种常见的神经变性疾病,给中老年人的生命健康带来了严重的威胁。据保守估计,我国PD患者数量超过了170万[1]。可以预见,随着我国社会人群逐渐老龄化,PD患者数量将逐年攀升,将给家庭和医疗卫生部门以及社会带来沉重的负担和挑战。
PD的主要病理特征是中脑黑质内多巴胺(Dopamine,DA)能神经元的选择性变性死亡,纹状体DA含量显著减少以及黑质残存神经元胞质内出现含有异常突触核蛋白(a-synuclein)嗜酸性包涵体——路易体(Lewy body,LB)[2]。迄今为止,PD的发病机制仍未完全阐明。大量的学者认为,氧化应激损伤,特别是神经元内的DA自氧化产生活性氧簇 (reactive oxygen species,ROS)可能是导致DA能神经元特异性损伤的关键因素[3]。
细胞在漫长的进化过程中,形成了精密而完善的内源性抗氧化系统。大量的基因敲除实验表明,内源性抗氧化系统对多种神经退行性疾病的损伤模型起到了重要的保护作用。因此,诱导细胞自身抗氧化基因表达上调是一个有效的对抗氧化应激损伤的手段。1994年Moi教授[4]发现,核因子2红系相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)是调控细胞内源性抗氧化基因表达的核心转录因子。当细胞受到氧化应激损伤时,Nrf2可以调控下游内源性抗氧化基因表达,发挥抗氧化作用[5]。
二咖啡酰奎宁酸(dicaffeoylquinic acids,diCQA)是一类酚酸类天然化学成分,可从东风菜、苍耳等药用植物中提取。数个研究提示该物质具有抗氧化、抗病毒、降血脂、神经营养、抗过度的炎症反应等多种药理作用,具有很好的临床应用前景[6-7]。1,5-二咖啡酰奎宁酸(1,5-dicaffeoylquinic acids,1,5-diCQA)是diCQA 的一种。我们前期的研究工作表明,奎宁酸对PD细胞模型具有保护作用,但其具体机制尚未得到深入研究。本实验采用1-甲基-4-苯基吡啶离子(MPP+)诱导PC12细胞损伤作为PD的体外模型,探索1,5-diCQA对PD细胞模型的保护机制[8]。
1 材料与方法
1.1 主要实验材料和仪器
1,5-diCQA由上海研域化学试剂有限公司提供,大鼠嗜铬瘤细胞株(PC12细胞)来自武汉大学典型培养物保藏中心。胎牛血清、DMEM培养液购于Gibco公司,抗Nrf2抗体购自英国Abcam公司,TritonX-100、胰蛋白酶购自 Biosharp公司,β-actin抗体购于Santa Cruz公司。活性氧检测试剂盒、CCK8试剂盒、细胞总谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成公司,聚丙烯酰胺凝胶试剂盒购自武汉博士德公司,PVDF膜购自美国Millipore 公 司。LY294002、PD98059、SP600125、SB202190均购自美国Sigma公司。其他试剂为分析纯(国产)产品。
1.2 细胞培养和分组
PC12细胞培养于含10%马血清、5%胎牛血清、0.1mg/mL NGF的RI1640培养液中,37℃5%CO2培养箱中培育,每隔1d换液,细胞丰度约达80%时,以0.125%胰蛋白酶消化传代,于对数生长期给药。实验分组如下:①正常对照组;②MPP+处理组:采用公认的MPP+损伤PC12细胞的造模方法[9],以250mmol/L的 MPP+处理 PC12细胞24 h,构建PD的细胞模型;③1,5-diCQA预处理+MPP+处理组:将各组细胞首先分别加入浓度10、20、50、100 μmol/L的1,5-diCQA,经过24h预处理后加入 MPP+(浓度如上)。每组均需设3个复孔。
1.3 CCK-8检测细胞存活率
于96孔培养板中培养各组PC12细胞,培养液总量为100mL/孔,按上述方法分组进行相应处理后,每孔加入10mL CCK-8溶液,37℃5%CO2培养箱中孵育4h,然后用全自动酶标仪于450nm波长,参考波长630nm,测定吸光度(A)值,细胞存活率(%)=(处理组A值/对照组A值)×100%。
1.4 谷胱甘肽(GSH)和细胞内活性氧族(ROS)水平检测
谷胱甘肽检测:以0.125%胰酶消化并收集各组细胞,冰上预冷的PBS洗涤2次,1 000r/min低速离心5min收集细胞,将细胞沉淀悬于RIPA裂解液,冰置30min使其充分裂解,12 000r/min低温离心15min,弃去沉淀收集上清,按照试剂盒说明书所述步骤,测定各组细胞内总GSH含量。
ROS检测:根据试剂盒说明书所描述的方法,在PC12细胞丰度达到80%左右(对数生长期)时,加药处理,收集细胞,加入CM-H2DCFDA,使终浓度为10 mmol/L。在37℃摇床上避光孵育30min以充分反应。采用Hitachi F-3000荧光检测仪,用485nm激发波长和520nm发射波长,检测DCF荧光强度,结果以与对照组ROS含量的百分比来表示。
1.5 Western blot检测Nrf2蛋白的表达水平
用0.125%的胰酶分别消化各组细胞,1 000r/min低速离心5min,将细胞沉淀用冰上预冷的PBS清洗2次,在细胞沉淀中加入RIPA裂解液,冰上放置10min充分裂解细胞,4℃下14 000r/min离心15min,取上清,用BCA法测定蛋白浓度,然后在蛋白样品中加入5×蛋白上样缓冲液混匀后煮沸变性5min。每个蛋白样品分别取50mg经聚丙烯酰胺凝胶电泳,200mA 1h电转移至PVDF膜,TBST漂洗3次,然后用含有5%脱脂奶粉的TBST常温封闭1h,TBST充分洗涤后,加一抗Nrf2抗体(1∶1 000,Abcam,UK)、β-actin抗体(1∶2 000,Santa Cruz,USA)4℃冰箱孵育过夜。一抗孵育完成后用TBST漂洗3次,辣根过氧化酶结合的二抗常温孵育1h,TBST充分洗涤后以ECL法显色并用扫描仪器扫描胶片。用Quantity One图像分析软件分析各条带灰度值,结果以与正常对照组灰度值的百分比表示。
1.6 siRNA转染
siRNA干扰序列参照已知的能够有效沉默Nrf2的序列合成[10],正义链:5′-UUAAGACACUGUAACUCGGGAAUGG-3′,反 义 链:5′-CCAUUCCCGAGUUACAGUGUCUUA-3′。 无 效 沉 默的片段的序列,正义链:5′-UAGCGACUAAACACAUCAAUU-3′,反 义 链:5′-AAUUGAUGUGUUUAGUCGCUA-3′。干 粉 siRNA 用 Free-Rnase水稀释成浓度为20mmol/L。然后参照Invitrogen公司的说明书,用Lipofectamine 2000进行转染。转染后48h进行后续的加药处理或者Western blot实验。细胞转染实验分组:①正常对照组(Control);②无效沉默组[Negative(NT)siRNA组];③实验组(Nrf2siRNA组)。
1.7 MAPK家族信号通路筛选实验
在正常的PC12细胞中分别加入PI3K/Akt通路抑制剂[LY294002(25mmol/L)],ERK 通路抑制剂[PD98059(10mmol/L)],JNK 通 路抑制 剂[SP600125(30mmol/L)],P38 通 路 抑 制 剂[SB202190(30mmol/L)],预处理1h之后再加入1,5-diCQA和 MPP+进行后续处理。
1.8 统计学分析
以GraphPad prism5.0软件分析处理数据,各指标结果用均数±标准差(±s)表示,采用单因素方差分析+Tukey法进行组间结果的比较分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 1,5-diCQA对 MPP+诱导损伤的PC12细胞具浓度依赖性的保护效应
本实验用CCK-8检测试剂盒测定PC12细胞存活率,以正常培养的PC12细胞代谢CCK-8试剂的吸光度代表100%细胞活力,结果表明:MPP+诱导之后PC12细胞存活率为 (48.81±2.88)%,细胞存活率明显下降(P<0.01)。给予1,5-diCQA预处理24h之后,MPP+处理导致的PC12细胞损伤得到了明显改善,上述效应具有浓度依赖性。见图1。
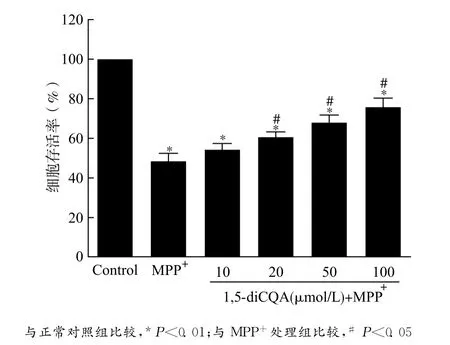
图1 1,5-diCQA呈浓度依赖性地保护 MPP+诱导损伤的PC12细胞Fig.1 1,5-diCQA concentration-dependently protected PC12cells against MPP+-induced injury
2.2 1,5-diCQA浓度依赖性地减轻 MPP+诱导的PC12细胞氧化应激损伤
为了评价1,5-diCQA的抗氧化作用,本研究对细胞内GSH和ROS进行检测。MPP+处理PC12细胞后,细胞ROS产生明显增高(P<0.01),另一方面,MPP+处理明显降低了细胞内的抗氧化物GSH 水平[MPP+处理组(5.07±0.73)nmol/mg proteinvs.对照组(13.89±1.26)nmol/mg protein,P<0.01],导致PC12细胞出现氧化损伤变性死亡。随后,我们以梯度浓度的1,5-diCQA对细胞模型进行预处理,再用MPP+处理细胞诱导损伤,结果发现ROS生成明显减少,GSH耗竭明显改善。因为100μmol/L浓度的1,5-diCQA所展示的保护效应已偏离线性曲线范围,所以接下来的保护机制研究均选择50μmol/L浓度作为我们的实验浓度。见图2。
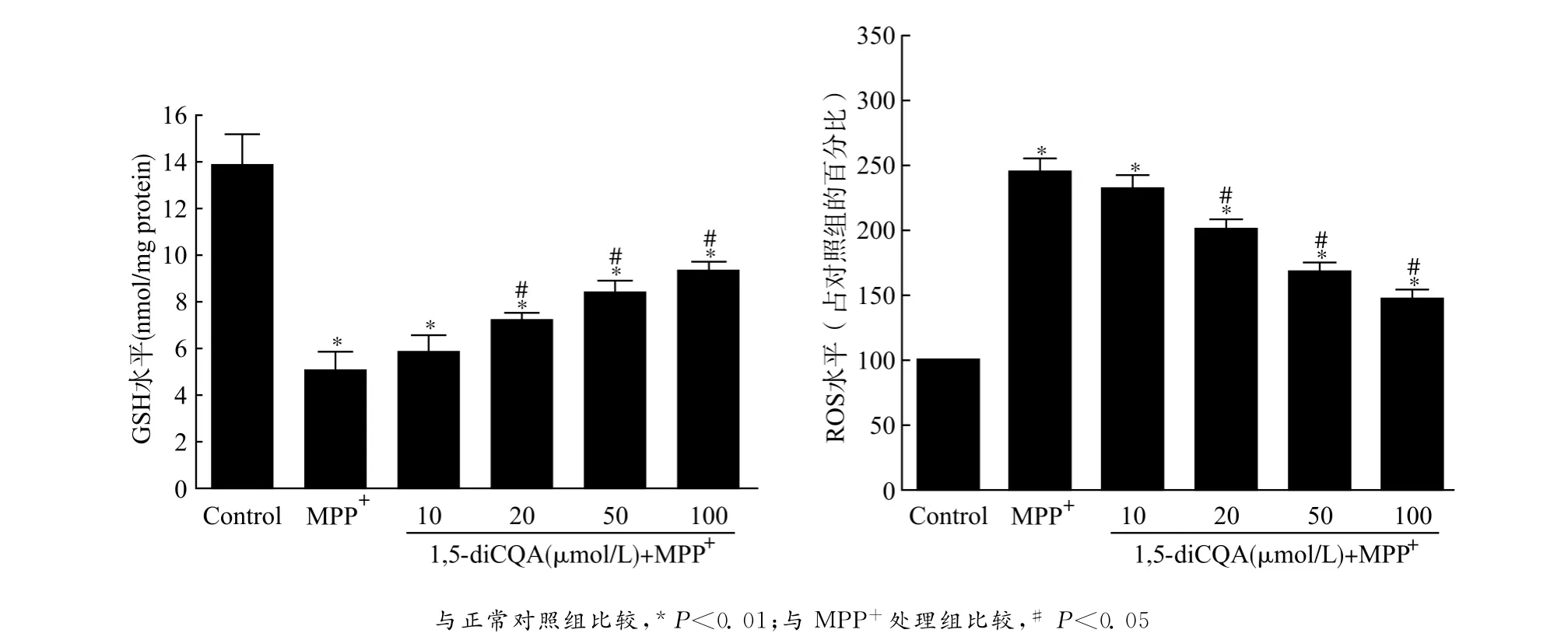
图2 1,5-diCQA可浓度依赖性地减轻MPP+所导致的PC12细胞氧化应激损伤Fig.2 1,5-diCQA concentration-dependently decreased the oxidative damage of PC12cells induced by MPP+treatment
2.3 1,5-diCQA通过激活Nrf2发挥细胞保护作用
利用Western blot方法检测Nrf2蛋白表达水平,结果表明:1,5-diCQA预处理PC12细胞可以明显增高Nrf2蛋白的表达,并呈剂量依赖性,这提示Nrf2介导1,5-diCQA对MPP+诱导氧化应激损伤的PC12细胞的保护作用,见图3。同时,运用基因干扰技术,能够明显地干扰Nrf2的表达水平,与无效沉默组(NT siRNA)相比,沉默效率为(56.15±2.36)%,见图4。用1,5-diCQA预处理 Nrf2沉默的PC12细胞,不能减轻 MPP+所致的细胞损伤,细胞存活率未能回升[MPP+组vs.MPP++1,5-diCQA 组:(19.47±1.65)%vs.(21.13±2.85)% ,P=0.352 6];GSH 水平在 Nrf2敲除的PC12细胞中明显下降[NT siRNA组vs.Nrf2siRNA组:(15.05±1.71)nmol/mg proteinvs.(4.31±0.83)nmol/mg protein,P<0.01],且1,5-diCQA预处理对GSH耗竭的逆转效应也消失,见图5。

图3 1,5-diCQA预处理对PC12细胞Nrf2蛋白表达的影响Fig.3 The effect of 1,5-diCQA pretreatment on Nrf2expression
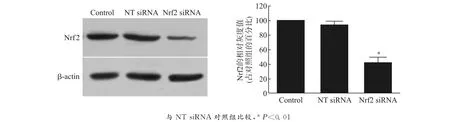
图4 siRNA干扰对PC12细胞Nrf2蛋白的沉默效率Fig.4 Silencing efficiency of siRNA transfection on Nrf2protein of PC12cells
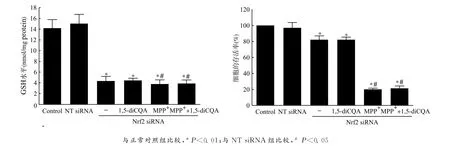
图5 敲除Nrf2消除了1,5-diCQA对MPP+诱导损伤的PC12细胞的保护作用Fig.5 The protective effect of 1,5-diCQA was lost in Nrf2-knockdown PC12cells
2.4 Erk激酶参与了1,5-diCQA激活Nrf2所介导的细胞保护机制
我们通过在培养液中加入不同的激酶抑制剂后进行细胞存活率检测,发现Erk激酶参与了Nrf2介导的对MPP+诱导氧化应激损伤的PCI2细胞的保护作用。检测结果显示:加入PI3K/Akt通路抑制剂和JNK通路抑制剂以及P38通路抑制剂预处理,均不能消除1,5-diCQA预处理对PD细胞模型的保护作用,只有ERK通路抑制剂PD98059可以消除,证明Erk激酶参与了这一保护过程。见图6。
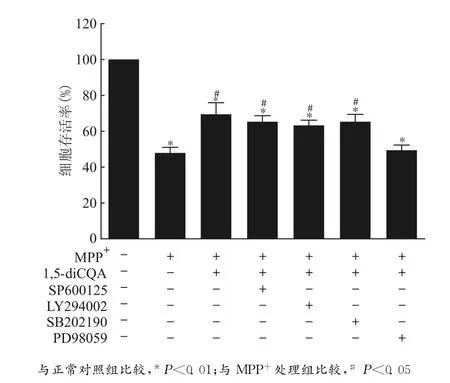
图6 Erk激酶参与了1,5-diCQA对MPP+诱导损伤的PC12细胞的保护作用Fig.6 Erk kinase signaling was involved in the protective effect of 1,5-diCQA on the MPP+-induced cell damage
3 讨论
环境毒素 1-甲基-4-苯基-1,2,3,6 四氢吡啶(MPTP)进入大脑后,经过神经胶质细胞产生的单胺氧化酶 B代谢形成1-甲基-4-苯基吡啶离子(MPP+),后者是一种神经毒性物质,它可经由主动运输进入细胞的线粒体,并特异性地抑制呼吸链中NADH2CoQ还原酶(复合酶Ⅰ)的活力,使ATP合成受阻,造成自由基的蓄积,导致细胞遭受氧化应激甚至变性死亡[11-12],从而导致灵长类动物产生类似PD的症状。另外,MPP+对单胺转运体2(VMAT2)的亲和力非常高,两者极易相互结合并被转运至DA能神经元的突触囊泡,从而影响DA在突触囊泡的贮存,造成突触体胞质的DA增多,DA通过自身氧化产生大量的自由基和醌类物质,导致了DA依赖性氧化应激增强[13]。因此,MPP+作为能够选择性触发DA能神经元损伤的物质,广泛地用于PD细胞模型的构建。
迄今,已有多个实验报告表明奎宁酸类物质拥有很强的抑制黄嘌呤氧化酶,清除羟自由基、超氧阴离子的能力,具备明确的抗氧化作用,学者们寄希望将其开发应用于动脉粥样硬化、神经变性疾病、肿瘤、感染等疾病的干预。本研究采用公认的MPP+损伤PC12细胞构建PD细胞模型,探索1,5-diCQA对PD细胞模型的保护作用及其机制。结果表明,在本研究的条件下,以1,5-diCQA预处理能以剂量依赖性地显著减少MPP+导致的PC12细胞GSH耗竭和ROS增多,显著提高细胞存活率。上述研究结果充分表明1,5-diCQA可以明显地减轻PD细胞模型的氧化应激损害,具备潜在的神经保护活性。
Nrf2是调控细胞内源性抗氧化基因表达的非常关键的转录因子。正常情况下,Nrf2与其分子伴侣 Keap1(Kelch-like ECH-associated protein 1)相结合,以相对失活状态存在于胞质中。当Keap1被氧化攻击时,或Nrf2被其上游各种磷酸化信号磷酸化后,Nrf2就会与Keap1解偶联并进入细胞核内,与抗氧化基因上游增强子的特异元件ARE结合,增进ARE依赖的抗氧化基因的转录活性,这些抗氧化基因的产物包括一系列的抗氧化酶,从而发挥抗氧化作用[14]。我们的实验结果显示,1,5-diCQA预处理PC12细胞能够明显上调Nrf2表达水平,提示Nrf2介导了1,5-diCQA的保护作用,而将Nrf2沉默之后,1,5-diCQA的保护作用消失,从而证实了1,5-diCQA的保护作用是通过激活Nrf2来完成的。
MAPK (mitogen-activated protein kinase,MAPK)家族在细胞分化、发育、存活及死亡等生理过程中发挥重要的调节作用[15]。细胞外信号调节激酶(extracellular-signal regulated kinase,Erk)是MAPK家族的重要成员之一。我们的实验结果显示,1,5-diCQA主要是通过激活Erk激酶,进而活化Nrf2,然后引起一系列的下游反应,从而显著减轻MPP+诱导的PC12细胞损伤。
PD病因和发病机制并不完全明确,目前认为各种因素如年龄老化、遗传因素、环境因素、氧化应激等原因导致DA能神经元的细胞毒性代谢物增多,后者加重了氧化应激损伤和胞内相关蛋白的异常修饰和聚集[16-18],这两者交互作用导致恶性循环,使细胞持续受损甚至变性死亡。因此如何延缓甚至逆转这一过程是将来PD防治工作的重点。本实验表明1,5-diCQA通过激活Erk激酶,然后激活Nrf2,进而引发下游的抗氧化产物的表达,从而对MPP+诱导的PC12细胞产生保护作用,对于将来PD的防治提供了重要的分子靶点,对于PD神经保护药物的研究具有很好的促进和提示作用。
(致谢:感谢华中科技大学神经生物学系罗振钊博士在实验技术上的无私指导和帮助。)
[1] Zhang Z X,Roman G C,Hong Z,et al.Parkinson’s disease in China:prevalence in Beijing,Xian,and Shanghai[J].Lancet,2005,365(9459):595-597.
[2] Blum D,Torch S,Lambeng N,et al.Molecular pathways innvolved in the neurotoxicity of 6-OHDA,dopamine and MPTP:contribution to the apoptotic theory in Parkinson’s disease[J].Prog Neurobiol,2001,65(2):135-172.
[3] Ashimoto M,Hsu L J,Xia Y,et al.Oxidative stress induces amyloid-like aggregate formation of NACP/alpha-synucleininvitro[J].Neuroreport,1999,10(4):717-721.
[4] Moi P,Chan K,Asunis I,et al.Isolation of NF-E2-related factor 2(Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1repeat of the beta-globin locus control region[J].Proc Natl Acad Sci USA,1994,91(21):9926-9930.
[5] Yang Y,Li Q,Shuaib A.Neuroprotection by 2-h postischemia administration of two free radical scavengers,alpha-phenyl-ntert-butyl-nitrone(PBN)and N-tert-butyl-(2-sulfophenyl)-nitrone(S-PBN),in rats subjected to focal embolic cerebral ischemia[J].Exp Neurol,2000,163(1):39-45.
[6] Hur J Y,Lee P,Kim H,et al.(-)-3,5-Dicaffeoyl-muco-quinic acid isolated from Aster scaber contributes to the differentiation of PC12cells:through tyrosine kinase cascade signaling[J].Biochem Biophys Res Commun,2004,313(4):948-953.
[7] Hur J Y,Soh Y,Kim B H,et al.Neuroprotective and neurotrophic effects of quinic acids from Aster scaber in PC12cells[J].Biol Pharm Bull,2001,24(8):921-924.
[8] Xiao H,Lv F,Xu W,et al.Deprenyl prevents 1mentyl 4phenylphyridinium induced oxidative damage in PC12cells by activation of NQO1via Nrf2-PI3K/Akt signaling[J].Toxicology,2011,290(2/3):286-294.
[9] Chinopoulos C,Adam-Vizi V.Mitochondria deficient in complexⅠactivity are depolarized by hydrogen peroxide in nerve terminals:relevance to Parkinson’s disease[J].J Neurochem,2001,76(1):302-306.
[10] Chen Z H,Yoshida Y,Saito Y,et al.Induction of adaptive response and enhancement of PC12cell tolerance by 7-hydroxycholesterol and 15-deoxy-delta (12,14)-prostaglandin J2 through up-regulation of cellular glutathione via different mechanisms[J].J Biol Chem,2006,281(20):14440-14445.
[11] Dunnett S B,Biorklund A.Prospects for new restorative and neuroprotective treatments in Parkinson’s disease[J].Nature,1999,399 (6738):32-39.
[12] 孙欣,吴艳,黄露麒,等 .b-catenin在 MPTP致 C57BL/6小鼠多巴胺能神经元损伤模型腹侧中脑的表达变化[J].华中科技大学学报:医学版,2009,38(4):453-456.
[13] Obata T.Dopamine efflux by MPTP and hydroxyl radical generation[J].J Neural Transm,2002,109 (9):1159-1180.
[14] 曹旭,肖海兵,杨燕,等.Nrf2活化剂SFP对 MMP+所致PC12细胞氧化应激损伤的保护作用[J].华中科技大学学报:医学版,2013,42(2):143-147.
[15] Yang S H,Sharrocks A D,Whitmarsh A.MAP kinase signalling cascades and transcriptional regulation[J].Gene,2012,513(1):1-13.
[16] Kalivendi S V,Cunningham S,Kotamraju S,et a1.Alpha-synuclein up-regulation and aggregation during MPP+-induced apoptosis in neuroblastoma cells:intermediacy of transferrin receptor iron and hydrogen peroxide[J].J Biol Chem,2004,279 (15):15240-15247.
[17] Rabinovic A D,Lewis D A,Hastings T G,et a1.Role of oxidative changes in the degeneration of dopamine terminals after injection of neurotoxic levels of dopamine[J].Neuroscience,2000,101(1):67-76.
[18] 胡丹,张振涛,曹卫,等.N-乙酰半胱氨酸拮抗鱼藤酮致PC12细胞凋亡的研究[J].华中科技大学学报:医学版,2011,40(3):315-319.
