去甲斑蝥素对裸鼠结肠癌移植瘤血管生成的影响及其机制!
2013-05-16袁昌劲侯风刚吕秀玮
袁昌劲, 余 涛△, 侯风刚, 李 丹, 刘 礼, 吕秀玮, 任 丽
1华中科技大学同济医学院附属武汉中心医院中西医结合肿瘤科,武汉 430014
2上海中医药大学附属上海市中医医院肿瘤科,上海 200071
3武汉大学人民医院药学部,武汉 430060
去甲斑蝥素(norcantharidin,NCTD)是我国自行研发的抗肿瘤药物,多年的临床运用已经证实该药具有抗癌活性强、靶点众多、毒副作用小的特点。至于其抗肿瘤机制,以往的研究对其细胞毒作用关注较多,后来发现NCTD还具有抗胆囊癌、乳腺癌血管生成的作用,其机制和NCTD诱导内皮细胞凋亡[1-3],减少内皮细胞血管活性物质的释放,下调血管生成因子如血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、促血管生成素2(angiopoietin-2,Ang-2)以及上调血管抑制因子如血小板反应蛋白(thrombospondin,TSP)、金属蛋白酶组织抑制因子2(tissue inhibitor of metalloproteinases-2,TIMP2)的表达有关[1,4]。随着临床应用的扩展,NCTD也用于消化道肿瘤包括肠癌的治疗,然而其对肠癌血管生成的影响至今未见报道。本课题组前期通过体外实验证实NCTD能够抑制内皮细胞迁移、粘附、管腔形成能力和血管内皮生长因子受体2(vascular endothelial growth factor receptor-2;VEGFR-2)、内皮细胞钙粘蛋白(vascular endothelial cell cadherin,VE-Cd)的表达[5]。本文则从体内实验的角度观察NCTD对人结肠癌裸鼠皮下移植瘤和瘤内微血管的影响。由于VEGF[6]、VE-Cd[7]、基质金属蛋白酶2(matrix metalloproteinase-2;MMP-2)[8]等促血管生成因子的表达在肿瘤血管生成过程中起着决定性作用,本实验拟通过观察NCTD对这些因子表达水平的影响,进而探讨NCTD抗结肠癌血管生成的可能机制。
1 材料与方法
1.1 细胞与动物
人结肠癌细胞株(HCT116)购自中国科学院上海细胞库;SPF级BALB/C裸鼠,雄性,体重15g,购自上海西普尔-必凯实验动物有限公司[生产许可证号为SCXK(沪)2003-002],饲养于上海中医药大学附属普陀医院SPF级动物饲养间[许可证号为SYXK(沪)2005-2008],自由摄食饮水。
1.2 药物、试剂与仪器
NCTD购自南京泽朗医药科技公司(纯度>99%);RPMI-1640培养液和胎牛血清(FBS)购自美国Gibco公司;兔抗VE-Cd单克隆抗体购自Abcam公司,兔抗VEGF、MMP-2和CD34多克隆抗体以及辣根过氧化物酶标记的山羊抗兔多克隆抗体购自R&D公司。
1.3 细胞培养与动物造模
细胞用含10%胎牛血清、10万U/L青霉素和100mg/L链霉素的高糖DMEM 培养液,在5%CO2、37℃培养箱中培养,适时换液、传代,连续培养3代以上。造模取对数生长期的HCT116细胞,常规消化后制成密度为1×107/mL的细胞悬液,取0.5mL接种于裸鼠右前肢腋部皮下,当肿瘤长至直径约l cm时,在无菌条件下剥取瘤组织并切成l mm3的小块,用套管针接种至新一批共40只裸鼠右前肢腋部皮下。
1.4 动物分组及处理
裸鼠接种后采用随机数字表法将实验动物随机分成5组,分别为模型组,NCTD高、中、低剂量组和氟尿嘧啶组,每组均为8只。造模5d后开始给药:模型组予生理盐水0.5mL/只腹腔注射;NCTD实验组予 NCTD 8mg/kg(高剂量组)、5mg/kg(中剂量组)、2mg/kg(低剂量组)腹腔注射;氟尿嘧啶对照组予氟尿嘧啶20mg/kg腹腔注射,均每周2次,连续给药3周。给药结束后颈椎脱臼法处死荷瘤裸鼠,剥取瘤组织,称取瘤体质量,浸入甲醛固定,石蜡包埋。按以下公式计算抑瘤率(%):抑瘤率(%)=(模型组平均瘤质量-药物组平均瘤质量)/模型组平均瘤质量×100%。
1.5 微血管染色与判断
免疫组化两步法标记CD34,方法如下:将各组已包埋好的肿瘤组织切片,常规脱蜡,柠檬酸高温修复抗原,加3%过氧化氢消除内源性过氧化物酶,磷酸盐缓冲液(phosphate buffer saline,PBS)洗,滴加CD34兔抗多克隆抗体(1∶200稀释),4℃过夜,PBS洗,加二抗37℃孵育0.5h,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,脱水封片。镜下可见CD34被染成黄褐色,标记出内皮细胞所在的位置,由内皮细胞形成管腔,且管腔小于8个红细胞面积,无较厚平滑肌包绕者即为微血管。每张片取5个热点区域并计数微血管,取5个视野的均值作为为微血管密度(microvessel density,MVD)。
1.6 VEGF、VE-Cd、MMP-2免疫组化染色与检测
VEGF、VE-Cd、MMP-2染色采用SABC三步法操作。同1.5项二抗孵育完成后,PBS洗3次,每次5min,擦干组织周围的PBS后加上SABC(1∶100稀释),置于37℃温箱中0.5h,PBS洗后行DAB显色,苏木精复染,脱水封片。阳性表达位于细胞质中,呈淡黄色、棕黄色或棕褐色,采用IMS细胞图像分析系统测定图像中的阳性染色面积和吸光度(A)值,计算免疫组化指数:(阳性面积×A值)/10 000,每张切片随机选取3个大小相等的视野,结果以3个视野的平均值表示。
1.7 统计分析方法
采用SPSS 15.0统计软件对实验数据进行统计分析。实验数据以均数±标准差表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 荷瘤裸鼠生长状态观察
整个实验过程中,氟尿嘧啶组小鼠出现消瘦、精神不振、动作迟缓、食量减少、便秘、皮肤光泽变差,皮温降低等情况。模型组1只裸鼠因灌胃操作不慎死亡,余基本未见不良反应;NCTD各剂量组基本未见不良反应。
2.2 NCTD对荷瘤裸鼠体重、瘤重、抑瘤率的影响
荷瘤裸鼠处死前带瘤称体重,各组裸鼠体重无明显差异,组间比较F=1.027,P=0.326。各组瘤重差异有统计学意义,组间比较F=10.519,P<0.01;两两比较结果可知,各用药组瘤重均小于模型组,差异均有统计学意义(P<0.05),以 NCTD(8 mg/kg)组和氟尿嘧啶组效果更为明显(P<0.01)。各组抑瘤率见表1。
2.3 NCTD对瘤体MVD的影响
各组瘤组织CD34免疫组化染色热点区域如图1所示。按前文微血管的判定方法从图中可见,NCTD各剂量组中微血管数量明显减少。统计分析结果显示,随着NCTD剂量增大,微血管数量逐渐减少。各药物组MVD与模型组相比,差异均有统计学意义(P<0.05或P<0.01)。
表1 各组荷瘤裸鼠体重、瘤重及抑瘤率(±s)Table 1 The body weight,tumor weight and tumor inhibition rate of each group(±s)
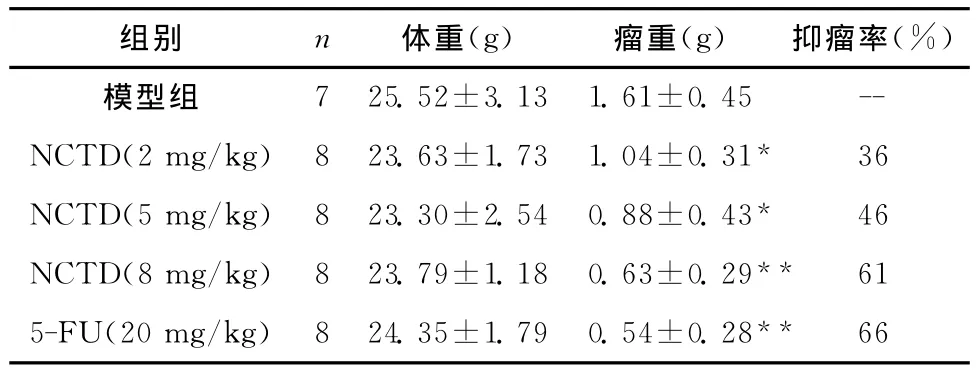
表1 各组荷瘤裸鼠体重、瘤重及抑瘤率(±s)Table 1 The body weight,tumor weight and tumor inhibition rate of each group(±s)
与模型组比较,*P<0.05**P<0.01
组别 n 体重(g) 瘤重(g) 抑瘤率(%)7 25.52±3.13 1.61±0.45 --NCTD(2mg/kg) 8 23.63±1.73 1.04±0.31* 36 NCTD(5mg/kg) 8 23.30±2.54 0.88±0.43* 46 NCTD(8mg/kg) 8 23.79±1.18 0.63±0.29** 61 5-FU(20mg/kg) 8 24.35±1.79 0.54±0.28**模型组66
2.4 NCTD对瘤体VEGF、VE-Cd、MMP-2表达的影响
图2所示分别为 VEGF、VE-Cd、MMP-2免疫组化染色图片,模型组中均见到大量表达,而NCTD各组中表达量明显减少,以NCTD 8mg/kg组表达最少。软件测算的免疫组化指数见表2。各指标组间比较差异均有统计学意义(均P<0.01),各药物组与模型组比较差异均有统计学意义(均P<0.05)。
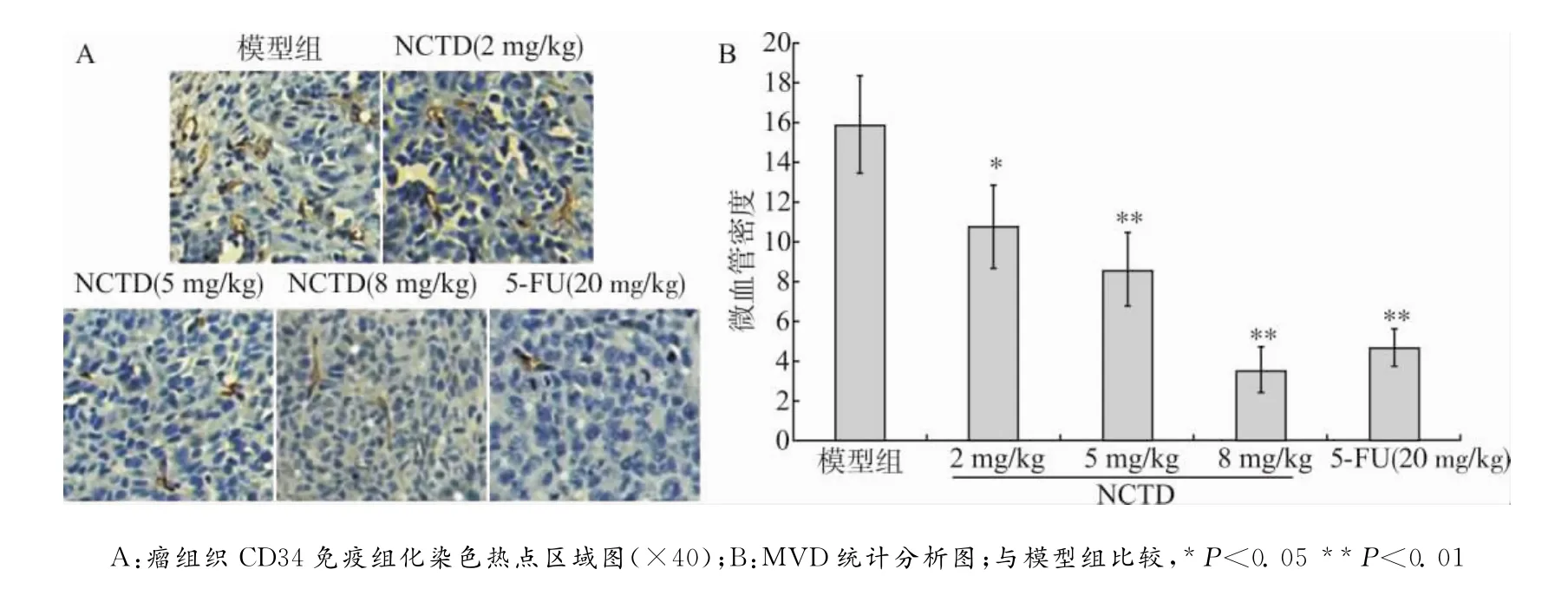
图1 NCTD对瘤体微血管密度的影响Fig.1 The effect of NCTD on the MVD of tumor tissues
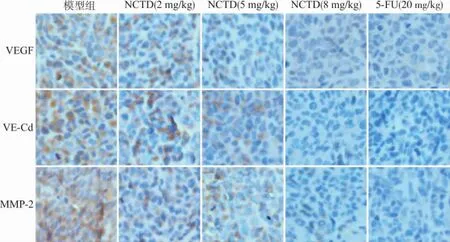
图2 瘤体 VEGF,VE-Cd,MMP-2免疫组化检测(DAB,×40)Fig.2 Immunohistochemical staining of VEGF,VE-Cd and MMP-2(DAB,×40)
表2 NCTD对瘤体VEGF、VE-Cd、MMP-2表达的影响(±s)Table 2 The effects of NCTD on the expression of VEGF,VE-Cd and MMP-2(±s)
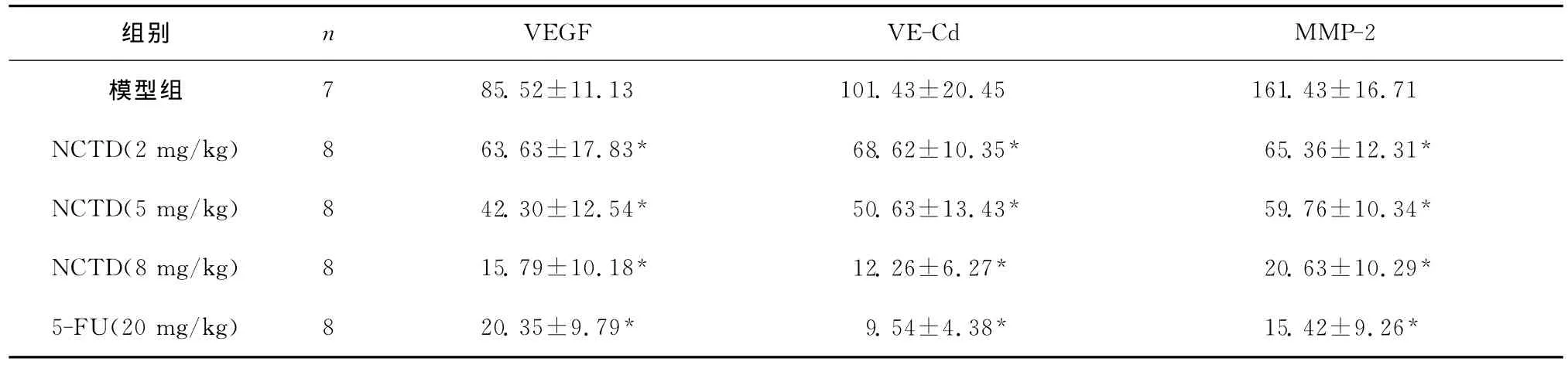
表2 NCTD对瘤体VEGF、VE-Cd、MMP-2表达的影响(±s)Table 2 The effects of NCTD on the expression of VEGF,VE-Cd and MMP-2(±s)
与模型组比较,*P<0.05
7 85.52±11.13 101.43±20.45 161.43±16.71 NCTD(2mg/kg) 8 63.63±17.83* 68.62±10.35* 65.36±12.31*NCTD(5mg/kg) 8 42.30±12.54* 50.63±13.43* 59.76±10.34*NCTD(8mg/kg) 8 15.79±10.18* 12.26±6.27* 20.63±10.29*5-FU(20mg/kg) 8 20.35±9.79* 9.54±4.38* 15.42±9.26 VEGF VE-Cd MMP-2模型组组别 n*
3 讨论
NCTD是从中药斑蝥体内提取活性成分经化学改造而成的新型抗肿瘤药物,其抗肿瘤靶点众多,作用机制复杂,能够通过抑制肿瘤细胞增殖、诱导凋亡、抑制侵袭转移和调节免疫等多条途径抑制肿瘤的生长。在对NCTD最初的研究中,多是从这些角度出发,在临床和实验中观察到它能够抑制肺[9]、肝[10-11]、胃[12]、乳腺[13]等多种肿瘤细胞的增殖。本实验利用人结肠癌裸鼠皮下移植瘤模型观察到相同的结果,即NCTD可以在不影响荷瘤裸鼠生长状态的前提下抑制结肠癌移植瘤的生长。由于肿瘤的生长和转移必须依赖血管生成[14],所以推测这种抑瘤效果并非单纯因为NCTD能够抑制瘤细胞的增殖或者诱导其凋亡,还可能与其抑制瘤体内血管生成有关。前期已有学者采用裸鼠移植瘤模型观察到NCTD可以抑制胆囊癌[1]、乳腺癌[15]的血管生成。本研究采用免疫组化方法标记CD34来间接反映各组结肠癌移植瘤内的MVD,发现NCTD各剂量组作用后瘤体内MVD明显减少,可见NCTD也可以抑制结肠癌移植瘤血管的生成,这些证据都有力支撑了从抗血管生成这个角度来研究NCTD的抗肿瘤机制。
研究证实[16],肿瘤血管生成是以内皮细胞为主要角色,多因子参与的复杂过程。已有实验发现NCTD对内皮细胞的增殖存在抑制[2],本课题组在前期体外实验中观察到NCTD能抑制内皮细胞的迁移、粘附、管状形成能力[5]。此外,NCTD还能影响血管相关生成因子如血管内皮生长因子、蛋白水解酶(主要是基质金属蛋白酶类,MMPs)、粘附分子的表达。VEGF是目前所发现的作用最强、特异性最高的促血管生成因子,它可以维持内皮细胞的活性,诱导内皮细胞增殖和迁移,募集骨髓源性造血祖或干细胞诱导血管形成[17]。VE-Cd是由内皮细胞特异性表达的一种跨膜粘附分子,胞外部分彼此连接,胞内部分和细胞骨架蛋白连接,控制着内皮细胞之间连接的稳定性,并负责向细胞内传导信号和促进血管的成熟,下调VE-Cd的表达将延缓血管样通道的形成[18]。MMP-2是明胶酶的一种,和肿瘤血管生成关系密切,其促进肿瘤血管生成的作用主要体现在两方面:一是降解局部ECM,为内皮细胞生长腾出空间;二是活化VEGF和另外一种血管生成的关键分子碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[19-20]。本研究利用免疫组化方法检测了结肠癌移植瘤内VEGF、VE-Cd、MMP-2等3种促血管生成因子的表达水平,结果显示NCTD可以降低3种蛋白的表达,作用随剂量增大而增强。
综合以上结果和分析可知,NCTD不仅对抗了内皮细胞相关血管生成的行为,同时抑制促血管生成因子的表达,从内皮细胞途径起到抑制结肠癌血管生成的作用。那么,可以认为NCTD抑制结肠癌生长的机制不仅是抑制结肠癌细胞的增殖,而且与抗血管生成也有关系,并且其抗血管生成的作用主要通过内皮细胞途径来实现的。这在一定程度上充实了NCTD抗肿瘤的作用机制,为拓展NCTD临床用途开辟了新思路。至于NCTD抗肿瘤是否还涉及其他途径或者靶点,则有待于更深入的研究。
[1] 范跃祖,陈春球,赵泽明,等 .去甲斑蝥素对胆囊癌肿瘤血管生成的作用及机制研究[J].中华医学杂志,2006,86(10):693-699.
[2] 莫日根,牛建昭,王继峰,等 .去甲斑蝥素对人脐静脉内皮细胞株的细胞毒作用[J].北京中医药大学学报,2001,24(6):25-28.
[3] 翟笑枫,吕祥,顾伟,等 .三种抗肿瘤中药有效成分对人脐静脉内皮细胞生长的影响[J].中国药物与临床,2011,11(7):752-754.
[4] 王景毅,梁金龙,刘国津 .去甲斑蝥素对乳腺癌细胞血管内皮生长因子表达的影响[J].中华中医药学刊,2009,27(11):2369-2371.
[5] 余涛,刘曼曼,李丹,等 .去甲斑蝥素对人脐静脉内皮细胞迁移、黏附、管腔形成能力及血管内皮生长因子受体、内皮细胞钙黏着蛋白表达的影响[J].中国癌症杂志,2012,22(3):232-235.
[6] Shibuya M.Vascular endothelial growth factor(VEGF)and its receptor(VEGFR)signaling in angiogenesis:a crucial target for anti-and pro-angiogenic therapies[J].Genes Cancer,2011,2(12):1097-1105.
[7] Li H,Shi X,Liu J,et al.The soluble fragment of VE-cadherin inhibits angiogenesis by reducing endothelial cell proliferation and tube capillary formation[J].Cancer Gene Ther,2010,17(10):700-707.
[8] 蔡华,孔昭如,陈红梅 .胃癌基质金属蛋白酶-2与血管生成的关系[J].癌症,2002,21(1):25-28.
[9] 赵良中,李强,冯宪敏,等 .去甲斑蝥素抑制肺癌细胞增殖的体外研究[J].中国畜牧兽医,2010,37(6):155-157.
[10] 张金梅,吴杰,常城,等 .去甲斑蝥素对肝癌细胞增殖和凋亡的影响[J].中国肿瘤生物治疗杂志,2011,18(1):33-37.
[11] 董秀,韩兆峰,王晓波 .去甲斑蝥素对人肝癌HepG2细胞凋亡的影响[J].中国民族民间医药杂志,2011,20(12):47.
[12] 成浩,范跃祖 .去甲斑蝥素对人胃癌SGC-7901细胞增殖的影响及其机制探讨[J].现代肿瘤医学,2008,16(4):527-530.
[13] 梁莉,贾廷珍,朱应葆,等 .去甲斑蝥素对乳腺癌细胞系MCF-7adr生长与凋亡的影响[J].临床肿瘤学杂志,2007,12(7):490-493.
[14] Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[15] 林晓燕,宋和平,胡赟宏 .去甲斑蝥素对人乳腺癌血管生成的抑制作用[J].中国癌症杂志,2007,17(11):847-850.
[16] Folberg R,Hendrix M J,Maniotis A J.Vasculogenic mimicry and tumor angiogenesis[J].Am J Pathol,2000,156(2):361-381.
[17] Hotz H G,Hines O J,Hotz B,et al.Evaluation of vascular endothelial growth factor blockade and matrix metalloproteinase inhibition as a combination therapy for experimental human pancreatic cancer[J].J Gastrointest Surg,2003,7(2):220-228.
[18] Hendrix M J,Seftor E A,Meltzer P S,et al.Expression and functional significance of VE-cadherin in aggressive human melanoma cells:role in vasculogenic mimicry[J].Proc Natl Acad Sci USA,2001,98(14):8018-8023.
[19] Iozzo R V,Zoeller J J,Nystrom A.Basement membrane proteoglycans:modulators Par Excellence of cancer growth and angiogenesis[J].Mol Cells,2009,27(5):503-513.
[20] Xu J,Rodriguez D,Petitclerc E,et al.Proteolytic exposure of a cryptic site within collagen typeⅣis required for angiogenesis and tumor growthinvivo[J].J Cell Biol,2001,154(5):1069-1079.
