益生菌微胶囊二次包衣工艺的优化
2013-05-15梁华忠龚雷淋刘达玉
邹 强,梁华忠,龚雷淋,刘达玉,王 卫,李 翔,*
(1.成都大学生物产业学院,食品加工和应用四川省高校重点实验室,四川成都610106;2.四川高福记生物科技有限公司,四川成都610106)
微胶囊技术作为益生菌的包埋手段之一,它常被用来提高益生菌在不良环境中的存活率以达到益生菌肠道释放的目的[1-4]。目前,海藻酸钠和蛋白质是益生菌包埋研究中常采用的两种壁材,但这两者均存在着各自的不足之处。海藻酸钠胶体对酸和胃蛋白酶稳定,并且进入到小肠消化环境后,又会逐渐转变成可溶解的粘性层[5],最终在结肠中被消化,因此利用海藻酸钠包埋益生菌有利于实现益生菌的肠道释放。但是海藻酸钠胶体多孔的凝胶网状结构使得它并不能完全有效地限制小分子有害物质的渗透,所以它对益生菌的保护效果也非常有限[6]。蛋白质虽然具有优良的乳化、凝胶和阻隔能力,但它不耐胃酸,并且在胃蛋白酶的作用下易水解,所以在人体胃部,蛋白质微胶囊对益生菌的保护效果也并不理想[6]。
有研究发现,利用海藻酸钠对明胶微胶囊进行二次包衣能够提高明胶对胃蛋白酶的稳定性,从而提高包埋益生菌在模拟胃液中的存活率,并实现肠道释放[7]。该方法弥补了海藻酸钠和蛋白质作为益生菌包埋壁材的各自缺点,为建立改良的益生菌包埋体系提供了一定的理论基础。但是海藻酸钠和蛋白质之间涉及到复杂的相互作用,外界环境条件对这种作用影响很大,目前并没有研究系统地考察二次包衣条件对益生菌包埋效果的影响。因此本研究以乳清蛋白微胶囊为研究对象,采用海藻酸钠对其进行二次包衣,考察不同包衣条件对微胶囊粒径和包埋益生菌在模拟胃液中存活率的影响,由此来确定海藻酸钠包衣蛋白质微胶囊的最佳参数和条件。
1 材料与方法
1.1 材料与仪器
两歧双歧杆菌F-35(B.bifidum F-35) 本实验室保藏;分离乳清蛋白(WPI,94.0%) 北京银河经贸有限公司;海藻酸钠 Sigma公司;转谷氨酰胺酶(Tgase,1000U/g) 江苏一鸣生物科技有限公司;胃蛋白酶(10000NFU·mg-1) BBI公司;吐温20(分析纯) 上海劲马实验设备有限公司。
ULTRA-TURRAX T8型均质机 德国IKA公司;Leica DM2000型光学显微镜 德国莱卡公司;BT-9300H型激光粒度分析仪 辽宁百特仪器有限公司。
1.2 实验方法
1.2.1 蛋白质微胶囊的制备 参照邹强等[8]的制备方法:将2mL浓缩菌液与30mL预热(40℃)的乳清蛋白溶液(10%,w/v)混合后,快速加入Tgase(10U/g蛋白质)并漩涡振荡使其分散均匀,将此混合液加入到盛有150g预热的(40℃)大豆油的250mL锥形瓶中,然后使该体系在磁力搅拌器的作用下(900r/min,40℃)反应180min,待液滴在酶的作用下转化为凝胶颗粒后离心(500×g,1min),收集微胶囊颗粒并用林格氏试剂溶液清洗两次,在700×g下离心5min,重新收集胶体颗粒,储藏于4℃备用。
1.2.2 海藻酸钠二次包衣实验 主要参照Annan等[7]的包衣方法,具体工艺流程如图1所示,并在此基础上对工艺进行优化,其中包衣过程需要考察的实验条件如表1所示。

表1 海藻酸钠包衣过程中的实验条件Table 1 Experimental condition of alginate coating on microcapsules
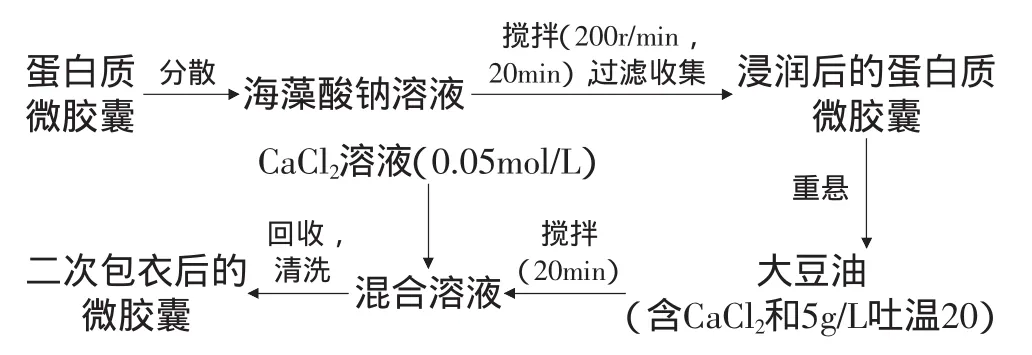
图1 海藻酸钠二次包衣的工艺流程Fig.1 The process flow of double-coating
1.2.3 微胶囊的形态观察及其粒径分析 取一小滴微胶囊分散液置于载玻片上,盖上盖玻片,在光学显微镜下观察其形态。微胶囊的粒径分布通过激光粒度分析仪测定,平均粒径表示为体积平均粒径D(4.3)。
1.2.4 B.bifidum F-35在模拟胃液中的存活实验人体模拟胃液(SGJ)的制备参照zou等[9]的方法,将0.5mL浓缩菌液或者0.5g微胶囊加入到4.5mL的SGJ中(37℃预热),用漩涡振荡器充分振荡10s,然后在37℃,100r/min下温育2h,之后用高速均质器对样品溶液进行破碎,用ULTRA-TURRAX T8均质机在10000r/min下均质45s,取样,用涂布平板法计算活菌数,其中存活率(SY)表示为:SY(%)=N/N0×100,N为经处理后,模拟胃肠液中存活的细胞总数,N0为在处理之前的细胞活菌总数。
1.2.5 二次包衣工艺的优化实验 将海藻酸钠溶液浓度、搅拌速度、CaCl2浓度分别固定为0.5%、500r/min和0.05mol/L,考察pH对包衣效果的影响;海藻酸钠溶液pH、搅拌速度、CaCl2浓度分别固定为5.5、500r/min和0.05mol/L,考察海藻酸钠溶液浓度对包衣效果的影响;海藻酸钠溶液浓度、pH、CaCl2浓度分别固定为0.5%、5.5以及0.05mol/L,考察搅拌速度对包衣效果的影响;海藻酸钠溶液浓度、海藻酸钠溶液pH、搅拌速度分别固定为0.5%,5.5以及500r/min,考察氯化钙浓度对包衣效果的影响。
1.2.6 数据统计分析 独立实验至少重复三次,结果应用SPSS15.0统计软件进行分析,实验数值以均数±标准差(±s)表示,采用One-way ANOVA法统计分析其显著性,p<0.05为显著水平。
2 结果与讨论
2.1 pH对包衣效果的影响
随着pH的降低,包衣后的微胶囊对B.bifidum F-35的保护效果越好。特别是pH在5.5时,包埋的B.bifidum F-35在模拟胃液中的存活率远高于pH为6.78和6.0时的存活率,这可能是因为较高pH的包衣环境会使得蛋白质和海藻酸钠之间的负静电斥力增加,从而影响海藻酸钠对乳清蛋白微胶囊的包衣效果,但是继续降低pH非但没有显著提高微胶囊对B.bifidum F-35保护效果,还可能因为偏酸性的包衣环境对包埋的B.bifidum F-35产生致死作用。另外,海藻酸钠溶液pH对微胶囊的粒径并没有显著影响(表2)。所以,海藻酸钠溶液pH选取为5.5。

表2 海藻酸钠溶液pH对B.bifidum F-35存活率(SGJ,2h)和微胶囊粒径的影响Table 2 The effect of pH of alginate solution on the survival of B.bifidum F-35 in SGJ for 2h and particle size of microcapsules
2.2 海藻酸钠溶液浓度对包衣效果的影响
随着海藻酸钠溶液浓度的提高,包埋的B.bifidum F-35的存活率随之上升,并在0.3%~0.5%之间上升的幅度最高,因为海藻酸钠溶液的粘度是随着浓度的提高而提高,而粘度的提高有利于海藻酸钠包覆于乳清蛋白微胶囊表面,从而抵御胃蛋白酶对乳清蛋白的降解作用并提高微胶囊对B.bifidum F-35保护效果,但浓度超过0.5%后,海藻酸钠包衣会导致微胶囊的平均粒径急剧增加,特别是浓度在0.7%和0.9%时,微胶囊的平均粒径(303μm和386μm)要远高于0.3%和0.5%时的平均粒径(表3)。考虑到微胶囊最终会添加到食品中,为了不影响食品的感官特性,需要尽量控制微胶囊的粒径,因此,海藻酸钠溶液浓度选取为0.5%。

表3 海藻酸钠溶液浓度对B.bifidum F-35存活率(SGJ,2h)和微胶囊粒径的影响Table 3 The effect of concentration of alginate solution on the survival of B.bifidum F-35 in SGJ for 2h and particle size of microcapsules
2.3 搅拌速度对包衣效果的影响
由表4可知,搅拌速度对B.bifidum F-35的存活率影响不大,2h后B.bifidum F-35的存活率均处于同一显著水平上;但它和微胶囊粒径却呈一定的相关性,微胶囊粒径随着搅拌速度的增加而降低,当搅拌速度超过500r/min时,微胶囊的粒径变化并不显著,说明此时的搅拌速度就足以使得乳清蛋白微胶囊完全分散于海藻酸钠溶液中,故搅拌速度选取为500r/min。

表4 搅拌速度对B.bifidum F-35存活率(SGJ,2h)和微胶囊粒径的影响Table 4 The effect of concentration of alginate solution on the survival of B.bifidum F-35 in SGJ for 2h and particle size of microcapsules
2.4 CaCl2浓度对包衣效果的影响
利用Ca2+可以和海藻酸钠形成凝胶从而达到包埋双歧杆菌的目的。当CaCl2浓度为0.01mol/L时,微胶囊对B.bifidum F-35的保护效果最差,这是因为分散在油相的CaCl2浓度越小,就越不利于Ca2+和海藻酸钠接触从而影响包衣效果,相反增加CaCl2浓度能够显著提高B.bifidum F-35在模拟胃液中的存活率,但当CaCl2浓度超过0.05mol/L后,提高的幅度并不明显。然而考虑到高浓度的CaCl2溶液具有较高的渗透压,而高渗透压对益生菌又有致死作用[10-11],并且CaCl2浓度对微胶囊的粒径并没有显著影响,因此CaCl2的浓度为0.05mol/L。

表5 CaCl2浓度对B.bifidum F-35存活率(SGJ,2h)和微胶囊粒径的影响Table 5 The effect of concentration of CaCl2on the survival of B.bifidum F-35 in SGJ for 2h and particle size of microcapsules
2.5 海藻酸钠包衣对乳清蛋白微胶囊形态的影响
经过海藻酸钠包衣的微胶囊表面有一层分布均匀的薄膜,而未经包衣的微胶囊表面并没有类似的结构出现,该包衣方法具有一定的可靠性。但是,包衣后微胶囊的呈球性却不如未经包衣的微胶囊(图2)。这可能是因为搅拌过程中的高剪切力使得微胶囊的球型结构被破坏。
2.6 海藻酸钠包衣对B.bifidum F-35存活率的影响

图2 微胶囊的光学显微镜观察结果(100×)Fig.2 Optical microscopy photographs showing the structure of microcapsules(100×)
通过上述结果得到了海藻酸钠包衣的最佳工艺为:海藻酸钠溶液pH5.5,海藻酸钠溶液浓度0.5%,搅拌速度500r/min,CaCl2浓度0.05mol/L。在此工艺条件下我们制备得到经海藻酸钠包衣的微胶囊,该微胶囊的粒径为133μm,包埋于其中的B.bifidum F-35在2h模拟胃液处理后的存活率为14.5%,存活量下降了不到一个对数值,而在未经包衣的蛋白质微胶囊中,B.bifidum F-35存活量下降了超过4个对数值,从而证实得到海藻酸钠的二次包衣能有效提高B.bifidum F-35在模拟胃液中的存活率。
3 结论
本研究优化得到了海藻酸钠对乳清蛋白微胶囊的最佳包衣工艺条件:海藻酸钠溶液pH为5.5,海藻酸钠溶液浓度为0.5%,搅拌速度为500r/min,CaCl2浓度为0.05mol/L。由该工艺制备而来的微胶囊平均粒径为133μm,此时B.bifidum F-35在2h模拟胃液中的存活率提高至14.5%。
[1]Kailasapathy K.Survival of free and encapsulated probiotic bacteria and their effect on the sensory properties of yoghurt[J].LWT-Food Science and Technology,2006,39(10):1221-1227.
[2]Muthukumarasamy P,Holley RA.Survival of Escherichia coli O157∶H7 in dry fermented sausages containing micro-encapsulated probiotic lactic acid bacteria[J].Food Microbiology,2007,24(1):82-88.
[3]Ding W,Shah N.Survival of Free and Microencapsulated Probiotic Bacteria in Orange and Apple Juices[J].International Food Research Journal,2008,15(2):219-232.
[4]Singh H.Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery[J].Trends in Food Science and Technology,2007,18(5):240-251.
[5]George M,Abraham T E.Polyionic hydrocolloids for the intestinal delivery of protein drugs:alginate and chitosan-a review[J].Journal of Controlled Release,2006,114(1):1-14.
[6]刘达玉,邹强,王卫.蛋白质微胶囊对益生菌包埋的最新研究进展[J].食品工业科技,2012,33(12):409-413.
[7]Annan N,Borza A,Moreau D,et al.Effect of process variables on particle size and viability of Bifidobacterium lactis Bb-12 in genipin-gelatin microspheres[J].Journal of Microencapsulation,2007,24(2):152-162.
[8]邹强,许卓,刘小鸣,等.乳清蛋白在转谷氨酰胺酶作用下包埋益生菌的研究[J].食品工业科技,2012,33(6):120-123.
[9]Zou Q,Zhao JX,Liu XM,et al.Microencapsulation of Bifidobacterium bifidum F-35 in reinforced alginate microspheres prepared by emulsification/internalgelation[J].International Journal of Food Science and Technology,2011,46:1672-1678.
[10]Reid AA,Vuillemard J,Britten M,et al.Microentrapment of probiotic bacteria in a Ca2+-induced whey protein gel and effects on their viability in a dynamic gastro-intestinal model[J].Journal of Microencapsulation,2005,22(6):603-619.
[11]Zou Q,Liu XM,Zhao JX,et al.Microencapsulation of Bifidobacterium bifidum F-35 in whey protein-based microcapsules by transglutaminase-induced gelation[J].Journal of Food Science,2012,77(5):270-277.
