油松花粉蛋白提取工艺的优化
2013-05-15范三红王相帅王亚云胡雅喃刘晓华
范三红,王相帅,王亚云,胡雅喃,刘晓华
(山西大学生命科学学院,山西太原030006)
松花粉,为鲜黄色或淡黄色细粉,其性味甘平无毒,显微镜下呈椭圆形或类球形,轮廓线明显,表面有类圆形或多角形纹理或小颗粒状突起,两侧各有一膨大的半圆形或近圆形气囊,气囊壁有明显大小不一的网状纹理,网眼呈多角形或类圆形[1]。松花粉药名松花、松黄,始载于唐《新修本草》,松花粉是我国特有的乡土树种——马尾松和油松的花粉[2]。花粉中富含蛋白质、氨基酸、碳水化合物、维生素、脂类等多种营养成分以及酶、辅酶、激素、黄酮、多肽、微量元素等生物活性物质,因此有“微型营养库”之美誉[3]。人服用后能在很短的时间内被人体快速吸收,促进人体正常新陈代谢,提高肌体免疫能力,对人类有很好的保健价值[4]。松花粉有这延缓衰老、抗疲劳、增强免疫力、降血脂等多种特殊功能,是一种天然的具有保健功能性的食品材料[5-7]。
油松花粉中含有的蛋白质,对人体的健康保健起着很大的作用。从油松花粉中分离出的蛋白质,可以用来研究其蛋白质的功能性质,用以研究出新的蛋白功能性食品。不仅如此,根据测定蛋白质的含量和对蛋白质的最佳提取工艺研究,可以研究出油松花粉在储藏过程中蛋白质含量和功能性质的变化情况,为油松花粉的储藏提供一些依据。
本实验利用碱提酸沉法,分离提取油松花粉的蛋白,成本较低,省时高效,而且对实验仪器的要求不是很高,是一种很普遍的提取蛋白的方法,可以为后续大量的提取油松花粉中的蛋白提供参考,并为进行深入研究蛋白质的功能性质提供帮助。
1 材料与方法
1.1 材料与仪器
油松花粉 山西省安泽县惠原科贸有限责任公司;盐酸、氢氧化钠、硼酸、硫酸铜、硫酸钾、浓硫酸 均为分析纯。
HRHS24型电热恒温水浴锅 青岛海尔医用低温科技有限公司;TG16A-WS型高速离心机 武汉爱斯佩科学仪器有限公司;101-2AB型电热鼓风干燥箱 天津市泰斯特仪器有限公司;JP-040ST型超声波清洗机 深圳市洁盟清洗设备有限公司;868型酸度计 美国奥利龙公司;JA1203N型电子天平 上海精密科学仪器有限公司;SP-2000UV型紫外可见分光光度计 上海光谱仪器有限公司;其他常用玻璃仪器。
1.2 实验方法
1.2.1 油松花粉基本组成成分的测定 水分含量:GB 5009.3—2010《食品中水分的测定》;灰分含量:GB 5009.4—2010《食品中灰分的测定》;粗蛋白含量:GB 5009.5—2010《食品中蛋白质的测定》;粗脂肪含量:GB/T 5009.6—2003《食品中脂肪的测定》;还原糖测定:GB/T 5009.7-2008《食品中还原糖的测定》。
1.2.2 油松花粉破壁方法 采用温差破壁和超声波破壁复合方法:将花粉置于-18℃冰箱内冷冻24h,迅速置于60℃的热水中搅拌30min,之后迅速冷却至室温25℃,之后放入超声波仪器中进行处理,超声频率40000Hz、超声波功率为240W、超声时间10min、超声温度为50℃,最后干燥后得破壁花粉[8-11]。
1.2.3 油松花粉蛋白等电点的测定 取4g花粉,以料液比1∶30加入120mL蒸馏水,放入超声波破壁(40000Hz,240W,50℃,10min),之后调节pH10.04后,放入45℃恒温水浴锅,浸提60min,以3000r/min离心10min,取出上清液,并均匀倒入5个小烧杯,调节pH分别为2、3、4、5、6,再次以3000r/min离心10min,取出上清液,测定吸光度值。选取出吸光度值最小的一个区间,再以0.2为梯度,测定出准确的等电点[12]。此时蛋白质沉淀量最大,上清液的吸光度值最小。
1.2.4 油松花粉蛋白提取流程(采用碱提酸沉法提取) 破壁后的油松花粉→加入蒸馏水并调节pH为10→恒温水浴锅浸提→3000r/min、10min离心分离→分离出上清液→调节pH至油松花粉的等电点(pI)→3000r/min、10min离心分离→分离出沉淀物→水洗中和、均质、干燥→得到蛋白[13]。
1.2.5 油松花粉蛋白质提取率的计算 油松花粉蛋白质的提取率(%)=提取出的蛋白质质量/油松花粉中蛋白质的含量×100。
1.2.6 单因素实验设计 采用控制变量法,分别研究料液比、提取液pH、提取时间、提取温度四个因素对油松花粉蛋白提取的影响[14]。
1.2.6.1 料液比单因素实验的设计 固定提取pH为10,温度为45℃,提取时间为60min,离心速度为3000r/min,离心10min,分别在料液比为1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)的条件下提取。
1.2.6.2 提取时间单因素实验的设计 固定料液比为1∶30(g/mL),温度为45℃,提取时间为60min,离心速度为3000r/min,离心10min,分别在提取pH为8、9、10、11、12的条件下提取。
1.2.6.3 提取pH单因素实验的设计 固定提取pH为10,温度为45℃,料液比为1∶30(g/mL),离心速度为3000r/min,离心10min,分别在提取时间为20、40、60、80、100min的条件下提取。
1.2.6.4 提取温度单因素实验的设计 固定提取pH为10,提取时间为60min,料液比为1∶30(g/mL),离心速度为3000r/min,离心10min,分别在提取温度为25、35、45、55、65℃的条件下提取。
1.2.7 正交实验设计 在单因素实验的基础上,进行正交实验,选用料液比、pH、提取时间、提取温度4个实验因素为自变量,以油松花粉蛋白质提取率为考察指标,设计四因素三水平正交实验[15],确定出最佳提取条件。分析因素与水平实验因素见表1。
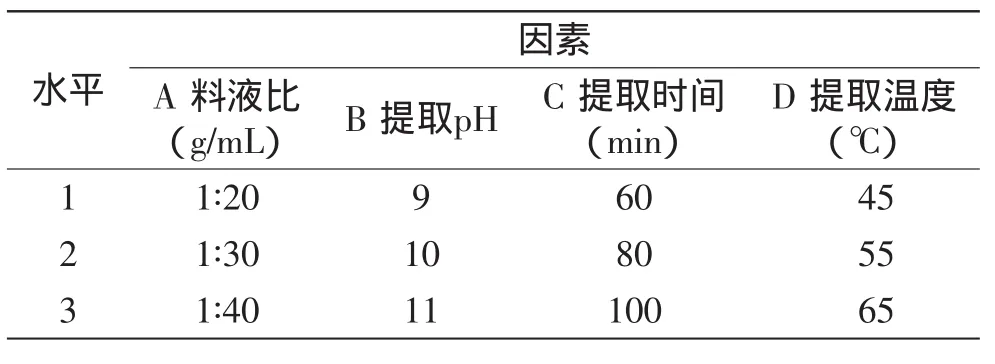
表1 因素水平表Table 1 Different levels of factors
1.2.8 数据处理 所有实验平行测定3次,采用Minitab软件和Excel对数据处理,其结果以平均值±标准偏差的形式表示。
2 结果与讨论
2.1 油松花粉基本组分测定结果

表2 油松花粉基本组分含量(%)Table 2 Basic chemical composition of pine pollen(%)
通过对油松花粉基本组分进行测定[16],测定结果由表2所示,该油松花粉的基本组分测定结果与参考文献[17-21]记载均有一定差异,原因可能在于油松花粉的产地不同,生产的季节不同,这一点从不同参考文献也可以说明。就该油松花粉的基本组分含量来看,还原糖和蛋白质的含量都相对较高,就为日后实验研究油松花粉蛋白的理化性质打下了良好的基础。其实验数据还可为日后油松花粉资源的选择性开发利用提供参考。
2.2 油松花粉蛋白等电点的测定结果
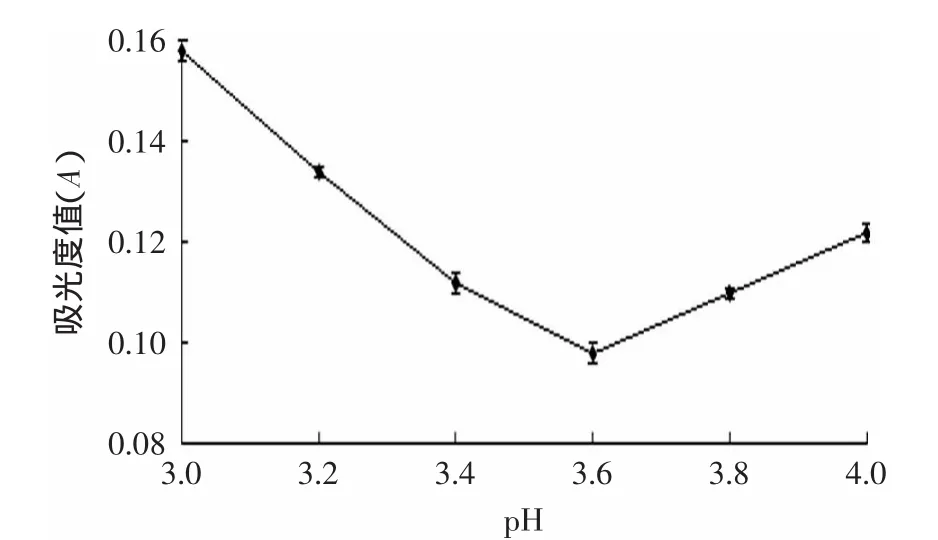
图1 油松花粉蛋白的等电点Fig.1 Isoelectric point of pine pollen
根据蛋白质在等电点时溶解度最低的原理可知,在碱性环境中提取,之后再样品中加酸,调节pH至等电点,蛋白质的沉淀量最大,上清液中蛋白质的含量是最低的,由此可以测得油松花粉蛋白的等电点(pI)。碱提酸沉法是很容易分离出样品蛋白的方法,所以,要想优化选择油松花粉蛋白的提取条件,首先要测定出油松花粉蛋白的等电点。
根据前期实验可以确定出油松花粉蛋白等电点的区间位于pH在3~4之间;进一步研究结果表明(图1),当pH在3.6时,上清液吸光度值最小,由此可以得到油松花粉蛋白的等电点(pI)为3.6。
2.3 单因素实验结果及分析
2.3.1 料液比对油松花粉蛋白提取率的影响 料液比对油松花粉蛋白提取率的影响结果见图2。由图2可知,随着料液比的增加,蛋白质提取率逐渐增加,在1∶30以后,蛋白质的提取率接近稳定,蛋白质提取率的增加速度明显减缓。当料液比较低时,油松花粉中的蛋白质不能充分的溶解,在进行酸沉阶段,去除的沉淀中会含有大量的蛋白造成提取率降低[22];同时当溶液量过大,成本上升,还会产生过多的废液,而且由图2可见,料液比在1∶30、1∶40和1∶50相差并不大,根据以上分析得出油松花粉蛋白提取的最佳料液比为1∶30(g/mL)。
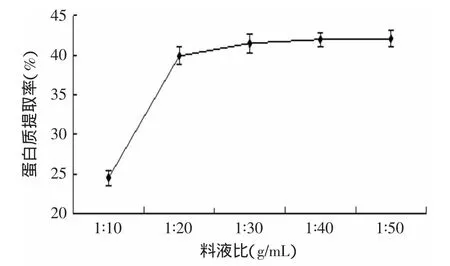
图2 料液比对蛋白提取率的影响Fig.2 Effect of material/liquid ratio on protein yield
2.3.2 提取pH对油松花粉蛋白提取率的影响 碱提pH对油松花粉蛋白提取率的影响结果见图3。由图3可知,随着提取pH的增加,蛋白质的提取率先增大后减小,并且在pH为10时,蛋白质的提取率最大,可能是蛋白质在碱性环境下溶解度会增大,但是随着pH得继续升高,碱性增强,会使得蛋白质变性,内部结构会改变,而且蛋白质会发生降解反应,这样使得蛋白质的溶解度反而降低。同时,pH过高,蛋白质会进行不正常的化学反应,蛋白质会脱羧、脱氨、肽键断裂产生有毒的物质,降低蛋白质的营养价值[23]。根据以上分析可以说明,油松花粉蛋白提取的最佳pH为10。
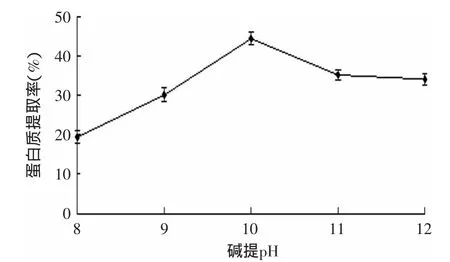
图3 pH对蛋白提取率的影响Fig.3 Effect of extraction pH on protein yield
2.3.3 提取时间对油松花粉蛋白提取率的影响 碱提时间对油松花粉蛋白提取率的影响结果见图4。由图4可知,随着提取时间的增加,蛋白质的提取率逐渐增大,在提取时间为100min时最大,这可能是因为:随着提取时间的延长,蛋白质的溶解率会增大,但是增加一定程度时,蛋白质溶解率达到最大,再延长提取时间,蛋白质的提取率不会有明显提高。提取时间为80、100min,两者相比较,考虑到节省时间的因素,据此可以说明,油松花粉蛋白提取的最佳提取时间为80min。
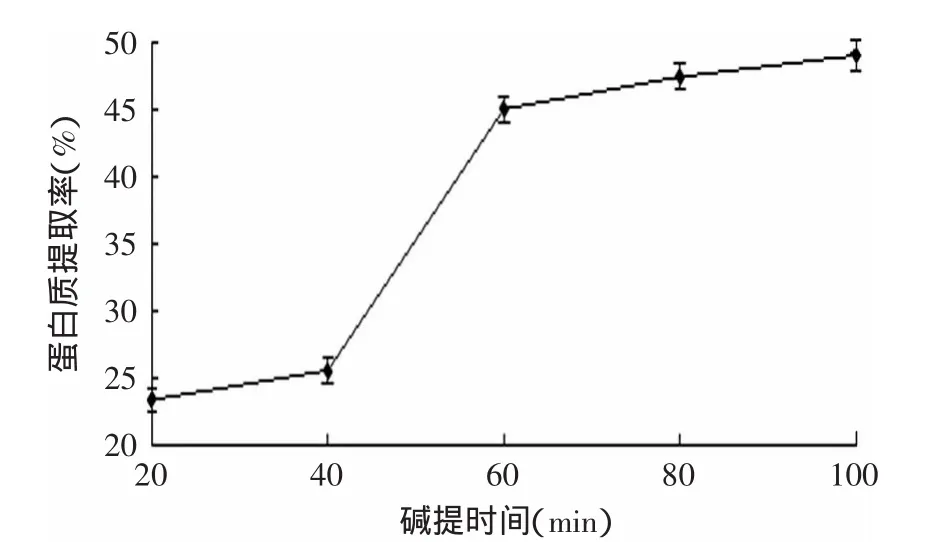
图4 碱提时间对蛋白提取率的影响Fig.4 Effect of extraction time on protein yield
2.3.4 提取温度对油松花粉蛋白提取率的影响 提取温度对油松花粉蛋白提取率的影响结果见图5。由图5可知,随着提取温度的升高,蛋白质的提取率逐渐增大,在提取温度为55℃的时候,提取率最高,可能的原因是随着温度的升高,会增加蛋白质的溶解度,而且高温使之前破壁不完全的花粉破壁,这样蛋白质的溶解度会明显升高。但是提取的温度不能太高,因为高温会使蛋白质变性,其内部结构发生改变[24]。综合以上因素,油松花粉蛋白提取的最佳提取温度为55℃。
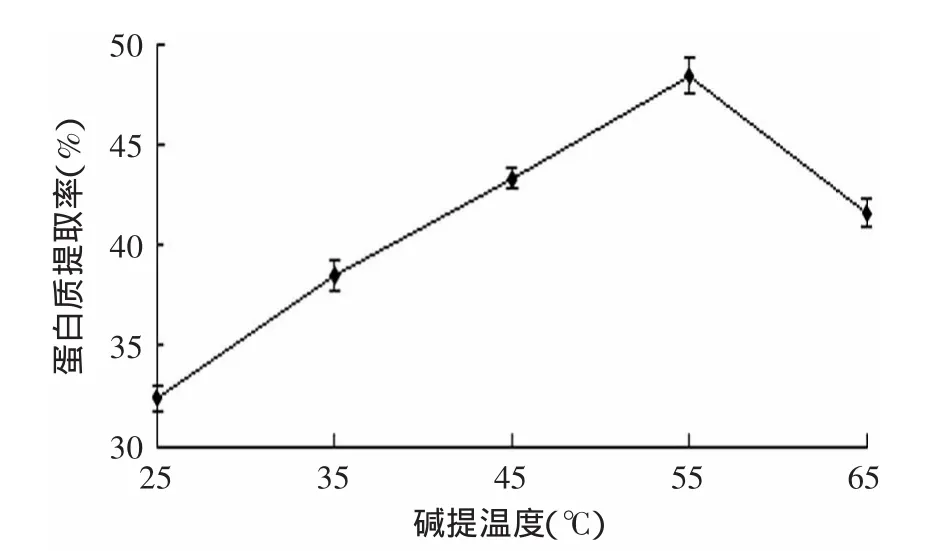
图5 碱提温度对蛋白提取率的影响Fig.5 Effect of extraction temperature on protein yield
2.4 正交实验结果及分析
根据单因素实验结果,对料液比、提取pH、提取时间、提取温度四因素进行采用L9(34)正交实验,以蛋白质的提取率为实验指标,确定油松花粉蛋白的最佳提取工艺。
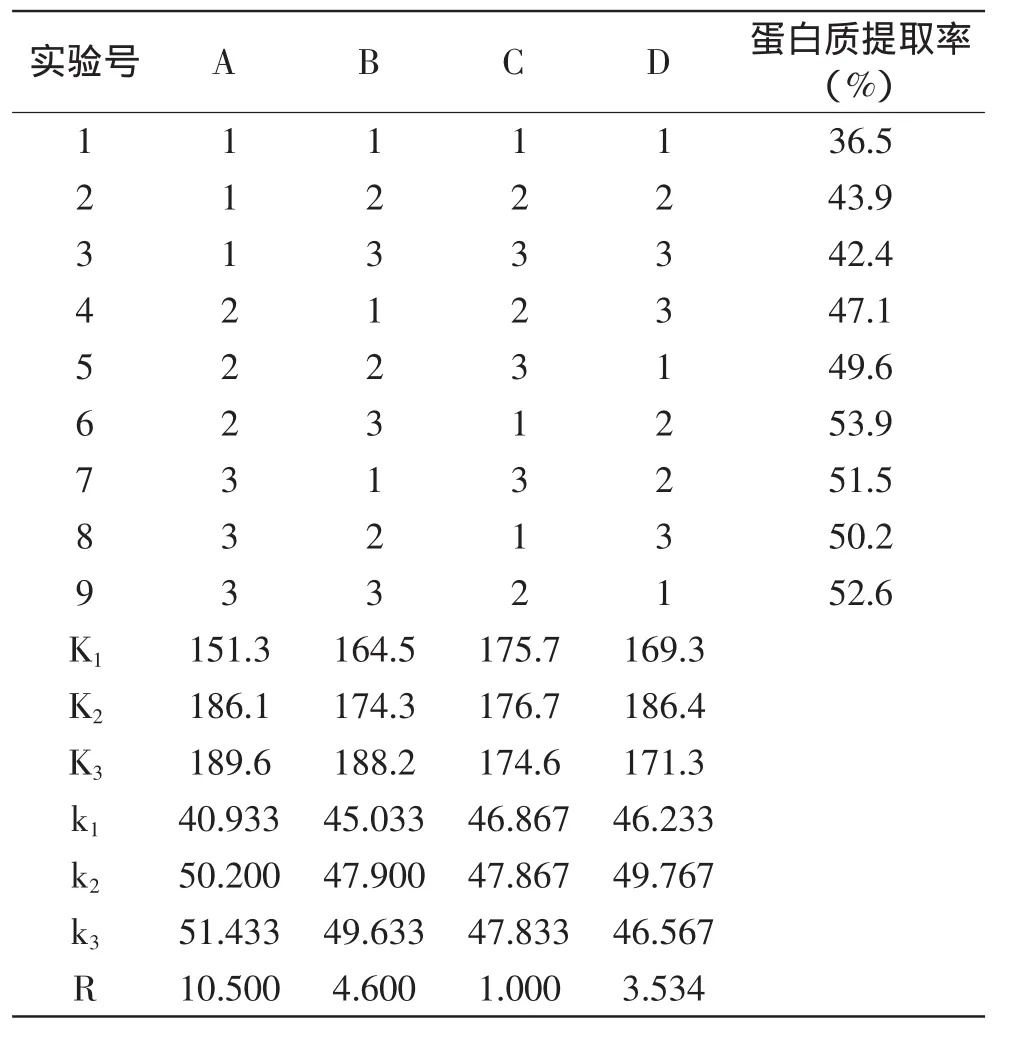
表3 正交实验结果Table 3 Results of orthogonal test
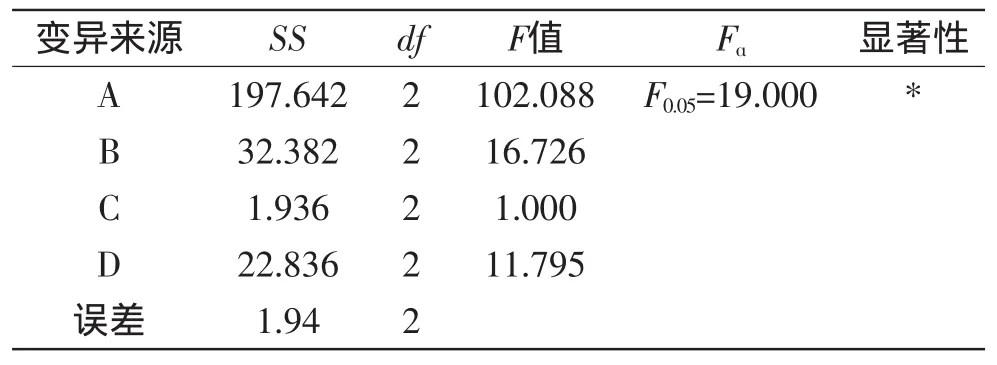
表4 方差分析表Table 4 Analysis of variance for the orthogonal array design
极差R反映各因素作用的大小,极差越大的因素对实验指标所造成的影响也越大。由表3可知,RA(10.500)>RB(4.600)>RD(3.534)>RC(1.000),四个因素对实验结果的影响次序为:A>B>D>C,即料液比对蛋白质提取率的影响最大,提取pH的影响次之,其次为提取温度,而提取时间对蛋白质的提取率影响最小。
由表3中的极差分析可知,本实验的最佳提取组合为A3B3C2D2,即料液比1∶40(g/mL)、提取pH为11、提取时间80min、提取温度55℃。
从表4的方差分析可知,料液比对油松花粉蛋白质的提取率的影响显著,而其他因素均不显著。
2.5 验证实验
因为正交实验确定出的最佳组合A3B3C2D2并不在正交表中,所以按此条件做3次实验进行验证。得到油松花粉蛋白的提取率为56.3%±0.3%,大于正交实验中的任意一组提取率,由此证明,此最佳提取工艺是可行的。
3 结论
油松花粉蛋白的等电点为3.6。影响油松花粉蛋白质提取率各因素的主次顺序是:料液比>pH>提取温度>提取时间,油松花粉蛋白质的最佳提取工艺条件为:料液比1∶40(g/mL)、pH为11、提取时间80min、提取温度55℃,此时提取率可达56.3%。
[1]盛明智,陈开文,卢红.松花粉的显微和理化鉴定研究[J].中华医学丛刊,2004(7):9-10.
[2]何晓燕,孙雪圆,于智洋.松花粉的有效成分及药理作用[J].东北林业大学学报,2007,35(9):78-80.
[3]李英华,胡福良,朱威,等.我国花粉化学成分的研究进展[J].养蜂科技,2005,8(4):7-16.
[4]白玉琢.油松花粉的开发利用概况及市场前景分析[J].中国科技成果,2010,11(17):53-55.
[5]谢姣,王华,任廷远,等.松花粉的功效及应用展望[J].食品与药品,2011,13(3):139-141.
[6]Niederberger V,Purohit A,Oster JP,et al.The allergen profile of ash(Fraxinus excelsior)pollen:cross-reactivity with allergens from various plant species[J].Clinical and Experimental Allergy,2002,2(6):933-941.
[7]Markovic-Housley Z,Degano M,Lamna D,et al.Crystal structure of a hypoallergenic isoform of the major birch pollen allergen Bet v1 and its likely biological function as a plant steroid carrier[J].Journal of Molecular Biology,2003,325(1):123-133.
[8]胡筱波,徐明刚,吴谋成,等.温差破壁法对油菜蜂花粉中主要营养素含量的影响[J].食品科学,2005,26(10):120-124.
[9]胡平,郑明珠,刘景圣.超声波破壁提取松花粉多糖的工艺研究[J].食品科学,2007,28(9):308-311.
[10]杨芙莲,党云刚.温差-超声波复合破壁法对花粉破壁率和黄酮得率的影响[J].陕西科技大学学报,2010,28(1):58-61.
[11]唐维,张星海.花粉破壁方法的研究进展[J].食品与发酵工业,2003,29(2):86-92.
[12]莫重文,马宇翔,杨国龙.蛋白质化学与工艺学[M].北京:化学工业出版社,2007.
[13]姜绍通,蒋连平.菜籽饼粕中分离蛋白的制备[J].食品科学,2007,28(12):161-164.
[14]胡筱波,朱新荣,周彩华,等.油菜花粉中活性蛋白的最佳提取工艺研究[J].食品科技,2006,11:98-101.
[15]王钦德,杨坚.高级食品实验设计与统计分析[M].北京:中国农业大学出版社,2009:55-110.
[16]黄笑钰,刘邻渭.食品化学综合实验[M].北京:中国农业大学出版社,2002.
[17]李英华,胡福良,朱威,等.我国花粉化学成分的研究进展[J].养蜂科技,2005,8(4):7-16.
[18]马养民,毛远.油松花粉成分分析[J].西北林学院学报,1993,8(4):98-100.
[19]Del Pilar de Sa-Otero,Maria,Armesto-Baztan,et al.Analysis of protein content in pollen loads produced in north-west Spain[J].Grana,2009,48(4):290-296.
[20]吴晓琴,刘杰尔,金成,等.不同种松花粉中营养素和非营养素的比较研究[J].食品工业科技,2011,32(1):273-276.
[21]Youcef Shahali,Ahmad Majd,Zahra Pourpak,et al.Mostafa moin comparative study of the pollen protein contents in two major varieties of Cupressus arizonica planted in tehran[J].Oroginal Article,2007,6(3):123-127.
[22]管斌,林洪,王广策.食品蛋白质化学[M].北京:化学工业出版社,2005:335-336.
[23]王镜岩,朱圣庚,徐长发.生物化学[M].第三版.北京:高等教育出版社,2002:123-317.
[24]阚建全.食品化学[M].第二版.北京:中国农业大学出版社,2008:44-102.
