微波辅助提取枇杷花中齐墩果酸和熊果酸的工艺优化
2013-05-15汪文浩郑美瑜陆胜民
汪文浩,郑美瑜,陆胜民,*
(1.南京农业大学食品科技学院,江苏南京210095;2.浙江省果蔬保鲜与加工技术研究重点实验室,浙江省农业科学院食品科学研究所,浙江杭州310021)
枇杷(Eriobotrya japonica)系蔷薇科枇杷属植物,是一种具有药用价值的小型亚热带常绿果树,在我国已经有2200多年的种植历史,目前产区主要分布在浙江、福建、安徽、四川等省区。枇杷花为枇杷的花蕾及花序,干燥后呈现绿白色、白色或淡黄色。据记载,枇杷花可以“止渴下气,利肺气,止吐逆,清上焦热,润五脏”[1],有清火、解热、润喉、利肺、化痰止咳、治头痛伤风等功能,临床上可用于急、慢性呼吸道疾病的治疗[2]。
目前从枇杷花中分离出的生物活性成分主要有黄酮类、多酚类、三萜酸类、苦杏仁苷等[3-4],其中三萜酸类具有较好的抗病毒、降血糖[5]、抗炎[6]等作用。枇杷花中的三萜酸类化合物主要是齐墩果酸(Oleanolic Acid,OA)和熊果酸(Ursolic Acid,UA)及其以它们为母体的衍生物[7]。目前,OA、UA的提取方法有热回流提取法、微波辅助提取法、超临界流体萃取法等,其中微波辅助提取比传统的热回流提取的时间短,得率高[8],适用于天然活性成分的提取[9]。本研究首次利用微波辅助提取技术对枇杷花中OA、UA进行提取,以OA、UA综合提取量为指标,运用正交实验方法进行工艺的筛选及优化,为枇杷花的综合利用及新产品的开发奠定基础。
1 材料与方法
1.1 材料与仪器
枇杷花 由杭州市余杭区塘栖枇杷花研究所提供,新鲜枇杷花经清洗后于80℃干燥5h,粉碎后备用;OA、UA标准品 中国药品生物制品鉴定所;甲醇(色谱纯) 百灵威科技有限公司;所用其他试剂 均为分析纯。
P1201型高效液相色谱仪(D230+二极管阵列检测器、P230型高压恒流泵、AS120型自动进样器、AXW-5柱温箱) 大连依利特分析仪器有限公司;WF-4000型微波快速反应系统 上海屹尧微波化学技术有限公司;LXJ-HB型飞鸽离心机 上海安亭科学仪器厂;KQ-500DB型数控超声波清洗器 昆山市超声仪器有限公司;DHG-9070A型电热鼓风干燥箱 上海精宏仪器设备有限公司;AL104-1C型电子天平METTLER TOLEDO公司;SHB-A型循环水真空泵、RE52-99型旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 分析检测方法
1.2.1.1 色谱条件 色谱柱:Waters C18(4.6mm×250mm,5μm);流动相:甲醇-0.1%冰醋酸水溶液(94∶6),流速0.5mL·min-1;检测波长:210nm;柱温:25℃;进样量:10μL。
1.2.1.2 标准曲线的绘制 分别精密称取OA 22.9mg、UA 30.0mg于25mL容量瓶中,用甲醇溶解并定容至刻度,配制成916mg/L OA、1200mg/L UA的混合溶液。分别精密量取标准溶液0.25、0.5、1、2、3、4mL于10mL容量瓶中,甲醇定容。精密吸取上述不同浓度的混合标准溶液10μL,在上述色谱条件下进行测定。以样品浓度(mg/mL)为纵坐标、峰面积为横坐标绘制标准曲线。
1.2.1.3 样品中OA、UA的检测 精密称取干燥并粉碎的枇杷花样品0.5g于微波萃取瓶中,加入乙醇溶液进行微波辅助提取,提取结束后于5000r/min离心15min,取上清液减压浓缩至干燥,残留物用甲醇溶解,进样前过0.45μm滤膜,在上述色谱条件下进行检测,进样量10μL。
1.2.2 单因素实验
1.2.2.1 乙醇体积分数选择 在提取温度为70℃、液固比为40∶1(mL/g)、微波功率为200W条件下,选取体积分数分别为35%、50%、65%、80%、95%的乙醇溶液提取50min,考察不同乙醇体积分数对枇杷花OA、UA提取量的影响。
1.2.2.2 提取时间选择 在乙醇体积分数为80%,提取温度为70℃,液固比为40∶1(mL/g),微波功率为200W条件下,分别提取10、20、30、40、50、60min,考察不同提取时间对枇杷花OA、UA提取量的影响。
1.2.2.3 提取液固比选择 在乙醇体积分数为80%,提取温度为70℃,微波功率为200W条件下,在液固比为20∶1、30∶1、40∶1、50∶1、60∶1、70∶1(mL/g)时提取50min,考察不同液固比对枇杷花OA、UA提取量的影响。
1.2.2.4 微波辅助提取功率选择 在乙醇体积分数为80%,提取温度为70℃,液固比为40∶1(mL/g)条件下,在微波功率为100、200、300、400、500W时提取50min,考察不同微波功率对枇杷花OA、UA提取量的影响。
1.2.2.5 提取温度选择 在乙醇体积分数为80%,微波功率为300W,液固比为40mL/g时,在提取温度为40、50、60、70、80℃条件下提取50min,考察不同提取温度对枇杷花OA、UA提取量的影响。
1.2.3 L9(34)正交实验根据单因素实验的结果,选取乙醇体积分数、液固比、提取时间、微波功率四个因素进行L9(34)正交实验,提取温度为50℃,确定最佳提取工艺,正交实验因素水平如表1所示。根据实验结果,发现枇杷花中OA、UA的含量比值大约为1∶5(见图1),采用权重法衡量工艺参数[10]。综合指标=(OA含量平均值/OA含量最大值)×0.17×100+(UA含量平均值/UA含量最大值)×0.83×100。综合指标值越大,表明对枇杷花中OA和UA的总的提取量越大。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiments
1.2.4 枇杷花中OA、UA提取方法的比较
1.2.4.1 微波辅助提取枇杷花中OA、UA 精确称取枇杷花样品0.5g,加入20mL 80%乙醇,于50℃提取50min,微波功率为300W。
1.2.4.2 热回流提取枇杷花中OA、UA 考虑到提取液体积太少,热回流提取无法实现虹吸,本实验选用的提取液体积为100mL。精确称取枇杷花样品2.5g,加入100mL 80%乙醇,于50℃条件下回流提取50min。
1.2.4.3 超声波辅助提取枇杷花中OA、UA 精确称取枇杷花样品0.5g,加入20mL 80%乙醇,于50℃提取50min,超声功率为300W。
1.3 数据处理
实验数据采用SPSS软件进行统计分析,采用Origin软件进行作图。正交实验、提取方法比较实验每个实验点重复三次,结果以平均数±标准偏差(SD)表示。
2 结果与分析
2.1 OA、UA线性关系及色谱图分析
OA标准曲线回归方程为Y=0.2714X+0.5633,R2=0.9994,UA标准曲线回归方程为Y=0.2395X+1.3949,R2=0.9990。样品平行5次,进行精密度检验,OA的相对标准偏差(RSD)为1.45%,UA的RSD为1.17%,表明仪器精密度良好。标准品与样品的HPLC色谱图如图1所示。在上述色谱条件下,色谱图中标准品与样品OA、UA在出峰时间附近无干扰峰出现,且分离度大于1.5。
2.2 单因素实验结果
2.2.1 乙醇体积分数对枇杷花OA、UA提取量的影响 由图2可以看出,在乙醇体积分数低于80%时,OA、UA的提取量随乙醇体积分数的增大而增加,这是因为OA、UA为弱极性分子,乙醇体积分数的增大有利于OA、UA的溶出。当乙醇体积分数达到95%时,OA、UA的提取量反而下降,可能是因为高浓度的乙醇使蛋白质变性加快,在一定程度上抑制了乙醇向细胞内的渗透[11],妨碍了OA、UA的溶出,从而影响了OA、UA的提取量,因此正交实验选用乙醇体积分数条件为65%、80%和95%。
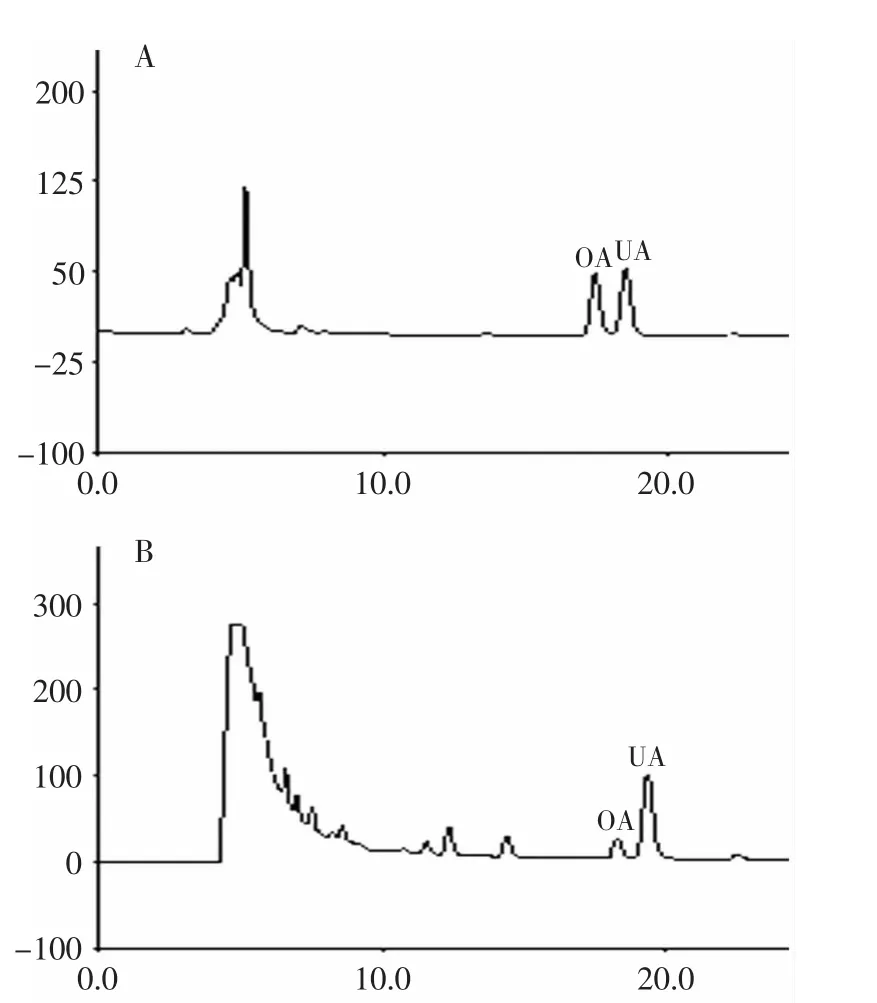
图1 标准品与样品HPLC色谱图Fig.1 HPLC chromatogram of standard and sample
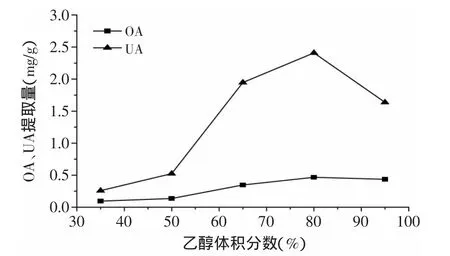
图2 乙醇体积分数对枇杷花OA、UA提取量的影响Fig.2 Effects of ethanol concentration on extraction yield of OA and UA in loquat flowers
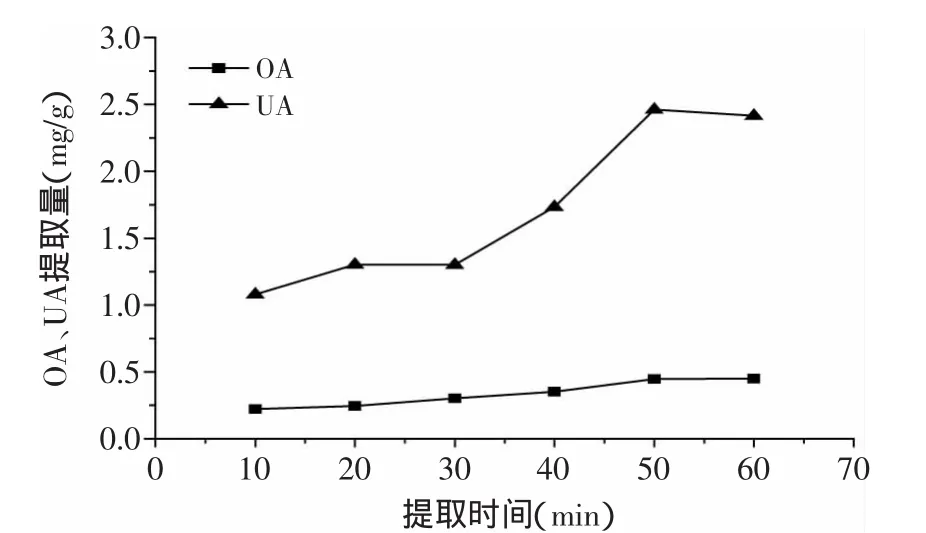
图3 提取时间对枇杷花OA、UA提取量的影响Fig.3 Effects of extraction time on extraction yield of OA and UA in loquat flowers
2.2.2 提取时间对枇杷花OA、UA提取量的影响 由图3可以看出,随着提取时间的延长,OA、UA的提取量逐渐增加,在50min时,提取量达到最大,枇杷花中OA、UA基本上全部溶出。在60min时,提取量已接近饱和并有轻微的下降,可能是因为提取时间过长会对OA、UA的结构造成破坏,引起提取量的下降,因此正交实验选用的提取时间条件为40、50、60min。
2.2.3 液固比对枇杷花OA、UA提取量的影响 由图4可以看出,在液固比较小时,OA、UA提取量随液固比的增加而升高。在液固比达到40∶1(mL/g)时,OA、UA的提取量达到最大值,液固比继续增加,提取量反而下降,可能是因为提取溶剂用量过多时,会增加细胞内其他杂质的溶出[12],而且会使浓缩时间过长,增加能耗,降低回收率,因此正交实验选用的液固比条件为30∶1、40∶1、50∶1(mL/g)。
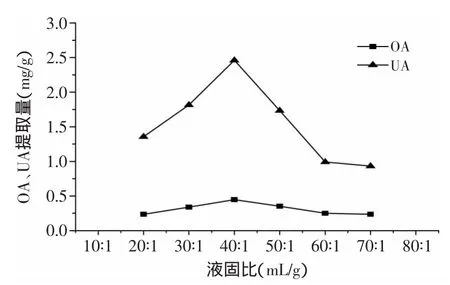
图4 液固比对枇杷花OA、UA提取量的影响Fig.4 Effects of liquid/solid ratio on extraction yield of OA and UA in loquat flowers
2.2.4 微波功率对枇杷花OA、UA提取量的影响 如图5所示,随着微波功率增加,提取液的升温速度加快,增加了料液扩散的速度,提高了提取量。但是当功率达大于300W时,提取量接近平衡并缓慢下降,可能是升温速度过快,造成了提取液的爆沸,造成了提取液的损失[13],而且功率增加会增加能耗,因此正交实验选用的微波功率条件为100、200、300W。
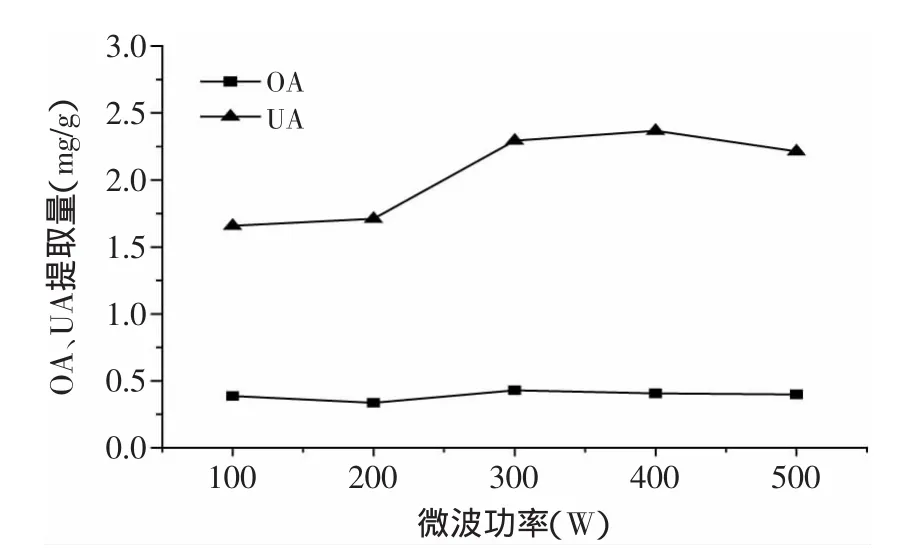
图5 微波功率对枇杷花OA、UA提取量的影响Fig.5 Effects of microwave power on extraction yield of OA and UA in loquat flowers
2.2.5 提取温度对OA、UA提取量的影响 由图6可以看出,在温度较低条件下,提取量随温度的升高而增加,当温度超过50℃后提取量反而下降,可能是因为温度过高会加速乙醇的挥发,降低提取液中乙醇的体积分数,从而降低了提取量,因此提取温度选择50℃。
2.3 正交实验结果
按照表1进行L9(34)正交实验,实验结果见表2,对综合指标进行方差分析结果如表3所示。
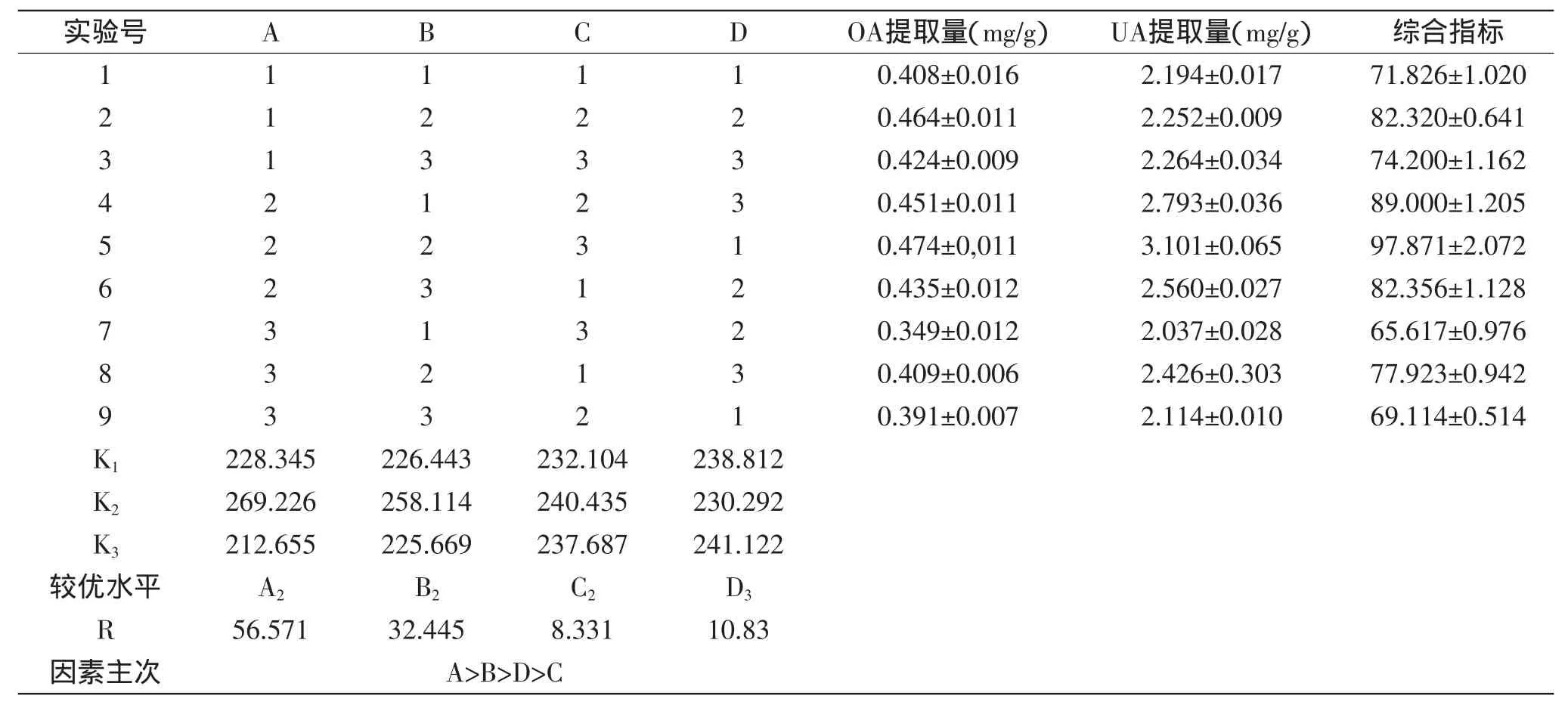
表2 L9(34)正交实验结果Table 2Result of orthogonal experiments L9(34)
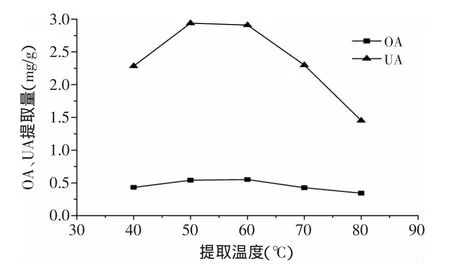
图6 提取温度对枇杷花OA、UA提取量的影响Fig.6 Effects of extraction temperature on extraction yield of OA and UA loquat flowers
由表2可以看出,影响枇杷花中OA、UA提取量的因素的主次顺序为:乙醇浓度(A)>液固比(B)>微波功率(D)>提取时间(C);枇杷花中OA、UA的提取的最佳工艺组合为A2B2C2D3,即乙醇浓度80%,液固比40∶1(mL/g),提取时间50min,微波功率300W,提取温度50℃。由表3中方差分析可以看出,乙醇浓度、液固比对枇杷花中OA、UA提取量的影响呈现显著水平。
按照A2B2C2D3的条件进行三次重复验证实验,OA、UA提取量分别达到0.482、3.118mg/g,RSD分别为1.973%和1.830%,综合指标为98.631±1.498。验证实验结果表明,在此条件下提取的OA、UA含量的综合指标达到最大值,且具有良好的重复性,因此确定A2B2C2D3为最佳工艺条件,即乙醇体积分数80%,液固比40∶1mL/g,提取时间50min,微波功率300W。
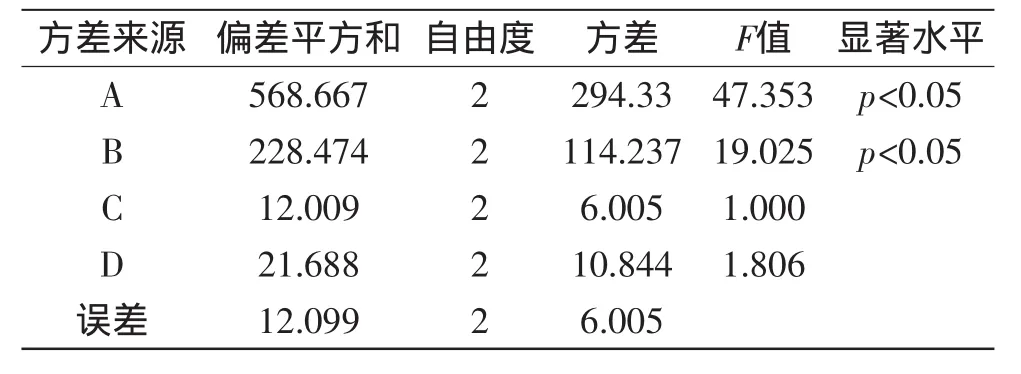
表3 正交实验方差分析Table 3 Variance analysis of orthogonal experiment
2.4 枇杷花中OA、UA提取方法的比较
枇杷花中OA、UA超声波辅助提取、热回流提取的实验结果如表4所示,并与微波辅助提取的最佳工艺条件的提取量进行比较。从表4中可以看出,利用超声波辅助提取OA、UA的提取量大于热回流提取,但与微波辅助提取的综合指标相比,OA、UA提取量均低于微波辅助提取的结果。
3 结论
本研究探明了枇杷花中OA、UA的微波辅助提取工艺,以提取物中OA、UA综合含量作为指标,通过单因素与正交实验得出,各因素对提取量的影响顺序为:乙醇浓度>液固比>微波功率>提取时间,其中乙醇浓度、液固比两个因素对提取量有显著影响(p<0.05),最佳提取工艺为:乙醇浓度80%,液固比40∶1mL/g,提取时间50min,微波功率300W,提取温度50℃。通过验证实验,表明在该实验条件下,OA提取量达到0.482mg/g,UA提取量达到3.118mg/g,且重复性良好。
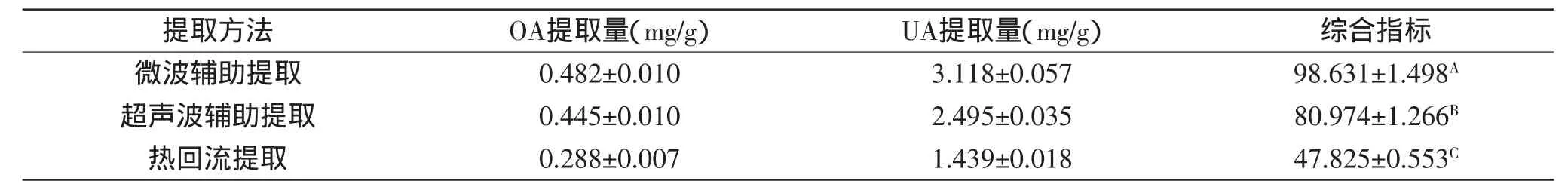
表4 微波辅助提取、超声波辅助提取、热回流提取实验结果Table 4 Results of microwave-assisted extraction,ultrasonic-wave assisted extraction and thermo-refluxing extraction experiments
本研究还对枇杷花中OA、UA的不同提取方法进行了比较,结果表明,在乙醇浓度80%,液固比40∶1(mL/g),提取时间50min,提取温度50℃,微波功率300W条件下,采用微波辅助提取枇杷花中OA、UA的提取量显著高于超声波辅助提取和热回流提取。
[1]李时珍.本草纲目[M].北京:宗教文化出版社,2003:332-333.
[2]国家中医药管理局《中华草本》编委会.中华草本[M].上海:上海科学技术出版社,1999:145-148.
[3]周春华.枇杷花、果主要生物活性组分与抗氧化活性研究[D].杭州:浙江大学,2007.
[4]闫永芳,过尘杰,孙钧,等.宁海白枇杷花中酚类物质鉴定及含量测定[J].中国食品学报,2012,12(4):202-207.
[5]Shoko T,Yoko I,Eri K,et al.Production of bioactive triterpenes by Eriobotrya japonica[J].Photochemistry,2002,59(3):315-323.
[6]王静波.枇杷花止咳抗炎药效学研究[D].成都:四川师范大学,2009.
[7]成丽,刘燕,陈凌娅,等.枇杷花三铁皂苷成分的研究[J].华西医大学报,2001,32(2):283-285.
[8]杨小舟,张继,杨晓龙,等.微波辅助提取黄参多糖的工艺研究[J].食品工业科技,2012,33(9):319-322.
[9]邱志敏,芮汉明.微波辅助提取枸杞多糖的工艺优化及其抗氧化性研究[J].食品工业科技,2012,33(7):220-224.
[10]邹建国,刘飞,刘燕燕,等.响应面法优化微波辅助提取枳壳中总黄酮工艺[J].食品科学,2012,33(2):24-28.
[11]赵静,段杨峰,孔繁渊,等.超声波辅助提取枇杷核苦杏仁苷工艺优化[J].食品科学,2011,32(8):37-42.
[12]王志兵,王力,姜海峰,等.返魂草总黄酮的微波提取及响应面优化[J].食品工业,2012(3):3-6.
[13]李秀信,王建华,刘莉丽,等.微波辅助提取香椿叶黄酮工艺的研究[J].中国食品学报,2012,12(1):46-51.
