花椰菜废弃茎叶中叶蛋白提取工艺的研究
2013-05-15汪建旭冯炜弘杨道兰王永林
汪建旭,冯炜弘,杨道兰,王永林,尹 燕,张 艳
(兰州市农业科技研究推广中心,甘肃兰州730010)
花椰菜(Brassica oleracea L.var.botrytis L)是十字花科芸薹属植物中以花球为产品的一种甘蓝类蔬菜,具有很高的营养价值。但在鲜销和初加工过程中茎叶剩余物占到了鲜重的70%以上[1]。根据测算,兰州市2012年产生的花椰菜茎叶剩余物达到了86万吨,这些茎叶剩余物含水率及有机质含量较高,堆放或填埋会产生大量渗滤液,造成严重的环境污染。
果蔬加工过程中废弃物的利用已经成为许多新的、可替代的廉价蛋白质来源[2-7]及功能性成分[8-10]的研究主题。花椰菜废弃茎叶中除含有大量水分外,还含有高质量的蛋白质和纤维素[1]。叶蛋白是以植物青嫩茎叶为原料,经榨汁、絮凝、浓缩、干燥等工艺提取出的一种富含可溶性蛋白质的浓缩物,简称为LPC。由于其产量高、营养丰富、提取和浓缩方法相对简单,已经作为一种有效和可行的蛋白质来源[11]。目前国内外还没有对花椰菜废弃茎叶中叶蛋白提取工艺进行过研究,因此本实验对花椰菜废弃茎叶叶蛋白的不同絮凝条件及提取工艺进行了研究,以期为花椰菜废弃物的综合开发利用提供技术参数和理论指导。
1 材料与方法
1.1 材料及仪器
花椰菜废弃茎叶 品种为玛润达,于2012年9月采自兰州市榆中县高原夏菜基地,为花球成熟期的新鲜、无腐烂茎叶,采样后贮藏于4℃的冷库中;壳聚糖(脱乙酰度≥90%) 国药集团化学试剂有限责任公司;其他化学试剂 均为分析纯。
101-3AB型恒温干燥箱 天津泰斯特仪器有限公司;HH-SY21-Ni4型恒温水浴锅 上海百典仪器设备有限公司;A-88型组织捣碎机 江苏金坛市盛威实验仪器厂;R30型电子搅拌器 北京华东仪器公司;TGL-16G型离心机 江苏金坛市科兴仪器厂;PHS-3F型酸度计 上海雷磁仪器厂;Kjeltec 1030型全自动凯式定氮仪,Soxtec Avanti 2050型全自动脂肪仪 德国福斯(FOSS)公司。
1.2 实验方法
1.2.1 原料化学成分的测定 取5g新鲜花椰菜茎叶,剪碎至2~5mm,按照国标规定的检测方法,进行化学成分测定[5-7]。
干物质测定:采用烘干法,在105℃下烘干至恒重后测定质量;粗蛋白测定:按照GB/T 6432-1994进行测定;粗灰分含量测定:按照GB/T 5009.4-2010进行测定;粗纤维含量测定:按照GB/T 5009.10(88)-2010进行测定;粗脂肪:按照GB/T 14772-2008法进行测定。
1.2.2 叶蛋白提取方法的筛选 挑选刚采收的新鲜无腐烂花椰菜废弃茎叶1000g,清洗后用组织捣碎机加水捣成浆状,向原浆中加入一定量蒸馏水并用四层纱布反复挤压过滤。叶渣再加入适量蒸馏水继续挤压过滤,调节料水比至1∶5(g/mL),合并滤液并分别测定打浆后新鲜原液和调节料水比之后原液的pH。滤液分别按以下方法进行处理:
a.直接加热法:控制水浴温度为75℃,保温10min;
b.酸沉淀法:对原液充分搅拌并用0.1mol/L HCl溶液调pH至4.0;
c.碱沉淀法:对原液充分搅拌并用0.1mol/L NaOH溶液调pH至10.0;
d.酸热沉淀法:对原液充分搅拌并用0.1mol/L HCl溶液调pH至4.0,继续加热至水浴温度为75℃,保温10min;
e.碱热沉淀法:对原液充分搅拌并用0.1mol/L NaOH溶液调pH至10.0,继续加热至水浴温度为75℃,保温10min;
f.酸絮凝剂法:对原液充分搅拌并用0.1mol/L HCl溶液调pH至4.0,加入絮凝剂壳聚糖(壳聚糖-盐酸溶液:将一定量的壳聚糖先溶于30~40mL,0.1mol/L盐酸中),至有絮状沉淀出现,静置40min。
将处理后溶液进行离心(4000r/min,10min),沉淀物在65℃条件下烘干至恒重,所得样品即为叶蛋白,并按照GB/T 6432-1994测定其中的粗蛋白含量。
1.2.3 叶蛋白提取条件的优化 根据1.2.2所得到的实验结果,酸絮凝剂法为提取花椰菜叶蛋白的最佳方法,通过单因素及正交实验进一步优化叶蛋白提取工艺参数。
1.2.3.1 单因素实验设计 以叶蛋白得率和提取率为指标,考察提取过程中料水比、壳聚糖添加量、pH对指标的影响。
按照1.2.2的酸絮凝剂工艺流程,配制料水比(g/mL)分别为1∶3、1∶4、1∶5、1∶6的原液,壳聚糖添加量为0.4g/L(占原液体积),调pH至4.0,提取叶蛋白,考察料水比对叶蛋白得率和提取率的影响;按照0.2、0.3、0.4、0.5g/L(占原液体积)的壳聚糖添加量,设定料水比为1∶5(g/mL),pH调至4,提取叶蛋白,考察壳聚糖添加量对叶蛋白得率和提取率的影响;设料水比为1∶5(g/mL),壳聚糖添加量为0.4g/L(占原液体积),分别调pH至3.0、3.5、4.0、4.5提取叶蛋白,考察pH对叶蛋白得率和提取率的影响。
1.2.3.2 正交实验 以叶蛋白得率和提取率为指标,在单因素实验的基础上,以料水比(A)、pH(B)、壳聚糖添加量(C)为实验因素,选用不同水平,进一步优化参数范围,进行L9(34)正交实验,并进行方差分析。各因素水平表见表1。
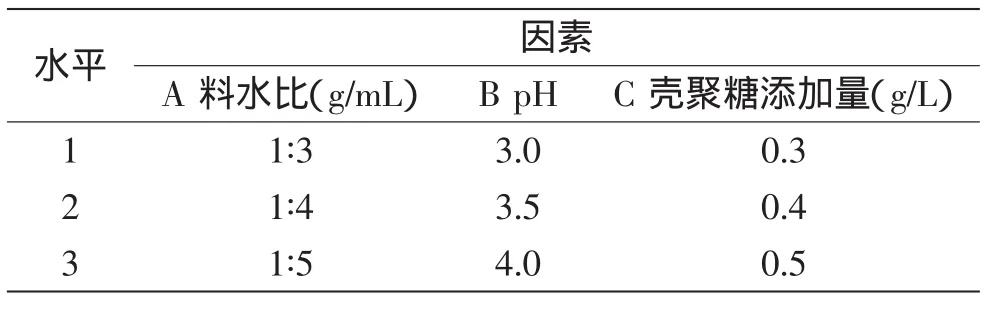
表1 正交实验设计Table 1 Orthogonal design
1.3 指标的计算

叶蛋白提取率(%)=叶蛋白得率×叶蛋白中粗蛋白质量分数/花椰菜茎叶干物质中粗蛋白质量分数×100
1.4 数据处理
实验数据分析及处理采用Excel和SPSS(17.0)软件。
2 结果与分析
2.1 花椰菜废弃茎叶中主要营养成分

表2 花椰菜废弃茎叶中主要营养成分Table 2 Main nutrients of discarded broccoli stems and leaves
由表2可以看出,虽然新鲜花椰菜废弃茎叶中水分含量较高,但其粗蛋白及粗纤维含量在干物质中比例较高,分别为21.70%和30.10%。此外,打浆后新鲜原液pH随料水比不同,在6.55~6.85之间,略偏酸性。研究表明苜蓿是叶蛋白含量较高的一种植物,其粗蛋白占到了干物质含量的18%~28%[12]。因此花椰菜废弃茎叶是适合作为提取叶蛋白的一种原料。
2.2 叶蛋白不同提取方法的筛选
从表3可见,采用酸絮凝剂法提取的花椰菜废弃茎叶叶蛋白得率最高,显著高于其余提取方法,其后依次是酸热沉淀法、直接加热法、酸沉淀法、碱沉淀法、碱热沉淀法。对叶蛋白提取率的影响依次为:酸絮凝剂法>酸热沉淀法>酸沉淀法>碱沉淀法>直接加热法>碱热沉淀法。碱热沉淀法提取的叶蛋白得率及提取率均显著低于其余各组,主要原因可能是碱沉淀后加热,蛋白质沉淀环境改变,反而有部分沉淀包括非蛋白提取物溶解进入上清液中。
近年来,叶蛋白提取方法主要有加热法、酸碱沉淀法、碱热法和酸热法、盐析法、有机溶剂法、发酵法和电浓缩法等[13]。本实验结果表明,采用酸絮凝剂法提取的花椰菜废弃茎叶叶蛋白得率及提取率最高,其原因可能是pH发挥了双重作用,使得壳聚糖的絮凝作用发挥到极致。蛋白质分子的电荷和溶解度随环境pH的变化而变化。pH较低时,蛋白质带正电荷;pH较高时,蛋白质带负电荷;在某一特定pH时,蛋白质为电中性[14]。因此适宜的pH有利于蛋白质的絮凝。而本实验所用的壳聚糖为酸溶性壳聚糖,合适的pH有利于壳聚糖的充分溶解,从而使其壳聚糖的絮凝作用发挥到最大。
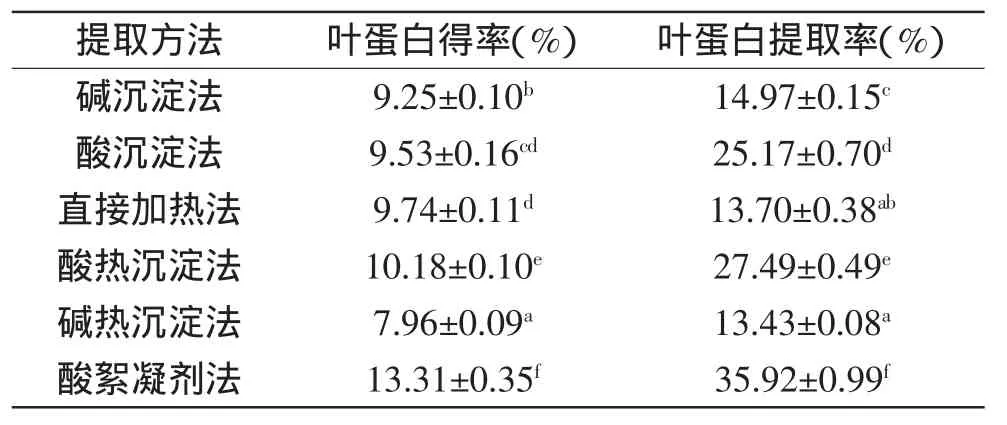
表3 不同提取方法对叶蛋白得率及提取率的影响Table 3 Effect of different extraction methods on yield and extraction rate of leaf protein concentrates
2.3 花椰菜废弃茎叶叶蛋白提取工艺优化
2.3.1 单因素实验结果
2.3.1.1 料水比对花椰菜废弃茎叶叶蛋白提取的影响 由图1可知,随着料水比值由1∶3降低至1∶4时,叶蛋白得率及提取率均显著提高,料水比值继续降低时,叶蛋白得率及提取率变化不大。当料水值比低于1∶4时,由于溶液太少,提取不充分,导致一部分蛋白质不能完全溶解,提取效果较低;当料水比值大于1∶4时,蛋白质已完全溶解,之后料水比值对叶蛋白得率及叶蛋白提取率影响不大,这与吕宗友等[15]的研究结果一致,而与敬思群等[16]的研究结果不一致。这可能与选择的料水比的变化范围有关,当料水比的变化范围较小时,加水量越大,叶蛋白提取越完全,而适中的料水比能以最少的提取液获得最大的叶蛋白[15];当料水比变化范围较大时,由于加水量过大,分离过程中蛋白质浓度过稀,从而导致蛋白质得率轻微下降[16]。

图1 料水比对叶蛋白得率及提取率的影响Fig.1 Effect of material to water rate on the yield and extraction rate of LPC
2.3.1.2 pH对花椰菜废弃茎叶叶蛋白提取的影响图2表明,pH对花椰菜废弃茎叶叶蛋白得率及提取率影响较显著。叶蛋白得率及提取率随pH的增加而提高,当pH达到4.0时,花椰菜废弃茎叶叶蛋白得率及提取率达到了最大值,分别为14.78%和39.00%,而当pH进一步升高时,叶蛋白得率及提取率反而均下降。其原因为蛋白质是一种两性电解质,其表面电荷随溶液的pH改变而发生变化。当溶液pH>pI(等电点)时蛋白质带负电荷;当溶液pH<pI时蛋白质带正电荷,当溶液pH接近pI时蛋白质静电荷为零,消除了蛋白质分子表面电荷之间的排斥力,使蛋白质分子易聚合沉淀[14]。实验中当pH为4.0时,叶蛋白得率及提取率均达最大值,此时叶蛋白的溶解度最小;当pH由4.0继续增大时,叶蛋白更多溶解于上清液中,其得率及提取率均呈现显著降低的趋势,这与肖海峻等[17]研究一致。
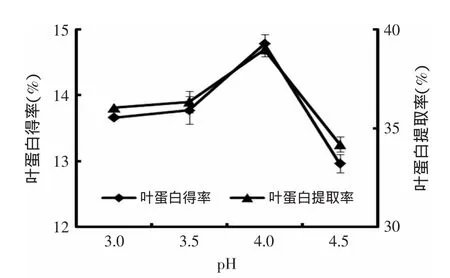
图2 pH对叶蛋白得率及提取率的影响Fig.2 Effect of pH value on the yield and extraction rate of LPC
2.3.1.3 壳聚糖添加量对花椰菜废弃茎叶叶蛋白提取的影响 图3表明,壳聚糖添加量对花椰菜废弃茎叶叶蛋白得率及提取率影响比较明显。废弃茎叶叶蛋白得率及提取率随壳聚糖添加量的增大而提高,在壳聚糖添加量为0.4g/L时,叶蛋白得率及提取率均达到了最大值,分别为15.04%和39.66%。而当壳聚糖添加量进一步提高时,蛋白质得率及提取率反而下降。大量实验研究表明,各种絮凝剂都有在相应条件下的最佳投加量,低于或超过这个用量都会使絮凝效果下降。用量不足时,壳聚糖分子链上的阳离子活性基团绝对数量有限,正电荷较少,不能与蛋白质胶体和悬浮颗粒所带负电荷完全电中和,壳聚糖分子链的吸附桥连作用有限,胶体不能完全脱稳凝聚,絮凝效率不高;过量时会将蛋白质胶体、悬浮微粒紧紧包围起来,导致“再稳”现象[18]。目前常用的蛋白絮凝剂有硫酸铝钾和聚乙二醇等,壳聚糖作为自然界唯一一种带正电荷的高分子聚合物,无毒无味,可生物降解,不会造成二次污染,是一种优良的絮凝剂[19-20]。
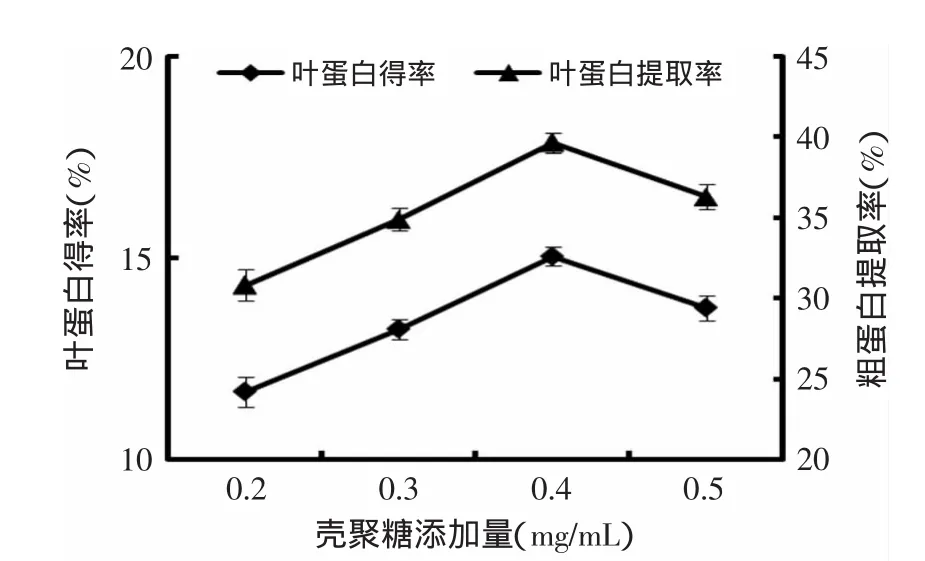
图3 壳聚糖添加量对叶蛋白得率及提取率的影响Fig.3 Effect of chitosan concentration on the yield and extraction rate of LPC
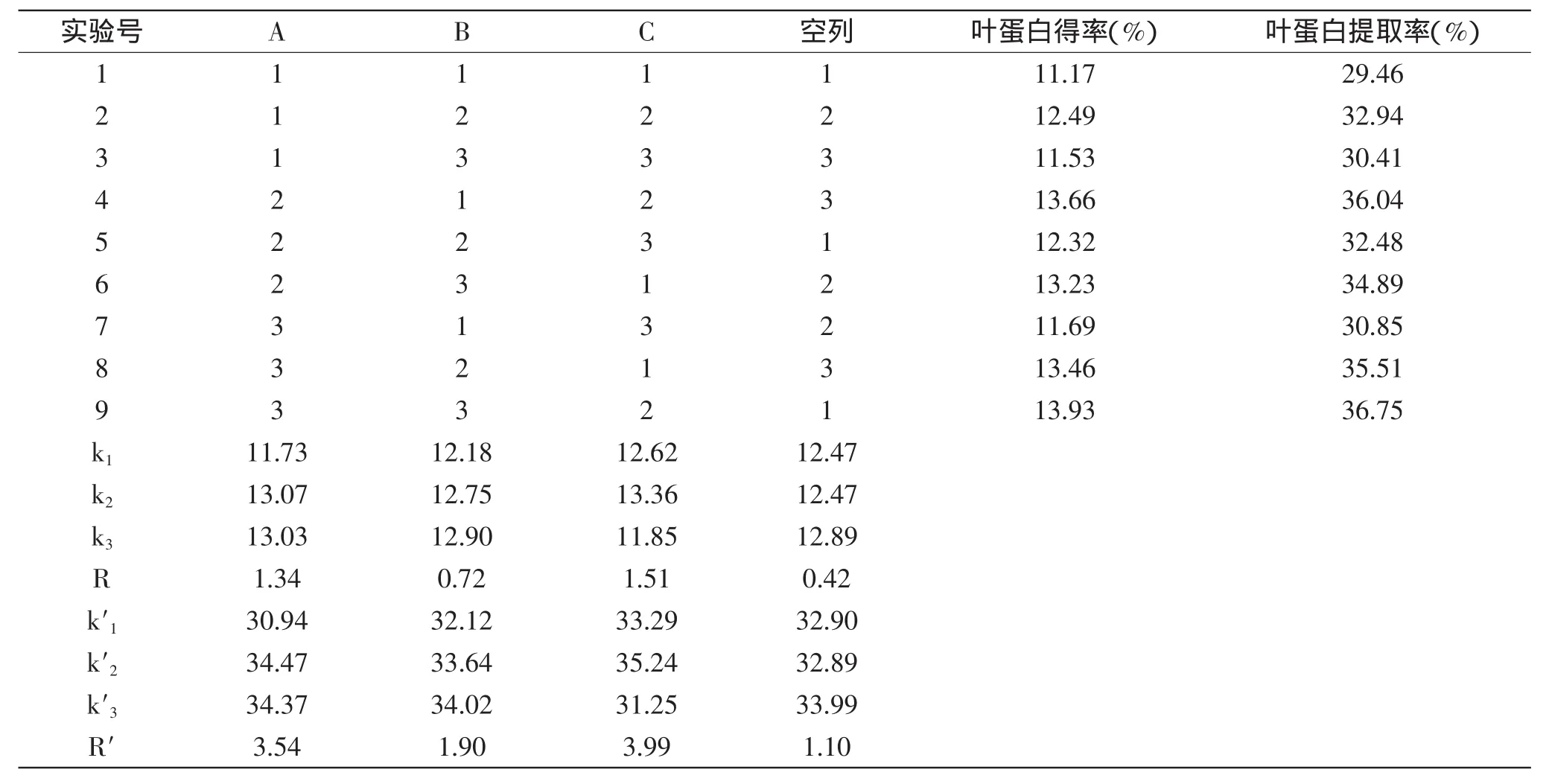
表4 花椰菜废弃茎叶叶蛋白提取工艺的正交实验结果Table 4 Orthogonal experimental results of extraction technology of LPC from discarded broccoli stems and leaves
2.3.2 正交实验结果 结合单因素实验结果,采用正交实验对叶蛋白提取工艺进一步优化,结果如下:表4表明,按照极差R的大小,影响花椰菜茎叶叶蛋白得率和提取率的主次因素的顺序均为C(壳聚糖添加量)>A(料水比)>B(pH)。叶蛋白得率和提取率的最佳组合均为A2B3C2,即料水比1∶4,pH4.0,壳聚糖添加量0.4g/L。
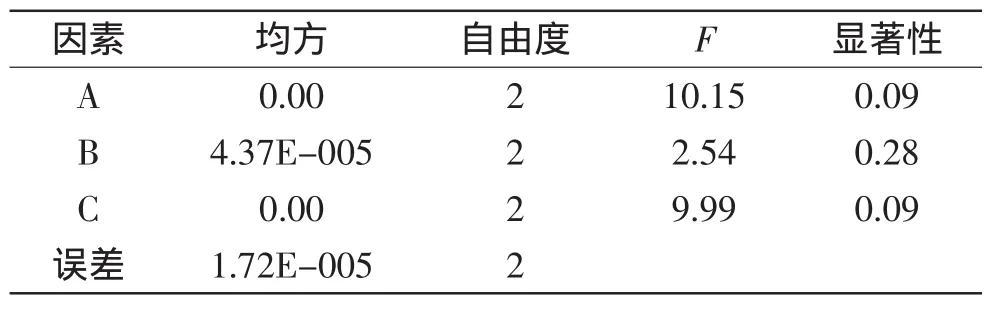
表5 叶蛋白得率正交实验方差分析Table 5 Variance analysis for the leaf protein yield of orthogonal test
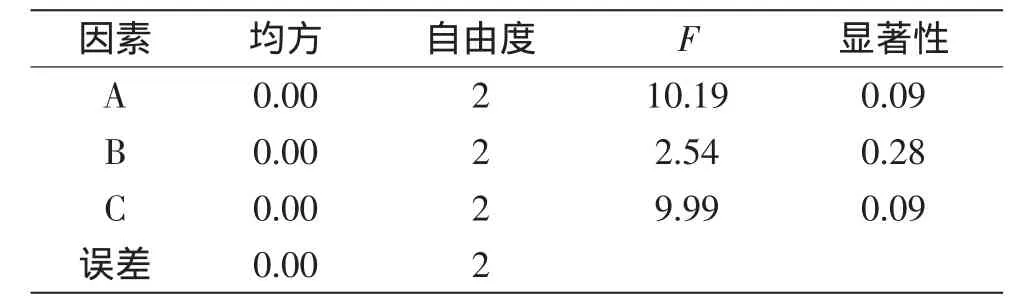
表6 叶蛋白提取率正交实验方差分析Table 6 Variance analysis for the leaf protein extraction rate of orthogonal test
A2B3C2这一最佳组合在正交实验中没有出现,通过验证实验后得到叶蛋白得率为14.79%、叶蛋白提取率为39.01%,大于表中A3B3C2的结果,这进一步验证了正交实验的准确性和可靠性。
由方差分析表5、表6可知,料水比与壳聚糖添加量对叶蛋白得率及提取率影响较大,pH对叶蛋白得率及提取率的影响最小。所以实际生产若考虑经济性,则在提取花椰菜废弃茎叶叶蛋白时可适当减少对pH的控制。
3 结论
本文确定了酸絮凝剂法为花椰菜废弃茎叶叶蛋白提取最佳方法,且通过单因素及正交实验得到花椰菜废弃茎叶叶蛋白最佳提取工艺为:料水比1∶4(g/mL),pH4.0,壳聚糖添加量0.4g/L。此时样品叶蛋白得率为14.79%、提取率为39.01%。
[1]何元翔,汪建旭,冯炜弘,等.萎蔫处理对花椰菜茎叶可青贮性影响[J].西北农业学报,2013,22(3):161-167.
[2]Quanhang L,Caili F.Application of response surface methodology for extraction of germinant pumpkin seeds protein[J].Food Chemistry,2005,92(4):701-706.
[3]Wani A A,Sogi D S,Grover L,et al.Effect of temperature,alkali concentration,mixing time and meal/solvent ratio on the extraction of water-melon seed proteins-a response surface approach[J].Biosystems Engineering,2006,94(1):67-73.
[4]Gorinstein S,Pawelzlk E,Licon E D,et al.Characterisation of pseudocereal and cereal proteins by protein and amino acid analyses[J].Journal of the Science of Food and Agriculture,2002,82(8):886-891.
[5]Rangel A,Domont G B,Pedrosa C,et al.Functional properties of purified vicilins from cowpea(Vigna unguic-ulata) and Pea(Pisum sativum) and cowpea protein isolate[J].Journalof Agricultural and Food Chemistry,2003,51(19):5792-5797.
[6]Sogi D S,Garg S K,Bawa A S.Functional properties of seed meals and protein concentrates from tomato processing waste[J].Journal of Food Science,2002,67(8):2997-3001.
[7]Tomotake H,Shimaoka I,Kayashita J,et al.Physicochemical and functional properties of buckwheat protein product[J].Journal of Agricultural and Food Chemistry,2002,50(7):2125-2129.
[8]Al-Farsi M A,Lee C Y.Optimization of phenolics and dietary fibre extraction from date seeds[J].Food Chemistry,2008,108(3):977-985.
[9]Mollea C,Chiampo F,Conti R.Extraction and characterization of pectins from cocoa husks:a preliminary study[J].Food Chemistry,2008,107(3):1353-1356.
[10]Roldan E,Sanchez-Moreno C,Ancos B,et al.Characterisation of onion(Allium cepa L.) by-products as food ingredients with antioxidant and antibrowning properties[J].Food Chemistry,2008,108(3):907-916.
[11]Alvise D N,Lesueur-Lambert C,Fertin B,et al.Hydrolysis and large scale ultrafiltration study of alfalfa protein concentrate enzymatic hydrolysate[J].Enzyme and Microbial Technology,2000,27(5):286-294.
[12]翟峰,张勇.苜蓿叶蛋白的开发与利用[J].中国饲料,2007,30(8):34-36.
[13]郭志华,曹稳根,廖红艳.叶蛋白的研究进展[J].宿州学院学报,2007,22(6):113-115.
[14]阎巧娟,李道娥,刘向阳,等.苜蓿叶蛋白提取工艺条件对蛋白质含量的影响[J].中国农业大学学报,1997,2(6):92-95.
[15]吕宗友,赵国琦,苏衍菁,等.白三叶叶蛋白提取及纯化工艺[J].草业科学,2011,28(11):2052-2056.
[16]敬思群,王桓.四翅滨藜叶蛋白提取工艺优化及氨基酸分析[J].郑州轻工业学报,2010,25(2):22-26.
[17]肖海峻,孟利前,杨新建,等.苜蓿叶蛋白提取工艺参数优化实验[J].食品科技,2011,36(4):159-162.
[18]郑怀礼.生物絮凝剂与絮凝技术[M].北京:化学工业出版社,2004:6-11.
[19]王志华,王书俊,黄毓礼.壳聚糖絮凝有机废水机理的研究工业水处理[J].工业水处理,2002,22(2):14-17.
[20]刘秉涛,张众,王海荣.壳聚糖对含蛋白废水的絮凝与回收[J].华北水利水电学院学报,2005,26(4):69-71.
