单菌和双菌固态发酵猪骨素的研究
2013-05-15邬应龙黄祎萌
张 宇,邬应龙,黄祎萌
(四川农业大学食品学院,四川雅安625014)
猪骨素是以天然猪骨抽提物为原料制备的膏状物,呈浅褐色或褐色,是一种优质廉价丰富的天然资源,含有大量的胶原、骨胶原和软骨素,其中的骨胶原蛋白分子形成一种十分稳定的三股超螺旋结构,不易被人体消化吸收[1],并且没经处理的猪骨素带有腥味,一般需进一步加工以促进原料分解和提高鲜味。马国霞等[2]采用红曲霉发酵猪骨素得到最小分子质量为8.1ku的多肽,左勇等[3]利用乳杆菌发酵骨素酶解液进一步提高了蛋白质的降解,忻欣等[4]采用酶解和发酵联用技术提高了羊骨中钙的转化率等。总体上讲,关于骨素发酵的报道多集中于液态发酵,而对微生物固态发酵骨素的研究相对较少。本实验在前期已优化了发酵工艺的基础上,以猪骨素为主要原料,分别利用红曲菌单菌固态发酵和红曲菌-米曲菌双菌固态发酵,对两种发酵过程中的蛋白酶活力、淀粉酶活力、木聚糖酶活力、氨基酸态氮、还原糖和红色指数的变化进行研究,并通过SDS-PAGE电泳分析两种发酵过程中蛋白质的降解情况,以期为猪骨素固态发酵的进一步研究提供参考。
1 材料与方法
1.1 材料与仪器
红曲菌、米曲菌 均由作者所在实验室保存;猪骨素(粗蛋白质量分数45.7%) 乐山天添天然调味料食品有限公司提供;麦麸(粗蛋白质量分数13.4%)
购于当地农贸市场;燕麦木聚糖 美国Sigma公司;蛋白质分子量标准(116~14.4ku) 碧云天生物技术研究所;SDS-PAGE凝胶配制试剂盒 武汉博士德生物公司;可溶性淀粉、干酪素、磷酸氢二钠、柠檬酸均为国产分析纯;种子培养基 200g马铃薯切成小块,加适量水煮沸20min,纱布过滤后加入20g葡萄糖,水定容至1000mL,分装于300mL三角瓶中,120mL/瓶;猪骨素固态发酵培养基 称取10g麦麸置于300mL三角瓶中,猪骨素8g,水8mL,pH调至5.5,用玻璃棒将发酵底物搅拌均匀。
DHP-9162型电热恒温培养箱 上海一恒科技有限公司;UV-3200型紫外可见分光光度计 四川新科仪器有限公司;DZKW-4型电子恒温水浴锅 北京中兴伟业仪器有限公司;Mini-protean垂直电泳仪、GelDoc 2000凝胶成像系统 美国Bio-Rad公司。
1.2 实验方法
1.2.1 猪骨素固态发酵 将在斜面上培养6d的红曲菌和3d的米曲菌分别制成约107个/mL的孢子悬浮液,分别取1mL接种于种子培养基中,于30℃、120r/min摇床分别培养5、2d,得到种子培养液。猪骨素红曲菌发酵:取1mL红曲菌种子培养液接种于猪骨素固态发酵培养基中,28℃恒温培养40d;猪骨素双菌发酵:对双菌发酵的蛋白酶活力、色泽、呈味综合考量后确定双菌发酵工艺为红曲菌于28℃恒温培养10d后,再接种米曲菌继续培养30d。
1.2.2 粗酶液和发酵液的制备 准确称取5g物料,加入20mL无菌蒸馏水,30℃、120r/min摇床提取2h,6000r/min,4℃离心20min,上层清液为粗酶液;另取5g物料于干燥箱中60℃干燥至恒重,即为物料干重;测得的酶活除以干重即为固态发酵底物的酶活,其单位为U/g干基。加入100mL无菌蒸馏水于发酵到指定时间的三角瓶中,其余与粗酶液制备方法相同,上层清液为发酵液。
1.2.3 水解酶活力测定 蛋白酶活力的测定采用福林法[5]。该红曲菌在此发酵条件下几乎不产中性和碱性蛋白酶,测定酸性蛋白酶活力。酶活力定义:在40℃下每分钟水解酪蛋白产生lμg酪氨酸,定义为1个蛋白酶活力单位。
木聚糖酶活力的测定采用3,5-二硝基水杨酸(DNS)比色法,参照文献[6]并作适当修改:采用0.1mol/L pH5.0的柠檬酸缓冲液稀释粗酶液和配制木聚糖溶液,40℃水浴反应20min。酶活力定义:在上述条件下,每20min水解木聚糖形成1μmol还原糖(以木糖计)作为1个木聚糖酶活力单位。
淀粉酶活力的测定采用3,5-二硝基水杨酸(DNS)比色法,参照文献[7]并作适当修改:采用0.1mol/L pH5.5的柠檬酸缓冲液稀释粗酶液和配制淀粉溶液,45℃水浴反应10min。酶活力定义:在上述条件下,每分钟水解淀粉产生1μmol葡萄糖作为1个淀粉酶活力单位。
1.2.4 氨基酸态氮测定 氨基酸态氮测定采用甲醛值法[8]。
1.2.5 还原糖测定 还原糖测定按照Miller的方法[9]。
1.2.6 红色指数的测定 参照李丹等[10]的方法。
1.2.7 蛋白质降解产物的SDS-PAGE电泳分析方法凝胶浓度分别为浓缩胶5%,分离胶15%,胶的制备方法参照文献[11-12]进行。发酵液用无菌水稀释一倍,稀释液与5×上样缓冲液以4∶1的体积比混合,样品上样量均为15μL;电泳初始电压80V,待样品进入分离胶后电压调至110V直至电泳结束,40℃染色2h后再脱色。
2 结果与分析
2.1 猪骨素发酵过程中水解酶活力的变化
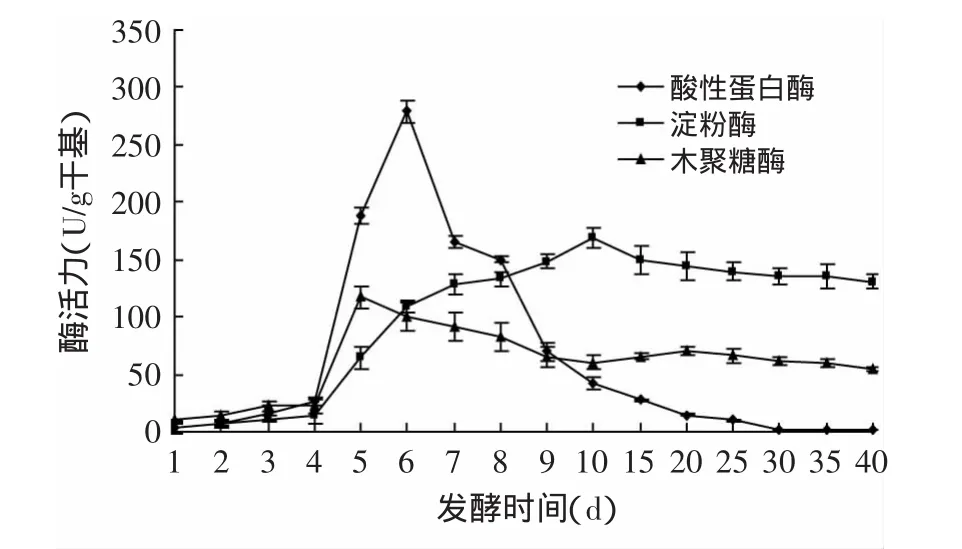
图1 红曲菌发酵猪骨素过程中水解酶活力变化Fig.1 Change of hydrolase activity during pig bone extract fermentation by Monascus
由图1可知,红曲菌水解酶活力在发酵4d后增长较快,蛋白酶活力、淀粉酶活力、木聚糖酶活力分别在第6、10、5d达到峰值,随后酶活力下降到一定程度后呈相对平稳的走势,其中蛋白酶活力下降幅度最大,在第30d以后,基本检测不出。三种水解酶活力在发酵过程中均逐渐增加到峰值后下降,可能是由于发酵初期红曲菌大量生长繁殖,在此过程中需大量利用碳源和氮源,促进水解酶的分泌,随着体系中水分的降低、可直接利用的营养物质的减少、pH的变化等原因,微生物的生长代谢受到抑制,导致水解酶活力下降。
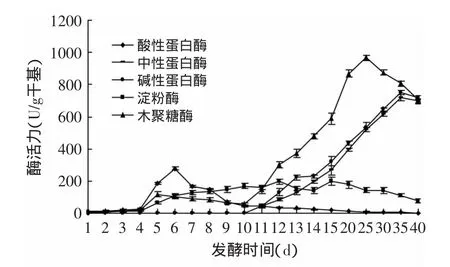
图2 双菌发酵猪骨素过程中水解酶活力变化Fig.2 Change of hydrolase activity during pig bone extract fermentation by double strains
如图2所示,在第10d接种米曲菌后,中性蛋白酶活力、碱性蛋白酶活力、木聚糖酶活力开始快速升高,分别在第35、35、25d达到峰值,随后有下降的幅度,且中性蛋白酶和碱性蛋白酶变化趋势基本相同;酸性蛋白酶活力、淀粉酶活力总体变化幅度不大。
结合图1和图2可知,红曲菌产酸性蛋白酶和木聚糖酶能力较弱,在发酵后期蛋白酶活力下降幅度较快,不利于原料的降解,但红曲菌在发酵过程中可分泌出红曲色素及活性物质,可改善色泽[13]。红曲菌发酵10d后接种米曲菌的双菌发酵,中性、碱性蛋白酶、木聚糖酶活力增加,说明双菌发酵可改善酶系组成,与张艳芳等[14]利用米曲霉双菌株组合发酵得出的结论相同。
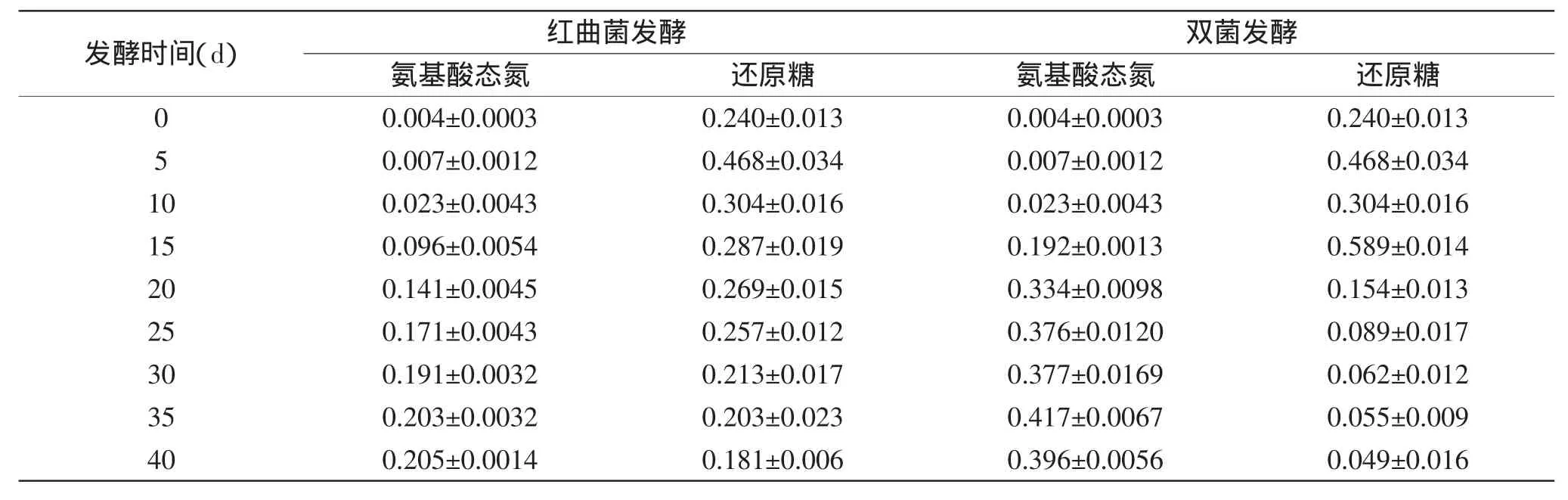
表1 猪骨素发酵过程中氨基酸态氮和还原糖的变化(g/100mL)Table 1 Change of Amino acid nitrogen and reducing sugar during pig bone extract fermentation(g/100mL)
2.2 猪骨素发酵过程中产物水解性能的变化
2.2.1 猪骨素发酵过程中氨基酸态氮和还原糖的变化 体系中化学组分的变化与酶的作用密不可分[15],在发酵过程中产生的蛋白酶、淀粉酶、木聚糖酶将蛋白质、淀粉、木聚糖降解。由表1可以看出,红曲菌单菌和双菌发酵猪骨素过程中氨基酸态氮含量均随着发酵时间的延长不断增加,双菌发酵产生的蛋白酶酶系多样,红曲霉的酸性蛋白酶和米曲霉的中性、碱性蛋白酶相辅相成,丰富了酶切方式,水解充分,双菌发酵的氨基酸态氮含量明显高于红曲菌发酵;还原糖量均表现为接种微生物后先增加后逐渐降低,在第20d以后,双菌发酵的还原糖量少于单菌发酵,主要原因是米曲菌大量生长繁殖,以及还原糖与体系中其他降解产物的相互作用,需消耗大量还原糖,此阶段总糖的水解补给不足以满足体系所需。
2.2.2 猪骨素发酵过程中红色指数的变化 由图3可看出,双菌发酵既发挥了红曲菌产红曲红色素的优势,而且接种米曲菌后,随着蛋白酶活力和木聚糖酶活力的不断提高,蛋白质原料、淀粉质原料不断被降解成氨基酸、还原糖类物质,在一定条件下发生美拉德反应和焦糖化反应等,形成棕红色物质,使红色指数继续增加。与单菌相比,双菌发酵可提高发酵液的红润度。
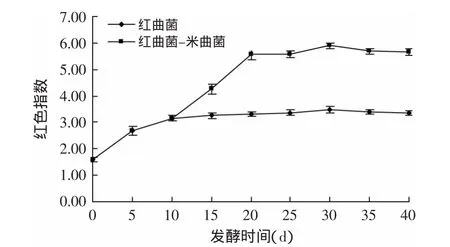
图3 猪骨素发酵过程中红色指数的变化Fig.3 Change of red index during pig bone extract fermentation
2.2.3 猪骨素发酵过程中蛋白质降解产物的SDSPAGE电泳分析结果 由图4可看出,红曲菌降解猪骨素的程度不高,其分子质量主要在116~45ku之间,且整个电泳图泳道颜色较深,说明样品中蛋白质浓度较高,蛋白质降解成多肽、寡肽或者氨基酸的程度不够。
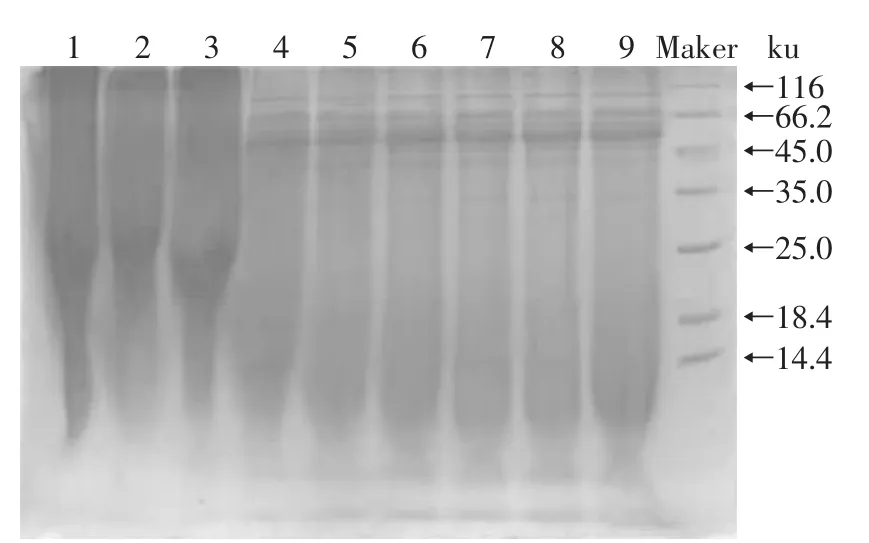
图4 红曲菌发酵猪骨素过程中蛋白质降解产物电泳图Fig.4 SDS-PAGE electropherograms during pig bone extract fermentation by Monascus

图5 双菌发酵猪骨素过程中蛋白质降解产物电泳图Fig.5 SDS-PAGE electropherograms during pig bone extract fermentation by mixed strains
由图5可看出,红曲菌发酵10d后接种米曲菌的双菌发酵,从第10d到第15d,发酵液中蛋白质分子质量分布有明显的变化,随着发酵时间的增加,可看到的蛋白质条带主要集中在116~25ku之间,在25ku以下,可看到五条颜色较浅的蛋白质条带,说明大分子蛋白质不断被降解成了小分子蛋白质。
结合图4、图5可知,红曲菌单菌发酵蛋白质分子质量主要集中在116~45ku,双菌发酵蛋白质分子质量主要集中在116~25ku,双菌发酵的分子质量分布范围较宽,可看到的蛋白质条带较多,且条带更为清晰,泳道基本无背景色干扰,说明双菌发酵过程中,大分子蛋白质被大量的降解成了小分子蛋白质、多肽和氨基酸,双菌发酵更有利于蛋白质的降解。
3 结论
3.1 红曲菌水解酶活力达到峰值后,均呈下降的走势,且蛋白酶活力下降幅度最快;双菌组合发酵,在接种米曲菌后,中性、碱性蛋白酶活力和木聚糖酶活力快速上升,而产酸性蛋白酶和淀粉酶能力与红曲菌发酵过程接近。
3.2 在发酵过程中,接种米曲菌后的双菌发酵,其氨基酸态氮明显高于红曲菌发酵,且双菌发酵可发挥红曲菌产红曲红色素的优势,提高发酵液的红润度,还原糖量均表现为先增加后逐渐降低,通过SDSPAGE电泳分析,与红曲菌单菌发酵相比较,双菌发酵的多肽条带较多,分子质量分布范围较宽,且条带清晰,说明双菌发酵更有利于蛋白质的降解。
[1]向聪,马美湖.畜骨综合利用与产品开发研究进展[J].肉类研究,2009(6):78-84.
[2]马国霞,邬应龙,刘凌志.猪骨素发酵及其产物的电泳分析[J].食品与发酵工业,2011,37(8):56-60.
[3]左勇,谢晖,鞠帅,等.猪骨酶解液乳酸菌发酵条件的研究[J].中国调味品,2012,37(2):55-58.
[4]忻欣,马俪珍,孔保华,等.采用酶解和发酵联用技术提高羊骨中钙转化率[J].食品与发酵工业,2009,35(8):59-63.
[5]中华人民共和国行业标准ZBX 66030-87[S].
[6]Boucherba Nawel,Benallaoua Said,Copinet Estelle,et al.Production and partial characterization of xylanase produced by Jonesia denitrificans isolated in Algerian soil[J].Process Biochemistry,2011,46:519-525.
[7]Mouna Sahnoun,Samir Bejar,Aida Sayari,et al.Production,purification and characterization of two α-amylase isoforms from a newly isolated Aspergillusoryzae strain S2[J].Process Biochemistry,2012,47:18-25.
[8]中华人民共和国国家标准GB/T 5009.39-2003[S].
[9]Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical chemistry,1959,31(3):426-428.
[10]李丹,崔春,赵谋明.高盐稀态酱油酿造过程中的色泽变化[J].食品与发酵工业,2010,36(4):75-79.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:77-90.
[12]Saleh H Salmen,Hameza M Abu-Tarboush,Abdulrahman A Al-Saleh,et al.Amino acids content and electrophoretic profile of camel milk casein from different camel breeds in Saudi Arabia[J].Saudi Journal of Biological Sciences,2012,19(2):177-183.
[13]郭爱莲,戴德慧,蒋家新.新型功能性红曲调味品的研究[J].食品科学,2002,23(7):84-87.
[14]张艳芳,陶文沂.米曲霉双菌株组合制曲改善酶系组成与发酵效果研究[J].食品与发酵工业,2008,34(9):37-39.
[15]吴拥军,龙菊,程昌泽,等.腐乳发酵过程中酶活力和化学组分变化的研究[J].食品科学,2009,30(3):249-252.
