低分割立体定向放疗联合自体CIK细胞免疫治疗中晚期肺癌的疗效观察
2013-04-19王园园王义善杨桂青林思祥
王园园,王义善,杨桂青,林思祥
肺癌是我国发病率及致死率最高的恶性肿瘤,临床发现时大多已进展至中晚期,失去手术治疗的机会[1-2]。化疗可有效控制肿瘤生长,但大多数中晚期肺癌患者因恶病质或低耐受性而无法接受或完成化疗[3-4]。低分割立体定向放射外科手术平台——射波刀因其高剂量、少疗程等特性可安全、有效地治疗肿瘤病灶,减少对正常组织的损伤[5]。大量前期报道证实,射波刀可作为无法手术治疗的晚期高危肿瘤的首选治疗手段[6-7]。但是,射波刀作为一种局部治疗手段,在控制多数中晚期患者存在的远处转移微小病灶方面受到限制。射波刀联合自体CIK细胞免疫治疗可在维持其高效的局部控制率的同时,提高对远处转移病灶的杀伤力,并增强患者自身免疫功能。CIK细胞作为最重要的过继性细胞免疫治疗手段之一,其潜在的放射增敏效应及对全身肿瘤细胞的清除作用日益受到关注。本研究观察射波刀联合自体CIK细胞免疫治疗对中晚期肺癌的近期临床疗效,现报道如下。
1 资料与方法
1.1 病例纳入标准 经病理及影像学确认为Ⅲ~Ⅳ期肺部恶性肿瘤;卡氏评分≥50分;预期生存期≥3个月;血常规、肾功能、肝功能等正常;知情并同意检查及治疗。
1.2 一般资料 选取2010年11月—2011年8月解放军第107医院射波刀中心收治的中晚期肺癌患者48例(共95个病灶)为研究对象,其中男35例,女13例;年龄45~86岁,中位年龄70岁。病理诊断为小细胞肺癌4例,非小细胞肺癌44例。均经CT扫描临床诊断。其中骨转移8例,脑转移4例。根据治疗不同分为射波刀治疗组(CK组)37例,射波刀联合CIK细胞免疫治疗组(CK联合CIK组)11例,两组患者性别、年龄、卡氏评分≤60分、病灶数、转移、病理类型、肺癌切除术史比较,差异均无统计学意义(P>0.05,见表1),具有可比性。
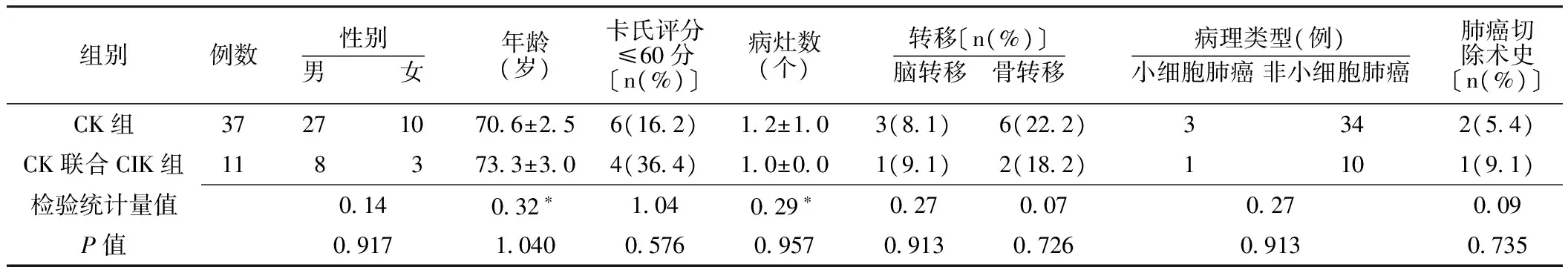
表1 两组患者一般资料比较Table 1 Comparison of patients′ characteristics between CK and CK/CIK groups
注:*为t值,余检验统计量值为χ2值
1.3 临床表现 CK组37例患者中,出现咳嗽、咳痰、胸闷、憋气等呼吸系统症状者24例,有骨转移症状如胸背部疼痛者6例,伴声音嘶哑者4例;CK联合CIK组11例患者中,咳嗽咳痰7例,骨转移疼痛症状2例,声音嘶哑1例。
1.4 治疗方法 所有患者在接受本研究前均经历1周对前期治疗毒副作用的清除时期,期间主要以对症及中药调整为主要治疗。射波刀立体定向放射手术系统为ACCURAY公司的CyberKnife System,采用发射6 MV X线的直线加速器,在4 s内全自动完成自Beam Off至X线摄影、新旧图像对比、计算动度差异、调控机械臂至新方向照射及Beam On等操作,补偿肿瘤的位移,达到亚毫米的临床精准度。参考定位增强CT(1.25 mm)勾画大体肿瘤体积,计划靶体积在大体肿瘤体积基础上三维外放2 mm。治疗剂量取决于肿瘤大小、部位及分期,60%~90%处方剂量包绕靶区。射波刀治疗分3~6次,于1周内完成。总剂量为20~51 Gy,单次剂量为4~12 Gy。周围型肺癌剂量参考45 Gy/3~5次;中央型肺癌剂量参考为30 Gy/3~5次;具体根据患者身体状况及肿瘤类型而定。
射波治疗后1周,对CK联合CIK组患者进行自体CIK细胞的回输。CIK细胞治疗包括CIK细胞的体外培养与扩增以及患者体内回输CIK细胞。射波刀治疗前抽取患者外周血后分离单核细胞,加入特定细胞因子诱导CIK细胞分化、增殖及扩增。CIK细胞培养的第14天收集成熟的CIK细胞,注入0.9%氯化钠溶液中回输给患者。CIK细胞治疗包括2次CIK细胞回输。
1.5 CIK细胞表型检测 流式细胞仪Facs Calibur 检测培养14 d后细胞CIK表型,以CD3+/CD16+56+百分比评价细胞培养情况。具体步骤如下:取2支流式管编号1#、2#,向流式管内各加入1×106个细胞,离心后弃上清液,加入磷酸盐缓冲液(PBS)3 ml,再次离心洗涤后弃上清液,100 μl PBS重悬细胞;1#管用400μl PBS重悬细胞,作为阴性对照,不做任何处理,备用;向2#管中加入9 μl CD3/CD16+56+荧光抗体,室温避光孵育15~20 min;抗体孵育结束,向2#管内加入PBS 2 ml,混匀离心后弃上清液,重复洗涤一次,用400 μl PBS重悬细胞,上机检测。
1.6 评价指标 治疗结束后3~4个月行增强CT(1.25 mm)复查,并记录患者症状、体征及一般情况。采用世界卫生组织(WHO)肿瘤近期疗效标准判定肿瘤治疗的近期疗效(有效率)。疗效评价标准:(1)客观疗效评价标准:完全缓解(CR):所有症状、体征完全消失4周;部分缓解(PR):肿瘤大小估计减少≥50%至少4周;总有效率=(CR+PR)/总例数×100%。根据患者治疗前及治疗后3个月卡氏评分改善情况评价对患者生活质量的影响。卡氏评分标准:100分:正常,无症状和体征;90分:能进行正常活动,有轻微症状和体征;80分:勉强进行正常活动,有一些症状或体征;70分:生活能自理,但不能维持正常生活和工作;60分:生活能大部分自理,但偶尔需要别人帮助;50分:常需要人照料;40分:生活不能自理,需要特别照顾和帮助;30分:生活严重不能自理;20分:病重,需要住院和积极的支持治疗;10分:重危,临近死亡;0分:死亡。
1.7 随访 截止到2012年5月随访4~6个月,中位随访时间5个月。

2 结果
2.1 治疗情况 CK组患者最大肿瘤病灶为13.0 cm×10.0 cm×9.8 cm,平均处方剂量为 (35.4±5.4)Gy,等剂量线为66%~82%;CK联合CIK组患者最大肿瘤病灶为11.0 cm×10.0 cm×6.0 cm,平均处方剂量为(35.6±6.3)Gy,等剂量线为69%~81%。CK联合CIK组有2例接受了4次CIK细胞回输,9例接受了2次CIK细胞回输。CIK细胞回输过程中没有感染或毛细血管渗漏等意外情况发生,急性不良反应主要为发热;2例患者在细胞回输后1~3 h内发热,体温37.6~40.0 ℃,不需做特殊处理,仅在体温>39.0 ℃时进行物理降温或给予解热药物治疗。
2.2 近期疗效评价 CK组患者中完全缓解10例,部分缓解14例,总有效率为64.9% (24/37);CK联合CIK组中完全缓解5例,部分缓解4例,总有效率为81.8% (9/11);两组总有效率比较差异无统计学意义(χ2=0.48,P>0.05)。
2.3 生活质量评分 CK组与CK联合CIK组治疗前卡氏评分比较,差异无统计学意义(P>0.05);两组治疗后比较,差异有统计学意义(P<0.05,见表2)。


组别例数治疗前治疗后CK组3765 0±10 073 6±11 2CK联合CIK组1167 7±9 086 4±11 6u值1 862 92P值0 1090 013
2.4 CIK细胞回输 对CK联合CIK组患者回输前进行CIK细胞表型的检测显示,培养所得CIK细胞CD3+/CD16+56+中位表达百分比平均(18.80±4.16)%,回输细胞中活性细胞比例>99.5%,单次回输细胞数量>200亿。
3 讨论
临床上,肺癌患者发现时多已晚期,使肺癌成为世界范围内癌症的第1大死因。低分割立体定向放射外科手术平台——射波刀已被证实可有效治疗早期肺部恶性肿瘤[8]。对于晚期肺癌患者的临床治疗,射波刀因其局部治疗效果显著、毒副作用轻等优点而日益受到重视。目前,对晚期肺癌的治疗指南为姑息性手术切除、姑息性放疗或姑息性化学治疗。不幸的是,大多数晚期肺癌患者因恶病质而不能进行手术或无法耐受化疗。一直以来,对这些无法手术或化疗的患者,放疗被认为是首选治疗[9]。但传统放疗,即使目前先进的影像追踪放射治疗过程中,因考虑到对周围正常组织的保护而常不得不降低对照射靶区的放射剂量,致使放疗后肿瘤局部控制率低,复发率高[10-11]。与目前临床使用的影像追踪放射治疗手段相比,射波刀增设了同步呼吸追踪系统,尤其适于肺部肿瘤的治疗。
近年来,越来越多的文献证实,射波刀治疗肺部恶性肿瘤的显著疗效,一些前期研究也证实了射波刀亦可作为晚期肺癌患者的首选治疗手段[12]。尽管射波刀治疗晚期肺癌患者取得了高效的局部肿瘤控制率及显著的正常组织保护效益,但其在抑制肿瘤复发方面并不尽如人意[13]。单纯提高射波刀治疗的放射剂量无法明显提高肿瘤复发抑制率,射波刀联合肿瘤其他治疗策略的综合治疗方法日益受到研究者的认可[14-15]。另外,很多临床研究分析发现,影响射波刀局部控制率的主要因素是肿瘤的体积。有学者对射波刀治疗后随访11个月的患者生存率进行统计,发现肿瘤体积<6 cm3的生存率为100%,6~12 cm3的患者生存率为93%,>12 cm3的患者生存率仅为47%[16]。肿瘤体积越大,局部控制率越低,可能与晚期肿瘤患者机体的整体状况差有关。本研究将射波刀联合自体CIK细胞免疫治疗用于晚期高难肺癌患者的临床治疗中,以期增强患者免疫力,进一步清除放疗后患者体内残余的肿瘤细胞,最终显著能提高晚期高难肺癌患者的临床疗效。本研究中,CK组患者治疗总有效率为64.9%,CK联合CIK组为81.8%,与前期研究所报道160例中晚期肿瘤常规适形放射治疗有效率42.50%相比[17],两组总有效率显著高于常规适形放射治疗有效率,但CK组与CK联合CIK组比较无明显差异,说明射波刀治疗在肿瘤局部控制率方面作用显著,且CIK细胞免疫治疗在肿瘤病灶生长控制方面见效较慢,可能与其属于全身性免疫提高治疗有关。进一步分析两组患者治疗后的犬氏评分,证实肿瘤精确射波刀联合CIK细胞免疫治疗,可明显改善患者生活质量,提高患者免疫力,在局部有效控制的基础上清除中晚期肿瘤患者广泛残余的癌细胞。
免疫治疗在人类肿瘤的临床治疗中日益受到关注[18-19]。过继性细胞免疫治疗通过为患者输入具有抗癌活性的免疫细胞,直接杀伤肿瘤细胞或激发机体抗肿瘤免疫效应,从而达到治疗肿瘤的目的[20]。自体细胞免疫治疗在临床肿瘤治疗中的作用及应用主要包含以下:(1)临床恶性肿瘤综合治疗的一部分,常规治疗后的巩固治疗;(2)一些免疫原性较强的恶性肿瘤或对化疗和放疗不敏感肿瘤在手术或介入微创治疗后可直接接受细胞免疫治疗;(3)通常在进行体细胞免疫治疗前,要降低肿瘤负荷。
CIK细胞是将人的外周血单个核细胞在体外用多种细胞因子〔如抗CD3McAb、白介素(IL)-2、γ干扰素(IFN-γ)、IL-1α等〕共同培养一段时间后获得的一群异质细胞,因其同时表达T细胞及NK细胞表型且具有细胞毒性T淋巴细胞功能而被认为是最高效的过继性细胞免疫治疗细胞[21]。CIK细胞抗肿瘤作用机制主要包括以下几点:(1)CIK细胞可以通过不同的机制识别肿瘤细胞,释放颗粒酶、穿孔素等毒性颗粒,这些颗粒直接穿透封闭的肿瘤细胞膜进行胞吐,从而导致肿瘤细胞裂解;(2)通过Ⅱ型跨膜糖蛋白(FasL)与肿瘤细胞膜表达的Ⅰ型跨膜糖蛋白(Fas)结合,诱导肿瘤细胞凋亡[22];(3)CIK细胞还能分泌高浓度的IL-2、IL-6、肿瘤坏死因子(TNF)、IFN-γ等多种细胞因子,不仅对肿瘤细胞有直接抑制作用,还可通过调节机体免疫系统反应性间接杀伤肿瘤细胞;(4)CIK在体内的抗肿瘤作用还与促进T细胞增殖活化有关。与其他免疫细胞相比,CIK细胞具有以下独特的优点[23]:(1)CIK细胞可通过收集癌症患者外周血单核细胞在体外诱导分化并扩增培养;(2)CIK细胞对肿瘤的杀伤性强于淋巴因子激活的杀伤细胞或NK细胞;(3)CIK细胞杀伤性是非MHC限制性的;(4)CIK细胞可作为最终效应细胞直接杀伤肿瘤细胞;(5)CIK细胞不介导主要组织相容性反应;(6)CIK细胞也可高效杀伤多耐药、FasL阳性或抗放射恶性肿瘤细胞等。本研究采用的CIK细胞培养技术14 d内细胞扩增1 000倍以上,回输数量>200亿;细胞回输前有严格质量控制,回输细胞中活性细胞比例>99.5%。
目前众多学者研究了射波刀或CIK细胞在晚期肺部恶性肿瘤治疗中的疗效,本研究将此两种手段联合用于晚期高难肺癌患者的临床治疗中,近期疗效评价证实射波刀联合CIK免疫治疗可能协同杀伤恶性肿瘤细胞,有利于提高晚期高难肺癌患者生存质量。
1 Ahn SH,Han MS,Yoon JH,et al.Treatment of stage Ⅰ non-small cell lung cancer with CyberKnife,image-guided robotic stereotactic radiosurgery[J].Oncol Rep,2009,21(3): 693-696.
2 卓小丽,谢贤和, 李诗运,等.培美曲塞联合顺铂与TP方案治疗晚期非小细胞肺癌疗效比较[J].海南医学院学报,2011,18(1):45-47.
3 Wilcox EE,Daskalov GM,Lincoln H,et al.Comparison of planned dose distributions calculated by Monte Carlo and Ray-Trace algorithms for the treatment of lung tumors with cyberknife: a preliminary study in 33 patients[J].Int J Radiat Oncol Biol Phys,2010,77(1): 277-284.
4 王云,李贲.国产盐酸吉西他滨治疗老年晚期非小细胞肺癌的临床观察[J].疑难病杂志,2010,9(3):214.
5 Bondiau PY,Doyen J,Mammar H,et al.Reirradiation of spine and lung tumor with CyberKnife[J].Cancer Radiother,2010,14(6/7): 438-441.
6 Liu P,Chen L,Huang X.The antitumor effects of CIK cells combined with docetaxel against drug-resistant lung adenocarcinoma cell line SPC-A1/DTX in vitro and in vivo[J].Cancer Biother Radiopharm,2009,24(1):91-98.
7 张莉,韩潇,张建清,等.局部晚期非小细胞肺癌放化疗后复发的相关因素研究[J].中国全科医学,2012,15(3):980.
8 Gibbs IC,Loo BW Jr.CyberKnife stereotactic ablative radiotherapy for lung tumors[J].Technol Cancer Res Treat,2010,9(6): 589-596.
9 Collins BT,Vahdat S,Erickson K,et al.Radical cyberknife radiosurgery with tumor tracking: an effective treatment for inoperable small peripheral stage Ⅰ non-small cell lung cancer[J].J Hematol Oncol,2009,2:1.
10 Sharma SC,Ott JT,Williams JB,et al.Clinical implications of adopting Monte Carlo treatment planning for CyberKnife[J].J App Clin Med Phys,2010,11(1):3142.
11 杨媚,张莉,艾力·吐尔逊,等.非小细胞肺癌放化疗不同联合模式对生活质量影响的评价[J].中国全科医学,2011,14(2):381.
12 Hoogeman M,Prévost JB,Nuyttens J,et al.Clinical accuracy of the respiratory tumor tracking system of the cyberknife: assessment by analysis of log files[J].Int J Radiat Oncol Biol Phys,2009,74(1):297-303.
13 Timmerman R,Paulus R,Galvin J,et al.Stereotactic body radiation therapy for inoperable early stage lung cancer[J].JAMA,2010,303(11):1070-1076.
14 Lv Y,Wang Z,Zhu X,et al.Preliminary effect of CyberKnife radiosurgery in the treatment of 31 patients with advanced non-small cell lung cancer[J].Zhongguo Fei Ai Za Zhi,2011,14(4): 329-334.
15 汪质良.Ⅲ期非小细胞肺癌同步放化疗临床疗效及安全性分析[J].海南医学院学报,2012,18(2):349-350.
16 Brown JM,Diehn M,Loo BW Jr.Stereotactic ablative radiotherapy should be combined with a hypoxic cell radiosensitizer[J].Int J Radiat Oncol Biol Phys,2010,78(2): 323-327.
17 王义善,王园园,姜鹏,等.射波刀手术平台对中晚期高难肿瘤患者的治疗分析[J].中华临床医师杂志(电子版),2011,5(19):5768-5771.
18 Ballen KK,Colvin G,Dey BR,et al.Cellular immune therapy for refractory cancers: novel therapeutic strategies[J].Exp Hematol,2005,33(12):1427.
19 王亮,张薇.肿瘤相关巨噬细胞的研究进展及靶向免疫治疗[J].中国全科医学,2010,13(7):2300.
20 Hontscha C,Borck Y,Zhou H,et al.Clinical trials on CIK cells: first report of the international registry on CIK cells(IRCC) [J].J Cancer Res Clin Oncol,2011,137(2):305-310.
21 Schmidt-Wolf GD,Negrin RS,Schmidt-Woif IG.Activated T cells and cytokine-induced CD3+CD56+killer cells[J].Ann Hematol,1997,74(2):51-56.
22 张彤,任国平,张蕊.紫杉醇、奥沙利铂、氟尿嘧啶方案联合自体CIK细胞输注治疗Ⅳ期胃癌的疗效与安全性研究[J].中国全科医学,2012,15(7):2418.
23 Baker J,Verneris MR,Ito M,et al.Expansion of cytolytic CD8(+) natural killer T-cells with limited capacity for graft-versus-host disease induction due to interferon gamma production[J].Blood,2001,97(10): 2923-2931.
