颈部浅表无痛性肿大淋巴结的超声诊断与鉴别
2013-04-19李瑞芬张冬艳李晓庆李秀山赵海鹰
李瑞芬,张冬艳,李晓庆,黄 玮,邵 丹,李秀山,赵海鹰
颈部浅表淋巴结肿大在临床中非常多见,可表现为有痛性或无痛性,而无痛者更应引起医生的高度重视。虽然高频超声应用于颈浅淋巴结的疾病诊断已积累了大量经验,但淋巴结肿大的原因复杂多样,各种疾病间超声特征存在交叉,故在提高超声诊断符合率方面仍然存在着广阔的探索空间。本研究以颈部浅表无痛性肿大淋巴结患者为研究对象,结合病理检查结果,对肿大淋巴结的整体形态、内部回声、血流等超声检查结果进行回顾性分析,探讨超声在颈部浅表无痛性肿大淋巴结病因诊断和鉴别诊断中的应用价值。
1 资料与方法
1.1 病例入选标准 颈部浅表淋巴结肿大者,触诊为无痛性;超声检查前未经任何化疗和放疗;在多发者中选择体积最大或较大,趋于圆形,皮质明显增厚且回声减低,内部有钙化或液化,淋巴结门结构不清,内部血流丰富或分布紊乱,每例选取1~3个淋巴结。
1.2 一般资料 选取2006年11月—2010年10月我院收治的300例患者656个颈部浅表无痛性肿大淋巴结,均经手术或超声引导下粗针活检进行病理学诊断,部分病例跟踪随访6~12个月。患者年龄为13~88岁,平均47岁;男181例,女119例;按病理检查结果分为2组4类:良性组,包括反应性增生110例235个淋巴结,淋巴结结核25例60个淋巴结;恶性组,包括淋巴瘤67例155个淋巴结,淋巴结转移癌98例206个淋巴结。
1.3 仪器与方法 (1)使用Philips iU22和Siemens S 2000彩色超声诊断仪,线阵探头5~12 MHz。患者平卧,头略转向被检查侧对侧,充分暴露颈部。按1991年美国耳鼻喉头颈外科基金会颈部淋巴结分区Ⅰ~Ⅵ的顺序检查(Ⅶ区超声难以显示),两侧对称部位对比观察。(2)颈淋巴结分区标准:Ⅰ区包括颏下区和颌下区淋巴结;Ⅱ区为颈内静脉淋巴结上组;Ⅲ区为颈内静脉淋巴结中组;Ⅳ区为颈内静脉淋巴结下组;Ⅴ区为枕后三角区或副神经链淋巴结;Ⅵ区也称中央区或颈前区,包括环甲膜淋巴结、气管周围淋巴结、甲状腺周围淋巴结及喉返神经旁淋巴结。(3)超声观察内容:淋巴结的位置、形态、边界、是否融合、内部有无钙化和液化;最大切面的长径/短径(L/S)比值;皮、髓质改变情况;有无淋巴结门;内部血流模式,分为Ⅰ型无血流型、Ⅱ型淋巴结门型、Ⅲ中央型和Ⅳ边缘型;动脉收缩期速度(PSV)、阻力指数(RI)。根据上述观察内容并结合国内外公认的淋巴结异常诊断标准,将超声诊断结果分为肯定诊断、可疑诊断、不能诊断。

2 结果
2.1 超声诊断情况 300例患者656个肿大淋巴结经超声检查能肯定诊断508个(77.4%),可疑诊断94个(14.3%),不能诊断54个(8.3%)。508个能做出肯定诊断的淋巴结中,反应性增生、转移癌、淋巴瘤、淋巴结结核分别为213个(41.9%)、169个(33.3%)、98个(19.3%)、28个(5.5%),见表1。
表1 656个肿大淋巴结的超声诊断情况〔个(%)〕
Table1 Ultrasonic diagnosis of 656 enlargement lymph nodes
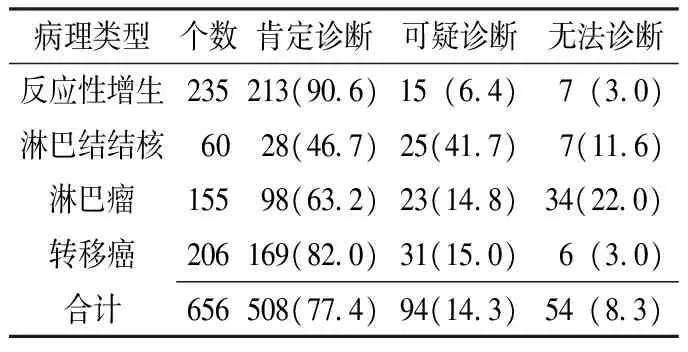
病理类型个数肯定诊断可疑诊断无法诊断反应性增生235213(90 6)15(6 4) 7(3 0) 淋巴结结核 60 28(46 7) 25(41 7) 7(11 6) 淋巴瘤155 98(63 2) 23(14 8)34(22 0)转移癌206169(82 0)31(15 0) 6(3 0) 合计656508(77 4)94(14 3)54(8 3)
2.2 超声测量参数比较 不同病理类型的肿大淋巴结短径、L/S比值、PSV、RI比较,差异均有统计学意义(P<0.01);其中反应性增生、淋巴结结核患者淋巴结短径与淋巴瘤、转移癌比较,差异均有统计学意义(P<0.05);4组患者淋巴结L/S比值组间两两比较,差异均有统计学意义(P<0.01);淋巴结结核、淋巴瘤、转移癌患者淋巴结PSV、RI与反应性增生患者比较,淋巴瘤、转移癌患者淋巴结PSV、RI与淋巴结结核患者比较,差异均有统计学意义(P<0.01,见表2)。
2.3 4种病变的主要特点 (1)反应性增生的病变多位于Ⅱ、Ⅲ区;以长径增大为主,短径变化较小,L/S比值>2;皮质可薄可厚,但均匀一致;皮、髓质分界清晰;淋巴结门居中,偶见融合(见图1);血流模式为Ⅰ型和Ⅱ型,动脉血流为低速低阻力型;可有慢性或反复的口腔或咽喉感染病史。(2)淋巴结结核,在颈部多个分区均可发生;长径和短径同时增大;可串珠样出现并融合;内部回声和血流类型多变并可同时检出;液化多见,偶见粗钙化;Ⅳ型血流为主。(3)淋巴瘤,短径增大明显,L/S比值<2,圆形及椭圆形多见;内部回声极低;髓质可消失或呈线状(见图2);内部血流极丰富,动脉血流呈高速高阻力型。(4)转移癌,短径增大,L/S比值<2,多数为类圆形和不规则型;淋巴结门消失或移位;皮质显著增厚;内部可为低回声、等回声或高回声;可发生液化和微钙化(见图3);内部血流紊乱、走形扭曲,动脉呈高速高阻力型(见表3)。

图1 超声检查显示淋巴结反应性增生(长径14.0 mm,短径3.9 mm,皮质厚度2.3 mm)
Figure1 Ultrasound showing reactive hyperplasia of lymph node(the long size 14.0 mm,the short size 3.9 mm,cortical thickness 2.3 mm)
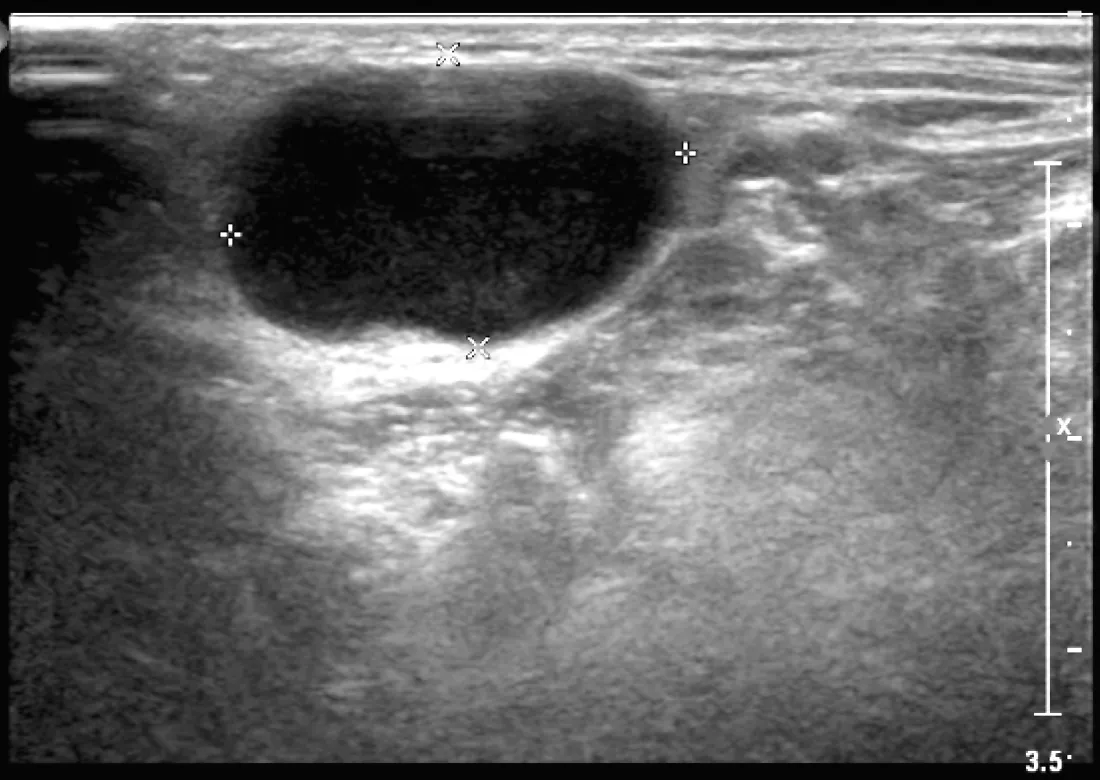
图2 超声检查显示淋巴瘤内部呈低回声,髓质消失(长径2.2 cm,短径1.4 cm)
Figure3 One lymphoma with low level echo without medulla(the long size 2.2 cm,the short size 1.4 cm)

图3 超声检查显示甲状腺左叶乳头状癌转移至同侧颈部淋巴结伴微钙化(长径34.0 mm,短径20.5 mm)
Figure3 Papillary carcinoma in left lobe of thyroid gland transferred to lymph node of left neck with micro calcification(the long size 34.0 mm,the short size 20.5 mm)

表2 656个肿大淋巴结超声测量参数比较Table 2 Parameters comparison of 656 enlargement lymph nodes
注:PSV=收缩期速度,RI=阻力指数;与反应性增生比较,*P<0.01,☆P<0.05;与淋巴结结核比较,△P<0.01;与淋巴瘤比较,▲P<0.01
表3 4种淋巴结病变的好发区域、结构及内部血流模式
Table3 Different predilection sites,structural changes and blood flow patterns of four types of lymph nodes diseases

病理类型好发区域形态皮质厚度髓质与周围分界血流模式反应性增生Ⅱ、Ⅲ长椭圆形、梭形均匀增宽清晰Ⅱ、Ⅰ淋巴结结核Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ椭球形、类圆形增厚不一致液化、粗钙化大部分不清晰Ⅳ、Ⅱ、Ⅲ淋巴瘤Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ类圆形显著增厚线状或消失清晰Ⅲ、Ⅳ、Ⅱ转移癌Ⅳ、Ⅲ、Ⅱ、Ⅴ类圆形、不规则不均匀增厚微钙化或液化大部分不清Ⅳ、Ⅲ、Ⅱ
3 讨论
Bruneton等[1]于1984年首次利用超声诊断鼻咽癌肿瘤和乳腺癌转移引起的颈部淋巴结肿大以来,国内外学者对于淋巴结病变做了大量研究和报道[2]。淋巴结肿大病因的多样性,颈部结构的复杂性,疾病所处的不同病理时期,异病间超声特征的交叉和重叠现象,操作者的经验和设备的分辨率影响,致使颈浅肿大淋巴结检出容易而定性困难,必须综合多方面特点才能达到不同的诊断层面。本研究中656个颈浅肿大淋巴结仅77.4%可做出肯定诊断,可疑诊断14.3%,不能诊断8.3%。在肯定诊断的肿大淋巴结中,疾病依次是反应性增生、转移癌、淋巴瘤和淋巴结结核。超声检查显示,反应性增生的淋巴结短径显著小于淋巴瘤及转移癌患者,且与淋巴结结核患者无显著差异;4类病理表现的淋巴结L/S比值间两两比较均有显著差异,提示淋巴结按照淋巴结结核、转移癌、淋巴瘤L/S比值减小的顺序趋向圆形发展,与反应性增生椭圆或梭形的形态相悖,差异增大;淋巴瘤、转移癌的淋巴结PSV、RI均显著高于反应性增生及淋巴结结核,说明恶性病变者动脉呈高速高阻力型。
3.1 超声诊断时应遵循的步骤 首先通过触诊和问诊确定是否有痛感,当为无痛性时,可除外淋巴结原发感染性病变,并把诊断引向最常见的4种疾病,即反应性增生、淋巴结结核、淋巴瘤、转移癌。其次,根据淋巴结的大小、形态、L/S比值(多数情况下良性淋巴结L/S比值>2,恶性淋巴结L/S比值≤2)、边界及血流类型大致拟为良、恶性,确立初步印象,再一步观察淋巴结内部回声、淋巴结门的有无、血流模式、动脉的PSV及RI,寻找最具特征性的信息。再次,结合临床表现和其他检查,这样可对大部分病例做出肯定诊断。
多数学者认为淋巴结内部出现干酪性坏死所致的液化和粗钙化、患者有肺结核病史和盗汗是淋巴结结核的主要依据[3]。皮质区回声极低、质均匀,血流自淋巴结门进入向四周呈“爪样”放射至皮质边缘[4],是淋巴瘤所特有的表现。皮质不均匀增厚,皮、髓质分界不清,与周围组织粘连,出现微钙化,血流丰富、紊乱、走形扭曲可作为转移癌的主要特征[5]。因为反应性增生在无痛性淋巴结中最多见,可发生在任何年龄,准确识别意义特别重大,能为临床提供极大帮助并减轻患者不必要的担心。这4种疾病之外尚存其他疾病可能,但未列入本研究范围之内。
3.2 导致可疑诊断或不能诊断的几个可重叠特征 淋巴结结核、淋巴瘤、转移癌的淋巴结皮质均可增厚、互相融合,且三者的淋巴结门均可移位或消失;淋巴结结核、转移癌血流模式于早期多为Ⅲ型,后期多为Ⅳ型,内部液化的概率较高[6];淋巴瘤、转移癌的L/S比值均≤2,而且二者动脉PSV、RI间无显著差异,均为高速高阻力型[7]。
3.3 在检查中要认识到不同病因肿大淋巴结存在的特殊情况 反应性增生可共存于淋巴结结核、淋巴瘤和转移癌之中;淋巴结非典型性的反应性增生偶见若干年后发展成淋巴瘤[2];转移性癌巢早期很小并局限在被膜下或皮质时,淋巴结门结构可完整,致恶性特征不典型[8-9];转移癌中发生坏死液化虽具有特征性,但极小时超声不能检出造成假阴性,而MRI却能检出直径<1.5 mm的坏死[5]。
综上所述,超声可作为颈浅肿大淋巴结诊断的首选方法,大多数能做出肯定诊断,但应强调良好的操作和思维习惯。不能以单一指标来定性,在检查前必须问诊、触诊,仔细询问病史、体征,遵循一定顺序检查(如按颈部分区),二维和彩色多普勒兼顾,努力寻找最具特征性的指标;同时应注重对照和扩大区域检查,包括同侧异常淋巴结之外区域、对侧和颈部浅表器官(如甲状腺、腮腺)以及乳腺、肝、脾等器官,这将对提高肯定诊断的符合率大有裨益。有疑虑者可结合CT、MRI等检查,必要时进行组织细胞学穿刺活检。
1 Bruneton JN,Roux P,Caramella E,et al.Ear,nose and throat cancer:ultrasound diagnosis of metastasis to cervical lymph nodes[J].Radiology,1984,152(3):771-773.
2 张缙熙,姜玉新.浅表器官及组织超声诊断学[M].2版.北京:科学技术文献出版社,2009:288-308.
3 王利英,王涌,秦茜淼,等.超声在淋巴结诊断中的应用[J].上海医学影像,2007,16(3):258-261.
4 蔡艳,卫月,黄颖,等.高频彩色多普勒超声在诊断颈部淋巴结转移癌性与淋巴瘤性淋巴结中的应用价值[J].中国医学影像技术,2008(增刊):66-68.
5 唐敏,曹礼庭.颈部恶性淋巴结肿大的超声诊断[J].川北医学院学报,2009,24(1):73-77.
6 徐仁艳,孙红光.彩色多普勒超声对颈部淋巴结病变的诊断价值[J].吉林医学,2009,30(19):2241-2242.
7 Esen G.Ultrasound of superficial lymph nodes[J].Eur J Radiol,2006,58(3):345-359.
8 Ahuja AT,Ying M.Sonographic evaluation of cervical lymph nodes[J].AJR,2005,184(5):1691-1699.
9 于天宇.颈部淋巴结转移的影像学研究进展[J].中国卫生工程学,2010,12(9):70-71.
