小鼠巨噬细胞内表达结核分枝杆菌CFP10-ESAT6融合蛋白对细胞增殖和凋亡的影响*
2013-04-13王山梅
任 琳, 李 轶, 王山梅, 师 娟, 郭 思
(河南省人民医院感染控制科,细菌室,河南 郑州 450000)
结核分枝杆菌是一种典型的胞内致病菌,可以通过多种不同的机制逃逸机体免疫细胞的杀伤及清除,从而在宿主细胞内进行复制和繁殖,并长期存活于机体内。有证据显示宿主可以通过诱导受感染巨噬细胞的凋亡来抑制胞内结核分枝杆菌的生长[1-2]。进一步的研究表明分枝杆菌毒力株抑制受感染巨噬细胞凋亡的能力要强于分枝杆菌减毒株[3-4]。 比较基因组学分析揭示了结核分枝杆菌中的差异区段1(region of difference 1, RD1)在所有的卡介苗菌株(bacillus Calmette-Guerin,BCG)中是缺失的。相反,RD1存在于结核分枝杆菌和牛分枝杆菌毒力株中[5]。其中,培养滤液蛋白10(culture filtrate protein 10, CFP10)和早期分泌性抗原靶6(early secretory antigenic target 6, ESAT6)是由RD1区的Rv3874和Rv3875两个基因分别编码的分泌性蛋白,研究发现CFP10和ESAT6对结核分枝杆菌的毒力起着重要的作用。有实验证实把CFP10和ESAT6重组到BCG中能使BCG的毒力和免疫性增强[6-8],但其对宿主巨噬细胞凋亡的影响以及相应的毒力机制并未完全阐述清楚。本研究从结核分枝杆菌H37RV株中克隆CFP10-ESAT6基因,将其重组于真核表达质粒pEGFP-N1中,并将重组质粒转染到RAW264.7巨噬细胞中,检测细胞内表达CFP10-ESAT6对巨噬细胞毒性以及凋亡的影响,探讨CFP10-ESAT6融合蛋白在结核分枝杆菌毒力中所起到的作用及其可能机制。
材 料 和 方 法
1材料
1.1基因组、质粒和细胞结核分枝杆菌H37Rv基因组DNA由河南省人民医院中心实验室保存。真核表达质粒pEGFP-N1购自Clontech。RAW264.7小鼠巨噬细胞株,由郑州大学病理生理学实验室提供。
1.2主要试剂质粒提取试剂盒和PCR清洁回收试剂盒(Omega);PCR试剂盒、DNA连接试剂盒和DNA marker (TaKaRa);限制性内切酶EcoRⅠ和HindⅢ (Fermentas);Annexin V-FITC/PI双染凋亡检测试剂盒(BestBio);转染试剂Lipofectamine 2000(Invitrogen);十字孢碱、氨苄青霉素和新霉素(Merck);鼠抗GFP单克隆抗体(Sigma);羊抗鼠IgG-HRP(Santa Cruz);FITC标记抗小鼠Toll样受体2(Toll-like receptor 2, TLR2)(Biolegend);结核分枝杆菌19 kD脂蛋白由河南省人民医院中心实验室提供;其余常规试剂均为国产或进口分析纯产品。
2方法
2.1CFP10/ESAT6融合基因PCR扩增及真核表达质粒的构建根据GenBank中结核分枝杆菌H37Rv株CFP10和ESAT6基因序列设计引物。上游和下游引物分别引入EcoRⅠ和HindⅢ酶切位点。CFP10基因上游引物P1: 5’-GC AAGCTT ATG GCA GAG ATG AAG ACC-3’;CFP10基因下游引物P2:5’-GCT GCC GCC ACC GCC GGA TCC GCC ACC GCC GCT TCC ACC GCC ACC GAA GCC CAT TTG CGA GGA C-3’;ESAT6基因上游引物P3:5’-GGT GGC GGT GGA AGC GGC GGT GGC GGA TCC GGC GGT GGC GGC AGC ATG ACA GAG CAG CAG TGG AAT - 3’;ESAT6基因下游引物P4:5’TA GAATTC CTA TGC GAA CAT CCC AGT G- 3’(划线部分分别是HindⅢ和EcoRⅠ酶切位点,引物由Invitrogen合成)。以结核分枝杆菌H37Rv株全基因组DNA为模板,分别以引物P1/P2和P3/P4进行第1轮PCR扩增,获得下游带有中间接头序列的CFP10基因和上游带有中间接头序列的ESAT6基因。PCR扩增体系为:H2O 32.5 μL,5×PrimeSTAR® Buffer(Mg2+plus)10 μL,dNTP Mixture(各2.5 mmol/L)4 μL,引物P1/P2或P3/P4(20 μmol/L)各1μL,结核分枝杆菌基因组DNA 1 μL,PrimeSTAR®HS 0.5 μL。反应参数为:94 ℃预变性4 min,98 ℃ 变性10 s,60 ℃ 退火45 s,72 ℃延伸30 s,30个循环后72 ℃延伸2 min。反应结束后取5 μL扩增产物用0.7%琼脂糖凝胶电泳检测结果。然后再以CFP10和ESAT6基因PCR产物为模板,以引物P1/P4进行第2轮PCR扩增,获得由中间接头序列连接的CFP10-ESAT6融合基因。PCR扩增体系为:H2O 31.5 μL,5×PrimeSTAR® Buffer(Mg2+plus)10 μL,dNTP Mixture(各2.5 mmol/L)4 μL,引物P1/P4(20 μmol/L)各1 μL,CFP10和ESAT6基因PCR扩增产物各1 μL,PrimeSTAR® HS 0.5 μL,总体积为50μL。CFP10-ESAT6融合基因与质粒pEGFP-N1分别用限制性内切酶HindⅢ和EcoRⅠ酶切,纯化。CFP10-ESAT6融合基因与pEGFP-N1质粒以摩尔比10∶1比例混合,用DNA连接试剂进行连接反应,转化DH5α感受态细胞,铺板过夜培养,随即挑取转化菌落于LB培养基振荡培养,提取质粒DNA,做双酶切和PCR鉴定,以上鉴定正确的阳性克隆送大连TaKaRa生物技术有限公司测序。
2.2重组质粒pEGFP-N1/CFP10-ESAT6的转染及鉴定使用脂质体法将重组质粒pEGFP-N1/CFP10-ESAT6转染RAW264.7小鼠巨噬细胞,以构建稳定表达CFP10-ESAT6的RAW264.7小鼠巨噬细胞系。将RAW264.7小鼠巨噬细胞传代至6孔细胞培养板,当细胞生长处于90%的汇合率时进行转染。用无菌EP管中制备溶液1:取脂质体10 μL加入到240 μL无血清无抗生素DMEM培养基中;溶液2:取4 μg重组质粒,加入到无血清无抗生素的DMEM培养液250 μL。将溶液1与溶液2混合,在室温下孵育20 min。用无血清无抗生素DMEM培养液洗6孔板2次,加入2 mL无血清无抗生素DMEM培养液,将重组质粒/脂质体混合液加入培养孔内,摇动培养板,轻轻混匀,设重组质粒/脂质体组和空白对照组。在37 ℃、5%CO2培养箱中培养6 h,更换含有血清的完全培养基。细胞培养24 h后,去掉培养基,用PBS洗板1次,加入按最佳筛选浓度配制的新霉素(G418)筛选培养基。筛选14 d后,可见有抗性的克隆生长,停药培养,挑选单克隆,Western blotting鉴定CFP10-ESAT6融合蛋白的表达。
2.3转染细胞中CFP10-ESAT6融合蛋白表达水平的鉴定收集经过G418筛选的RAW264.7小鼠巨噬细胞,常规提取总蛋白,BCA比色法测定蛋白浓度,进行SDS-PAGE,转膜,5%脱脂奶粉封闭,依次加入Ⅰ抗(抗GFP抗体)4 ℃孵育过夜,TBST洗膜,Ⅱ抗(HRP标记的羊抗小鼠IgG)室温孵育2 h,TBST洗膜,暗室加入ECL液孵育5 min,使用凝胶成像系统观察CFP10-ESAT6融合蛋白的表达情况。
2.4细胞增殖活性检测设空白对照组、pEGFP-N1组和pEGFP-N1/CFP10-ESAT6组,每组各5孔,每孔按细胞数5×103接种于96孔板,然后分别于12、24、48和72 h在每孔中各加入20 μL MTT液,培养4 h,弃去上清,再加入200 μL DMSO,充分振荡10 min。最后分别检测3组各时点的吸光度(A490)并重复3次。
2.5Annexin Ⅴ-FITC/PI双染法流式细胞术检测细胞凋亡设空白对照组、pEGFP-N1组和pEGFP-N1/CFP10-ESAT6组,将各组细胞接种至6孔板中(1×106cells/well),培养24 h后,离心收集细胞,用冷PBS洗涤细胞2次,然后用400 μL 1×binding buffer 悬浮细胞,浓度大约为1×109cells/L,在细胞悬浮液中加入5 μL Annexin Ⅴ-FITC,轻轻混匀后于2~8 ℃避光条件下孵育15 min,最后加入10 μL PI后轻轻混匀于2~8 ℃避光条件下孵育5 min。1 h内用流式细胞仪检测各组细胞凋亡情况。使用十字孢碱和结核分枝杆菌19 kD脂蛋白,终浓度分别为1 μmol/L和10 mg/L作用于3组细胞,细胞继续培养72 h,然后按照Annexin Ⅴ-FITC/PI双染凋亡法检测样本各时点的凋亡情况。
2.6流式细胞术检测RAW264.7小鼠巨噬细胞表面TLR2的表达 收集上述各组细胞,1 500 r/min离心5 min,然后用200 μL PBS重悬,重复洗3次,加入FITC标记的抗鼠TLR2Ⅰ抗(1∶1 000)在4 ℃孵育30 min,用PBS洗2次,再用PBS重悬细胞密度为106cells∶300 μL, 然后上流式细胞仪(Beckman Coulter)检测细胞凋亡率,CellQuest软件分析。
3统计学处理
数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1结核分枝杆菌CFP10-ESAT6融合基因PCR扩增及重组质粒的构建
以结核分枝杆菌H37Rv株全基因组为模板,通过PCR扩增出约650 bp左右的特异性片段,与预期的大小一致。限制性内切酶HindⅢ和EcoRⅠ双酶切重组质粒显示该重组质粒含有约650 bp片段。测序结果与GenBank数据库中CFP10和ESAT6基因完全匹配,表明重组质粒构建成功,见图1。

Figure 1. PCR products ofCFP10-ESAT6 gene and analysis of recombinant plasmid pEGFP-N1/CFP10-ESAT6. M: DNA marker; 1: PCR product ofCFP10-ESAT6 gene inMycobacteriumtuberculosis; 2: recombinant pEGFP-N1/CFP10-ESAT6; 3: recombinant pEGFP-N1/CFP10-ESAT6 digested withHindⅢ andEcoR Ⅰ.
图1PCR扩增结核分枝杆菌CFP10-ESAT6融合基因及重组质粒pEGFP-N1/CFP10-ESAT6的鉴定
2重组质粒转染RAW264.7小鼠巨噬细胞中CFP10-ESAT6的表达
使用脂质体转染法将重组质粒pEGFP-N1/CFP10-ESAT6转染至靶细胞RAW264.7小鼠巨噬细胞中,以构建稳定表达CFP10-ESAT6的小鼠巨噬细胞系。用新霉素筛选转染的小鼠巨噬细胞,经有限稀释法单克隆化,连续传代培养后,分别选取稳定转染pEGFP-N1和pEGFP-N1/ CFP10-ESAT6的细胞扩大培养,在倒置荧光显微镜下观察细胞呈绿色荧光,传代10次以上,EGFP仍有80%的阳性率,这些阳性细胞被认为可以稳定表达目的基因。免疫印迹分析表明,含重组质粒的细胞在约43 kD处出现明显条带,空质粒细胞蛋白在27 kD处出现条带,见图2。
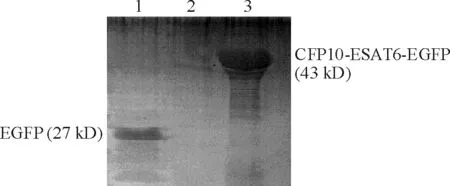
Figure 2. Expression of CFP10-ESAT6-EGFP recombinant protein in stable transfected RAW264.7 mouse macrophages. 1: pEGFP-N1 transfected cells; 2: normal cells; 3: pEGFP-N1/CFP10-ESAT6 transfected cells.
图2CFP10-ESAT6-EGFP重组蛋白在稳定转染RAW264.7巨噬细胞中的表达
3细胞内表达CFP10-ESAT6融合蛋白对RAW264.7小鼠巨噬细胞增殖活性的影响
MTT检测结果表明,与空质粒组和空白对照相比,重组质粒细胞在不同时点吸光度并没有明显变化,见图3。这一结果表明在RAW264.7小鼠巨噬细胞内表达的CFP10-ESAT6融合蛋白对细胞并没有毒性作用。
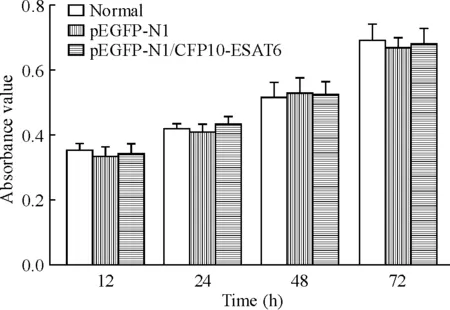
Figure 3. Viability of macrophages transfected with CFP10-ESAT6 assessed by MTT. Mean±SD.n=3.
图3MTT法检测CFP10-ESAT6转染巨噬细胞后细胞的增殖活性
4细胞内表达CFP10-ESAT6融合蛋白对RAW264.7小鼠巨噬细胞抗凋亡的影响
为了检测细胞内表达的CFP10-ESAT6融合蛋白是否能够抑制巨噬细胞的凋亡,本实验使用结核分枝杆菌19 kD脂蛋白和十字孢碱分别作用于空白对照细胞、空质粒细胞和重组细胞。当使用结核分枝杆菌19 kD脂蛋白作用于细胞时,结果显示重组细胞的凋亡率要小于空白对照组和空质粒组,十字孢碱作用于细胞72 h,3组细胞的凋亡率随着时间的延长而增加,与空白对照细胞和空质粒细胞相比,重组细胞的凋亡率变化并没有显著差异,见图4、5。这一结果表明胞内表达的CFP10-ESAT6融合蛋白并不能抑制十字孢碱所造成的细胞凋亡,但能够抑制结核分枝杆菌19 kD脂蛋白所造成的凋亡。

Figure 4. Effect ofMycobacteriumtuberculosis19 kD lipoprotein on the apoptosis of macrophages transfected with CFP10-ESAT6. Mean±SD.n=3.*P< 0.05vsnormal.
图4结核分枝杆菌19kD脂蛋白对转染CFP10-ESAT6巨噬细胞凋亡的影响

Figure 5. Effect of staurosporine on the apoptosis of macrophages transfected with CFP10-ESAT6.Mean±SD.n=3.
图5十字孢碱对转染CFP10-ESAT6巨噬细胞凋亡的影响
5细胞内表达CFP10-ESAT6融合蛋白对巨噬细胞TLR2表达的影响
本实验进一步检测CFP10-ESAT6融合蛋白是否能调控结核分枝杆菌19 kD脂蛋白受体TLR2的表达。流式细胞术证实了pEGFP-N1/CFP10-ESAT6细胞组在培养24 h、48 h和72 h后,重组质粒细胞的平均荧光强度明显低于空质粒组和空白对照组,差异显著(P<0.05),见图6。

Figure 6. Effect ofMycobacteriumtuberculosis19 kD lipoprotein on TLR2 expression in macrophages transfected with CFP10-ESAT6. The TLR2 expression of macrophages transfected with CFP10-ESAT6 decreased in a time-dependent manner. Mean±SD.n=3.*P<0.05vsnormal.
图6结核分枝杆菌19kD脂蛋白对转染CFP10-ESAT6巨噬细胞TLR2表达的影响
讨 论
结核分枝杆菌是典型的胞内寄生菌,感染巨噬细胞后,结核分枝杆菌能在受感染的宿主细胞中增殖和存活。机体在遭遇到病原微生物感染后诱导受感染细胞死亡或凋亡是宿主先天性免疫反应的一部分[9],受感染细胞的死亡是机体的一个重要防御机制,这种机制有利于保护其它未受感染的细胞。有研究报道称宿主巨噬细胞的凋亡能够减少分枝杆菌的生存能力,是机体抗结核菌胞内感染中先天性免疫反应中的一部分[10-12]。另一方面,有若干研究证实了结核分枝杆菌毒力株能够抑制宿主巨噬细胞的凋亡。总之,结核分枝杆菌和宿主巨噬细胞间的相互作用是结核发病机制的关键因素,宿主试图感知细胞内的病原体并诱导感染细胞死亡而病原体则隐藏在宿主细胞内抑制其死亡。
有研究表明分枝杆菌减毒株(BCG, H37Ra)所造成的巨噬细胞凋亡率要明显高于分枝杆菌毒力株(Mtb-H37Rv,M.bovis)[13]。由于细胞的死亡能够减弱分枝杆菌的生存能力,所以结核分枝杆菌抑制巨噬细胞凋亡的能力被认为是结核菌的一个致病毒力因素。基因组学分析揭示了结核分枝杆菌RD1在BCG中是缺失的,相反,RD1基因片段存在于结核分枝杆菌和牛分枝杆菌毒力株中。RD1基因区段中的CFP10和ESAT6基因作为结核分枝杆菌的重要分泌性抗原,与分枝杆菌的毒力和免疫性密切相关。因此CFP10和ESAT6在结核分枝杆菌和巨噬细胞相互作用的过程中是否具有毒性以及在凋亡中所起到的作用是个值得探讨的重要问题。
本研究通过构建pEGFP-N1/CFP10-ESAT6真核表达质粒稳定转染后可在荧光显微镜下观察到绿色荧光的表达,免疫印迹分析显示CFP10-ESAT6融合基因得以表达,表明构建的质粒转染巨噬细胞成功。本实验通过MTT和流式细胞术的方法检测巨噬细胞内表达的CFP10-ESAT6融合蛋白对巨噬细胞增殖以及凋亡的影响。本研究发现,以不同时点检测重组质粒巨噬细胞的增殖情况,其MTT吸光度和空白质粒组、空白对照组相比并没有明显变化。实验结果表明,巨噬细胞内表达的CFP10-ESAT6融合蛋白没有造成宿主巨噬细胞的损伤和死亡,其本身不具有细胞毒作用。本实验进一步研究了胞内表达CFP10-ESAT6是否能够抑制巨噬细胞的凋亡,使用结核分枝杆菌19 kD脂蛋白和非受体依赖的线粒体途径凋亡诱导剂十字孢碱处理上述各组细胞。我们发现随着时间的延长十字孢碱处理的各组细胞,其凋亡率都在增加,而且重组质粒细胞组和其它2组细胞相比凋亡率并没有明显差异。用结核分枝杆菌19 kD脂蛋白处理上述各组细胞,细胞同样随着时间的延长凋亡率在增加,但在24、48和72 h时点,pEGFP-N1/CFP10-ESAT6细胞组的凋亡率要低于其它2组并有明显差异。上述结果表明胞内表达的CFP10-ESAT6不能改变十字孢碱所造成的凋亡,但可以抑制结核分枝杆菌19 kD脂蛋白所造成的凋亡。目前所知有两种途径可以导致细胞的凋亡:通过Fas等死亡受体与相应配体结合所介导的细胞外途径和促凋亡/抗凋亡蛋白所控制所介导的线粒体途径 。本实验用的2种凋亡诱导剂,十字孢碱是蛋白激酶C抑制剂,能够通过胞内途径诱导细胞的凋亡,结核分枝杆菌19 kD脂蛋白是巨噬细胞TLR2的配体,同样能够诱导巨噬细胞的凋亡[14-15]。上述结果提示了结核分枝杆菌CFP10-ESAT6融合蛋白在巨噬细胞内的表达能够通过细胞外受体途径保护巨噬细胞免受凋亡,而不是线粒体途径。本实验进一步检测了重组质粒细胞TLR2的表达水平,流式细胞术证实了重组质粒细胞TLR2的表达水平要低于空质粒组和空白对照组,差异显著并且其TLR2受体表达水平的下降具有时间依赖性。以上结果表明巨噬细胞内表达CFP10-ESAT6融合蛋白能够抑制结核分枝杆菌19 kD脂蛋白所造成的凋亡,这一作用是通过下调巨噬细胞表面TLR2受体来实现的。
总之,本研究探讨了细胞内表达CFP10-ESAT6融合蛋白对RAW264.7巨噬细胞的毒性作用,该结核分枝杆菌分泌性蛋白本身不会改变巨噬细胞的活性,但该分泌性融合蛋白在细胞内能够下调TLR2的表达,进而抑制了结核分枝杆菌19 kD脂蛋白所诱导的细胞凋亡,结果提示了作为早期分泌性抗原,该融合蛋白可能通过细胞外受体途径抑制宿主细胞的凋亡从而有助于胞内结核分枝杆菌的存活和增殖。由于在结核病人体内宿主巨噬细胞功能的调节是非常复杂的,所以我们需要进一步研究结核分枝杆菌分泌性蛋白CFP10-ESAT6在体内对巨噬细胞功能的影响,以便于透彻地掌握结核病的发病机制。
[参考文献]
[1]Riendeau CJ, Kornfeld H. THP-1 cell apoptosis in response to mycobacterial infection [J]. Infect Immun, 2003, 71(1): 254-259.
[2]Sly LM, Hingley-Wilson SM, Reiner NE, et al. Survival ofMycobacteriumtuberculosisin host macrophages involves resistance to apoptosis dependent upon induction of antiapoptotic Bcl-2 family member Mcl-1[J]. J Immunol, 2003, 170(1): 430-437.
[3]Dhiman R, Raje M, Majumdar S. Differential expression of NF-κB in mycobacteria infected THP-1 affects apoptosis [J]. Biochim Biophys Acta, 2007, 1770(4): 649-658.
[4]Zhang J, Jiang R, Takayama H, et al. Survival of virulentMycobacteriumtuberculosisinvolves preventing apoptosis induced by Bcl-2 upregulation and release resulting from necrosis in J774 macrophages [J]. Microbiol Immunol, 2005, 49(9): 845-852.
[5]Behr MA, Wilson MA, Gill WP, et al. Comparative genomics of BCG vaccines by whole-genome DNA microarray [J]. Science, 1999, 284(5419):1520-1523.
[6]Pym AS, Brodin P, Brosch R, et al. Loss of RD1 contributed to the attenuation of the live tuberculosis vaccinesMycobacteriumbovisBCG andMycobacteriummicroti[J]. Mol Microbiol, 2002, 46(3): 709-717.
[7]Lewis KN, Liao R, Guinn KM, et al. Deletion of RD1 fromMycobacteriumtuberculosismimics bacilli Calmette-Guérin attenuation [J]. J Infect Dis, 2003, 187(1): 117-123.
[8]Pym AS, Brodin P, Majlessi L, et al. Recombinant BCG exporting ESAT-6 confers enhanced protection against tuberculosis [J]. Nat Med, 2003, 9(5): 533-539.
[9]Iriti M, Faoro F. Review of innate and specific immunity in plants and animals [J]. Mycopathologia, 2007, 164(2): 57-64.
[10] Molloy A, Laochumroonvorapong P, Kaplan G. Apoptosis, but not necrosis, of infected monocytes is coupled with killing of intracellular bacillus Calmette-Guerin [J]. J Exp Med, 1994, 180(4): 1499-1509.
[11] Fratazzi C, Arbeit RD, Carini C, et al. Programmed cell death ofMycobacteriumaviumserovar 4-infected human macrophages prevents the mycobacteria from spreading and induces mycobacterial growth inhibition by freshly added, uninfected macrophages [J]. J Immunol, 1997, 158(9): 4320-4327.
[12] Keane J, Shurtleff B, Kornfeld H. TNF-dependent BALB/c murine macrophage apoptosis followingMycobacteriumtuberculosisinfection inhibits bacillary growth in an IFN-γ independent manner [J]. Tuberculosis (Edinb), 2002, 82(2-3): 55-61.
[13] Keane J, Remold HG, Kornfled H. VirulentMycobacteriumtuberculosisstrains evade apoptosis of infected alveolar macrophage [J]. J Immunol, 2000, 164(4): 2016-2020.
[14] 朱兰卉,李冯锐,周懿舒,等. 细胞凋亡途径中HIPPI的潜在调节作用[J]. 中国病理生理杂志,2013, 29(6): 1136-1141.
[15] López M, Sly LM, Luu Y, et al. The 19-KDaMycobacteriumtuberculosisprotein induces macrophage apoptosis through Toll-like receptor-2 [J]. J Immunol, 2003, 170(5): 2409-2416.
