缓激肽对TGF-β1诱导的猪肺动脉平滑肌细胞增殖的影响*
2013-04-13冯文静徐西振赵俊杰董若兰姚济华
冯文静, 徐西振, 赵 刚, 赵俊杰, 董若兰, 凃 玲△, 姚济华△
(华中科技大学同济医学院附属同济医院 1老年医学科, 2心内科, 湖北 武汉 430030;3山东大学附属省立医院心内科,山东 济南 250021)
肺动脉高压(pulmonary artery hypertension,PAH)是一类严重的进展性疾病,其主要特征是肺血管阻力进行性升高,持续发展可导致患者右心衰竭而死亡[1]。肺血管重构是肺血管阻力进行性升高的重要病理生理基础,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)增殖导致了肺动脉中膜的肥厚和肌化,进而导致肺部毛细血管前动脉闭塞和肺动脉压力持续升高[2]。研究表明,转化生长因子β1(transforming growth factor β1, TGF-β1)能刺激血管平滑肌细胞过度增殖,促进肺血管重构的发生和发展[3]。
缓激肽(bradykinin, BK)是一种血管活性九肽,通过自分泌-旁分泌机制释放,与受体结合后发挥扩张血管、降低血压、增加局部血流、调节平滑肌松弛和收缩、增加血管通透性等多种生物学效应[4]。研究表明,激肽释放酶通过增加BK水平从而抑制血小板源性生长因子诱导的大鼠主动脉平滑肌细胞的增殖[5],然而,BK是否能抑制TGF-β1诱导的PASMCs增殖及其可能的分子机制尚不清楚。因此,本研究聚焦于肺血管重构的病理生理机制,旨在探讨BK对TGF-β1诱导的PASMCs增殖的影响,为临床肺血管重构的治疗提供新的理论依据。
材 料 和 方 法
1材料
1.1主要试剂 猪肺动脉购自武汉市血清制品厂,胎牛血清(fetal bovine serum,FBS)、DMEM培养基和胰酶购自HyClone。PASMCs培养于含有10%胎牛血清、0.146 g/L L-谷氨酰胺、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基。缓激肽、TGF-β1和缓激肽2型受体(bradykinin type 2 receptor, B2R)抑制剂HOE-140购自Sigma。细胞增殖/毒性检测试剂盒(Cell Counting Kit-8, CCK-8)试剂盒和牛血清白蛋白(bovine serum albumin, BSA)购自碧云天生物技术研究所,BCA蛋白定量试剂盒购自武汉博士德生物工程有限公司。兔抗磷脂酰肌醇3-激酶 (phosphatidylinositol 3-kinase, PI3K) 抗体购自Cell Signaling Technology,小鼠抗β- actin抗体、小鼠抗磷酸化细胞外信号调节激酶1/2 (phosphoylated extracellular signal-regulated kinase 1/2, p-ERK1/2) 抗体、兔抗ERK1/2抗体、兔抗蛋白激酶B (protein kinase B, PKB/Akt)抗体和兔抗p-Akt抗体购自Santa Cruz。辣根过氧化物酶标记山羊抗兔、山羊抗小鼠 IgG抗体购自 Jackson Immuno Research Lab。Western blotting化学发光试剂购自Pierce Biotechnology,PVDF膜购自Life Science,其余试剂为国产分析纯试剂。
1.2仪器Western blotting设备(Bio-Rad),凝胶成像系统Gene Genius Bio Imaging System(Synegene),微量紫外分光光度计(Bio-Rad),超净工作台(杭州),CO2培养箱(Forma)。
2方法
2.1PASMCs原代培养与鉴定 无菌操作下取猪肺动脉,分离肺组织中的3~4级肺小动脉,按照文献所述的方法进行培养和传代[6-7],在倒置相差显微镜下,PASMCs融合呈梭形重叠生长,呈现典型的“谷与峰”样特征。免疫荧光染色显示抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)阳性,细胞纯度在95%以上,实验采用第2~6代细胞进行。
2.2实验分组培养板中的细胞随机分为对照组、溶媒组、BK(10-5mol/L)组、TGF-β1(2 μg/L、5 μg/L和10 μg/L)组、TGF-β1+ HOE-140组、TGF-β1+BK组以及TGF-β1+BK+HOE-140组。细胞生长至60%~70%汇合时,换含0.4%FBS的DMEM培养基同步化处理12 h,换用新鲜DMEM培养基进行相应的干预处理。为研究可能的信号转导机制,给予BK(10-5mol/L)前1 h加用HOE-140(10-5mol/L),BK干预作用30 min后,加入TGF-β1,继续孵育24 h,进行CCK-8检测细胞增殖情况或者提取相应的蛋白质进行后续分析。实验至少重复3次。
2.3细胞活性检测细胞活性检测按文献所述的方法[8],用CCK-8试剂盒检测细胞的增殖情况。用0.02% EDTA-0.25%胰蛋白酶消化细胞培养瓶中处于对数生长期的PASMCs至单个细胞悬液并接种于96孔板,每孔100 μL,按上述分组和干预方法给药,每组设5个复孔。实验结束后,每孔加入10 μL CCK-8溶液(避光),置于37 ℃细胞培养箱孵育1 h后在自动酶标仪上测定490 nm处吸光度(A490)。
2.4Western blotting检测相关蛋白质的表达Western blotting按文献方法[9]进行,细胞干预结束后用预冷的1×PBS洗2次,6孔板每孔加入三去污细胞裂解液(50 mmol/L Tris-HCl, pH 8.0, 150 mmol/L NaCl, 0.2 g/L NaN3, 1 g/L SDS, 100 mg/L aproti-nin, 10 g/L NP-40, 5 g/L去氧胆酸钠, 100 mg/L PMSF)100 μL裂解细胞。用BCA蛋白定量试剂盒测定细胞蛋白浓度。取等量蛋白质加入6×loading buffer煮沸5 min,冰上静置4 min上样, SDS-聚丙烯酰胺凝胶电泳分离蛋白质,将分离开的蛋白质转至PVDF膜上,室温封闭2.5 h,相应Ⅰ抗4 ℃孵育过夜,第2天室温下TBS-T洗涤Ⅰ抗1 h,加入相应的辣根过氧化物酶标记的Ⅱ抗,室温孵育2.5 h,TBS-T洗涤1 h,ECL试剂显影,曝光,最后用凝胶成像分析系统灰度扫描定量各组蛋白质的表达量。
3统计学处理
数据以均数±标准差(mean±SD)表示,各组间差异显著性比较应用统计软件SPSS 13.0进行One-way ANOVA后,两两比较采用Student-Newman-Keuls检验,以P<0.05为差异有统计学意义。
结 果
1PASMCs形态及鉴定
肺动脉中膜组织块移植于培养瓶后,培养5~7 d可见少量细胞从组织块边缘爬出,细胞呈不规则多角形,并逐渐伸展成梭形或长梭形。部分区域可见PASMCs融合呈梭形重叠生长,呈现典型的“谷与峰”样特征。免疫荧光染色结果见图1,95%以上细胞抗α-SMA阳性,胞浆显示绿色荧光标记的肌动蛋白结构,胞核呈椭圆形位于细胞中央被染成蓝色。
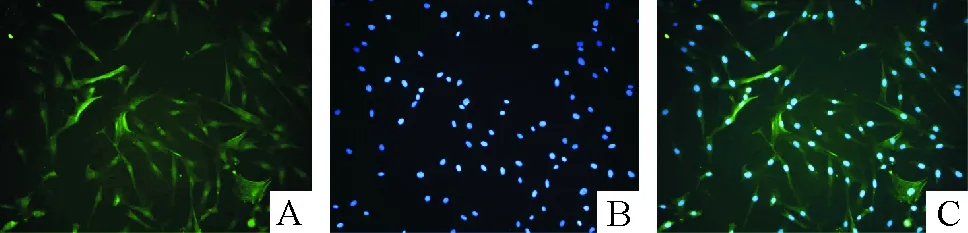
Figure 1. Immunofluorescence staining of PASMCs (×200). A: cytoplasmic positive staining for α-SMA; B: nucleus; C: merged image.
图1PASMCs免疫荧光染色
2TGF-β1呈剂量依赖性地促进PASMCs增殖
TGF-β1(2 μg/L、5 μg/L和10 μg/L)刺激PASMCs 24 h后进行CCK-8检测,结果见图2。与对照组和溶媒组相比较,TGF-β1(2 μg/L)组对PASMCs增殖无明显影响,而TGF-β1(5 μg/L)组与TGF-β1(10 μg/L)组显著促进了PASMCs增殖(P<0.05),并且以TGF-β1(10 μg/L)组更为显著,因此后续实验采用TGF-β1(10 μg/L)进行。这些实验结果提示TGF-β1呈剂量依赖性地促进PASMCs增殖。
3BK通过B2R抑制TGF-β1诱导的PASMCs增殖
PASMCs接受TGF-β1刺激时分别合用BK与B2R抑制剂HOE-140,CCK-8检测它们对TGF-β1诱导的PASMCs增殖的影响,结果见图3。与对照组和溶媒组相比较,单独应用BK (10-5mol/L) 对PASMCs的增殖作用没有显著影响(P>0.05),TGF-β1(10 μg/L)可以显著促进PASMCs增殖(P<0.05)。与TGF-β1组相比较,TGF-β1+BK组显著抑制了TGF-β1诱导的PASMCs增殖(P<0.05)。而合用B2R抑制剂HOE-140 (10-5mol/L) 后,BK抑制TGF-β1诱导的PASMCs增殖作用显著降低(P<0.05)。这些数据说明BK通过B2R调节TGF-β1诱导的PASMCs增殖作用。
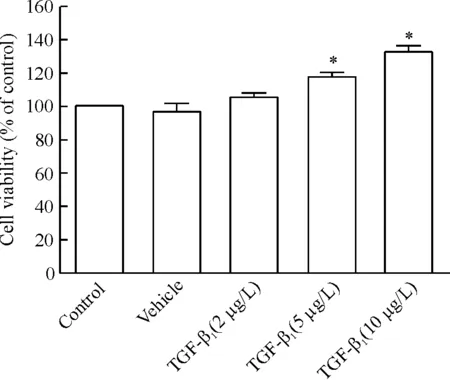
Figure 2. Effects of different concentrations of TGF-β1on the proliferation of PASMCs.Mean±SD.n=5.*P<0.05vscontrol group or vehicle group.
图2不同浓度TGF-β1处理对PASMCs增殖的影响
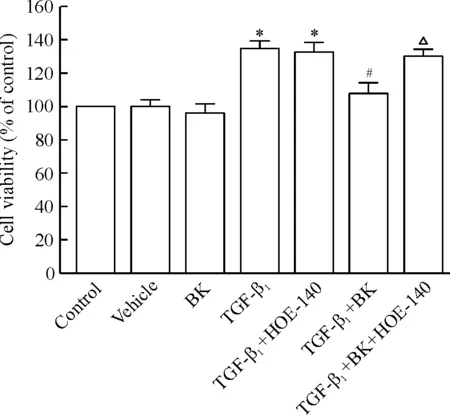
Figure 3. Effect of bradykinin (BK) on the proliferation of PASMCs induced by TGF-β1.Mean±SD.n=3.*P<0.05vscontrol group or vehicle group;#P<0.05vsTGF-β1group;△P<0.05vsTGF-β1+BK group.
图3BK对TGF-β1诱导的PASMCs增殖的影响
4BK对TGF-β1诱导的PASMCsPI3K蛋白表达的影响
Western blotting结果显示,与对照组相比较,溶媒组PI3K蛋白的表达无明显改变(P>0.05),TGF-β1明显上调了PI3K的表达(P<0.05);与TGF-β1组相比较,TGF-β1+BK组PI3K的表达显著降低(P<0.05),而HOE-140明显阻断了BK的效应(P<0.05),见图4。
5BK对TGF-β1诱导的PASMCsp-Akt蛋白表达的影响
Western blotting结果显示,与对照组相比较,溶媒组p-Akt蛋白的表达无明显改变(P>0.05),TGF-β1明显上调了p-Akt的表达(P<0.05);与TGF-β1组相比较,TGF-β1+BK组p-Akt的表达显著降低(P<0.05),而HOE-140明显阻断了BK的效应(P<0.05),见图5。
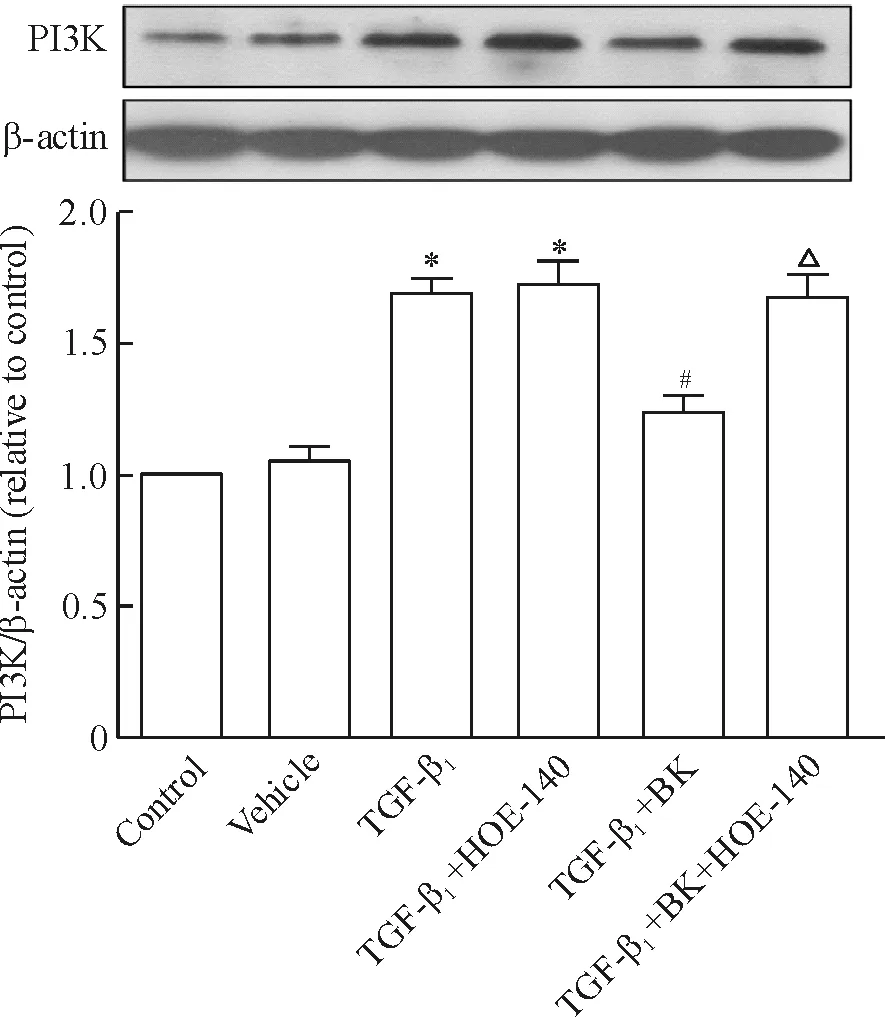
Figure 4. Expression of PI3K protein in PASMCs treated with vehicle, TGF-β1, BK or B2R inhibitor (HOE-140) as indicated.Mean±SD.n=3.*P<0.05vscontrol group or vehicle group;#P<0.05vsTGF-β1group;△P<0.05vsTGF-β1+BK group.
图4BK对TGF-β1诱导的PASMCsPI3K表达的影响
6BK对TGF-β1诱导的PASMCsp-ERK1/2蛋白表达的影响
Western blotting结果显示,与对照组相比较,溶媒组p-ERK1/2蛋白的表达无明显改变(P>0.05),TGF-β1明显上调了p-ERK1/2的表达(P<0.05);与TGF-β1组相比较,TGF-β1+BK组p-ERK1/2的表达显著降低(P<0.05),而HOE-140明显阻断了BK的效应(P<0.05),见图6。
讨 论
肺血管重构主要包括肺动脉内膜损害、中膜肥厚和外膜增厚,肺血管内皮细胞凋亡参与了PAH发病的重要起始环节[10]。Sakao等[11]研究发现,凋亡的肺血管内皮细胞分泌的血管内皮生长因子和TGF-β1能刺激血管平滑肌细胞过度增殖,促进肺血管重构。Sturrock等[12]研究发现,PAH发病过程中存在TGF-β1表达增加并且促进了PASMCs增殖。 细胞实验证实,TGF-β1可以促进PASMCs由G0/G1期进入G2/M+S期,从而调控细胞周期进展。 动物实验也发现,抑制TGF-β1可以降低肺血管重构和右心室压力[2]。本研究应用TGF-β1诱导原代培养的猪PASMCs增殖,发现TGF-β1呈剂量依赖性地促进PASMCs增殖,TGF-β1(10 μg/L)作用24 h,可以显著诱导猪PASMCs增殖,这与文献报道[2]是一致的,说明TGF-β1诱导PASMCs增殖模型制作成功。
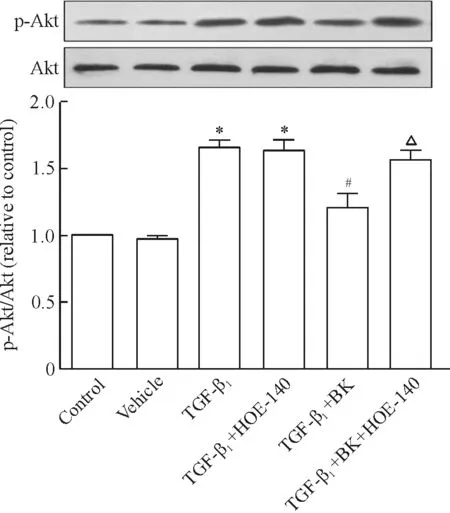
Figure 5. Expression of p-Akt protein in PASMCs treated with vehicle, TGF-β1, BK or B2R inhibitor (HOE-140) as indicated.Mean±SD.n=3.*P<0.05vscontrol group or vehicle group;#P<0.05vsTGF-β1group;△P<0.05vsTGF-β1+BK group.
图5BK对TGF-β1诱导的PASMCsp-Akt表达的影响

Figure 6. Expression of p-ERK1/2 protein in PASMCs treated with vehicle, TGF-β1, BK or B2R inhibitor (HOE-140) as indicated.Mean±SD.n=3.*P<0.05vscontrol group and vehicle group;#P<0.05vsTGF-β1group;△P<0.05vsTGF-β1+BK group.
图6BK对TGF-β1诱导的PASMCsp-ERK1/2表达的影响
本实验中,CCK-8结果显示,TGF-β1组显著诱导了PASMCs增殖,加用BK后TGF-β1诱导的PASMCs增殖作用显著降低,而HOE-140明显阻断了BK的效应。Western blotting结果也显示,BK显著抑制了TGF-β1诱导的PI3K/Akt和ERK1/2信号通路的激活,而HOE-140明显阻断了BK的效应。这些数据说明BK是通过B2R调节TGF-β1诱导的PASMCs增殖作用。
BK是一种血管活性九肽,是激肽释放酶-激肽系统(kallikrein-kinin system, KKS)中的重要活性物质成分,主要通过自分泌-旁分泌机制释放,与受体结合后发挥扩张血管、降低血压、增加局部血流、调节平滑肌松弛和收缩、增加血管通透性,改善肾功能等多种生物学效应[4]。B2R是一种跨膜G蛋白偶联受体,广泛表达于大多数组织[13]。已有研究报道,重组腺病毒介导的人组织激肽释放酶基因转染通过B2R抑制血小板源性生长因子诱导的自发性高血压大鼠血管平滑肌细胞增殖[5]。本研究发现,B2R抑制剂HOE-140明显阻断了BK抑制TGF-β1诱导的PASMCs增殖作用,该作用主要是通过阻断PI3K/Akt和ERK1/2信号通路而实现。
[参考文献]
[1]Rabinovitch M. Molecular pathogenesis of pulmonary arterial hypertension[J]. J Clin Invest, 2008, 118(7):2372-2379.
[2]Ma W, Han W, Greer PA, et al. Calpain mediates pulmonary vascular remodeling in rodent models of pulmonary hypertension, and its inhibition attenuates pathologic features of disease[J]. J Clin Invest, 2011, 121(11):4548-4566.
[3]Liu Y, Ma C, Zhang Q, et al. The key role of transforming growth factor-beta receptor I and 15-lipoxygenase in hypoxia-induced proliferation of pulmonary artery smooth muscle cells[J]. Int J Biochem Cell Biol, 2012, 44(7):1184-1202.
[4]Maurer M, Bader M, Bas M, et al. New topics in bradykinin research[J]. Allergy, 2011, 66(11):1397-1406.
[5]谢良地, 余惠珍, 朱鹏立, 等. 人组织激肽释放酶基因重组腺病毒转染对血管平滑肌细胞增殖和迁移的影响[J]. 中国病理生理杂志, 2010, 26(4):662-668.
[6]Yang S, Lin L, Chen JX, et al. Cytochrome P-450 epoxygenases protect endothelial cells from apoptosis induced by tumor necrosis factor-α via MAPK and PI3K/Akt signaling pathways[J]. Am J Physiol Heart Circ Physiol, 2007, 293(1):H142-H151.
[7]Tian X, Vroom C, Ghofrani HA, et al. Phosphodiesterase 10A upregulation contributes to pulmonary vascular remodeling[J]. PLoS One, 2011, 6(4):e18136.
[8]Kim HY, Hwang JY, Kim SW, et al. The CXCR4 antagonist AMD3100 has dual effects on survival and proliferation of myeloma cellsinvitro[J]. Cancer Res Treat, 2010, 42(4):225-234.
[9]徐西振, 李耕 ,冯文静, 等. 银杏叶提取物对 TNF-α诱导的牛主动脉内皮细胞血凝素样氧化低密度脂蛋白受体表达的影响及其机制[J]. 中国病理生理杂志, 2010, 26(12):2316-2320.
[10] Teichert-Kuliszewska K, Kutryk MJ, Kuliszewski MA, et al. Bone morphogenetic protein receptor-2 signaling promotes pulmonary arterial endothelial cell survival: implications for loss-of-function mutations in the pathogenesis of pulmonary hypertension[J]. Circ Res, 2006, 98(2):209-217.
[11] Sakao S, Taraseviciene-Stewart L, Wood K, et al. Apoptosis of pulmonary microvascular endothelial cells stimulates vascular smooth muscle cell growth[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 291(3):L362-L368.
[12] Sturrock A, Cahill B, Norman K, et al. Transforming growth factor-β1 induces Nox4 NAD(P)H oxidase and reactive oxygen species-dependent proliferation in human pulmonary artery smooth muscle cells[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(4):L661-L673.
[13] Leeb-Lundberg LM, Marceau F, Muller-Esterl W, et al. International union of pharmacology. XLV. Classification of the kinin receptor family: from molecular mechanisms to pathophysiological consequences[J]. Pharmacol Rev, 2005, 57(1):27-77.
