中性粒细胞明胶酶相关脂质运载蛋白在小鼠呼吸机所致肺损伤模型中的表达*
2013-04-13陈荣昌
肖 锐, 陈荣昌
(1广州市番禺区中心医院呼吸内科,广东 广州 511400; 2呼吸疾病国家重点实验室,广州市呼吸疾病研究所,广东 广州 510320)
目前,机械通气支持治疗在重症监护病房中得到普遍应用,特别是在救治急性肺损伤/急性呼吸窘迫综合症的病人发挥了重要作用。尽管机械通气有挽救生命的作用,它也能导致健康肺或有基础疾病肺的严重损伤。天然免疫和炎症反应在“生物伤”中的重要作用日益受到重视,它们之间形成的复杂的免疫炎症调控网络中的关键分子也是研究者们选择作为呼吸机所致肺损伤生物标志物的优先候选分子。
研究发现机械通气过程中的物理牵拉和剪切应力能诱导炎症细胞募集和炎症介质的产生。中性粒细胞和其介质参与了呼吸机所致肺损伤(ventilator-induced lung injury, VILI)的形成[1]。白细胞的激活和吸引是发生“生物伤”的重要特征。动物实验发现中性粒细胞缺乏的动物VILI发生的可能性显著降低。中性粒细胞在持续性肺损伤的正反馈环中处于一个中心地位[2]。中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)是一种阳性急性期蛋白。NGAL作为一种分泌蛋白,主要在粒细胞前体细胞和各种上皮细胞中表达[3]。肺泡上皮细胞在炎症反应中既是效应细胞又是靶细胞,在VILI的病理生理演变过程中具有重要作用[4]。因此,我们设想NGAL可能作为机械力和炎症刺激的感受器参与了VILI的发病机制。由于NGAL具有广泛参与炎症和免疫反应的生物学特性;并且是一种急性期反应的分泌蛋白,易于在血清和肺泡灌洗液中检测到;并且是与中性粒细胞密切相关的重要分子,鉴于这些特性,NGAL是作为VILI生物标志物的最佳候选靶标。我们实验目的是观察小鼠VILI模型中不同机械通气策略对NGAL表达的影响,希望能为早期诊断VILI找到新的生物标志物。
材 料 和 方 法
1材料
Trizol试剂购自Invitrogen。 AffinityScript qPCR cDNA 合成试剂盒和2×BrilliantⅡSYBR Green qPCR Master 试剂盒购自Stratagene。RIPA裂解液和BCA(bicinchoninic acid)蛋白定量试剂盒购自Pierce。抗小鼠β-actin单克隆抗体购自Santa Cruz。大鼠抗小鼠NGAL单克隆抗体购自R&D Systems;兔抗大鼠IgG-H&L(HRP)抗体购自 Abcam;发光底物试剂盒(SuperSignal® West Pico Chemiluminescent Substrate)购自Pierce。免疫组化染色试剂盒购自Zymed。
2.1小鼠呼吸机相关性肺损伤动物模型的建立雄性C57BL/6小鼠,共30只,6至8周龄,体重21.0~28.4 g。小鼠用戊巴比妥钠(65 mg/kg)麻醉。气管切开,插入气管导管, 动物取仰卧位置于Buxco动物生理信号采集系统的动物仓内,连接容量控制型小动物呼吸机(Harvard, Model 683)或压力控制型小动物呼吸机(Harvard, Model BS4 55-7059 Inspira)。气道压力和通气流量用Buxco动物生理信号采集系统监测。实验动物随机分为5组:(1)对照组: 小鼠气管切开插管后自主呼吸2 h,n=6。(2)高吸气末峰压(high peak inflation pressure,H-PIP;n=6)组:小鼠连接呼吸机后,给予50 cmH2O PIP和2.5 cmH2O 呼气末正压(positive end-expiratory pressure,PEEP),呼吸频率17 breaths/min、潮气量约1 mL,通气2 h。实验过程中适当调整潮气量以维持PIP在50 cmH2O。(3)低吸气末峰压(low peak inflation pressure,L-PIP;n=6)组:小鼠连接呼吸机后,给予15 cmH2O PIP,0 cmH2O PEEP,呼吸频率120 breaths/min, 潮气量约0.29 mL,通气2 h。(4)大潮气量(high volume,HV)组:小鼠连接呼吸机后,给予30 mL/kg、0 cmH2O PEEP,呼吸频率65 breaths/min,通气2 h。(5)小潮气量(low volume,LV)组:小鼠连接呼吸机后,给予6 mL/kg、5 cmH2O PEEP,呼吸频率135 breaths/min,通气2 h。
2.2实验动物标本的收集机械通气结束后腹腔注入戊巴比妥钠处死动物。(1)小鼠血清的收集:摘取小鼠眼球取外周血约0.6 mL,4 ℃放置过夜后5 000 r/min离心30 min,取上清,每管100 μL分装,-70 ℃保存。进行Western blotting检测。(2)小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的收集:收集完小鼠血清后,0.6 mL冰PBS液由注射器从气管套管注入小鼠肺,反复抽吸3次,回收率约90%。4 ℃、5 000 r/min离心10 min,取上清,每管100 μL分装,-70 ℃保存。进行总蛋白测定及Western blotting检测。(3)小鼠肺右叶取出后迅速放入液氮,次日放置-70 ℃保存。进行总蛋白提取,Western blotting检测。小鼠肺左下叶取出后迅速放入液氮,次日放置-70 ℃保存。进行总RNA提取,real-time RT-PCR检测。
2.3小鼠VILI模型复制的鉴定机械通气(或自主呼吸)2 h 处死动物后,用1 mL冰4%多聚甲醛由注射器从气管插管注入小鼠肺,用绳扎紧气道。将整个肺取出放入冰4%多聚甲醛固定24 h后,做石蜡包埋,病理切片、贴片、脱蜡、脱水、HE染色、固定后封片行病理镜检。另外,用BCA法测定BALF中总蛋白浓度,按照试剂盒说明书配制工作液和稀释标准品,加25 μL样品和稀释标准品到96孔酶标板的样品孔中。再在各孔加入200 μL BCA工作液,摇动混匀30 s。封板,37 ℃放置30 min。冷却到室温,用酶标仪测定562 nm 的吸光度(A562),根据标准曲线计算出蛋白浓度。
2.4小鼠VILI模型肺组织 NGAL mRNA 的表达利用 Primer 5.0引物设计软件设计扩增NGAL基因片段所需的上、下游引物,以β-actin作为内参照。引物序列由大连宝生物公司合成。稀释至10 μmol/L, -20 ℃保存。引物序列(5’-3’)及扩增的片段长度如下:NGAL上游引物CCCTGAACTGAAGGAACG,下游引物TTGGTATGGTGGCTGGTG,产物大小231 bp;β-actin上游引物CATCCGTAAAGACCTCTATGCCAAC,下游引物ATGGAGCCACCGATCCACA,产物大小171 bp。Real-time RT-PCR的反应条件和反应体系如下:第1链cDNA的合成是按照AffinityScript qPCR cDNA 合成试剂盒说明书配制20 μL反转录反应液,反应条件为25 ℃ 5 min;42 ℃ 15 min;95 ℃ 5 min,反应结束后,得到的cDNA溶液用RNase-free dH2O稀释到100 μL, -20 ℃保存。以上述cDNA溶液为模板按照BrilliantⅡSYBR Green qPCR Master 试剂盒说明书配制 real-time PCR反应体系,反应条件为95 ℃ 10 min, 95 ℃ 15 s,60 ℃ 60 s,后两步重复40个循环。所有的样本都做复孔。每次检测都包含有5个已知基因组DNA浓度的等比(10×)稀释梯度和未加 cDNA 模板的阴性对照获得的标准曲线。每次检测包含有溶解曲线的分析。目的基因的表达量利用相对定量分析法,即ΔΔCt法:ΔCt样本=Ct目的基因-Ct看家基因,ΔΔCt=ΔCt未知样本-ΔCt对照样本,相对表达水平=2-ΔΔCt。
2.5Western blotting法检测NGAL 在肺组织、血清和BALF中的表达用BCA法检测肺组织总蛋白提取液浓度,并将每个样本浓度调整为1 g/L,进行变性聚丙烯酰胺不连续凝胶电泳、转膜、封闭、洗膜后加入1∶100稀释的Ⅰ抗(大鼠抗小鼠NGAL单克隆抗体)摇床孵育,4 ℃过夜。洗膜之后用1∶1 000稀释的酶标Ⅱ抗兔抗大鼠IgG-H&L(HRP)室温下于摇床孵育1 h,反复洗膜4次,按发光底物试剂盒说明将A和B 2种试剂在保鲜膜上等体积混合;1 min后,将膜蛋白面朝下与此混合液充分接触;1 min后,将膜移至另一保鲜膜上,去尽残液,放入Kodak Image Station 2000R凝胶成像系统中显影。用凝胶成像系统分析软件分析条带灰度值,每个样本均测3次。计算公式如下:目的蛋白的相对表达量=目的蛋白灰度值/同一样本β-actin蛋白的灰度值。
2.6免疫组织化学法检测NGAL蛋白的表达部位将石蜡包埋的小鼠肺组织进行脱蜡和水化、洗片后抗原修复,滴加正常山羊血清封闭液,室温20 min,甩去多余液体。滴加Ⅰ抗稀释液50 μL, 4 ℃过夜。次日组织玻片在37 ℃复温45 min,洗片。 滴加Ⅱ抗50 μL, 室温静置1 h。洗片3次后 DAB显色10 min,自来水冲洗10 min。 苏木精复染2 min,盐酸乙醇分化。自来水冲洗10 min后脱水、透明、封片、镜检。
3统计学处理
数据采用SPSS 17.0统计学软件分析,数据以均数±标准差(mean±SD)表示,采用单因素方差分析和Tukey-Kramer多重比较检验法判断组间差异,以P<0.05为差异有统计学意义。
pH值,剩余葡萄糖含量和总蛋白质含量具有一定影响。咖啡碱的添加能在一定程度上刺激冠突散囊菌的生长,但在发酵过程中,其含量并未出现明显变化,这说明在该发酵系统中,冠突散囊菌既不能将其作为碳源、氮源分解代谢来维持生长,也不能利用共培养发酵体系中其他成分来合成咖啡碱。该结果与前人研究基本一致,且研究表明微生物体系中,利用真菌分解代谢咖啡因远比细菌要难的多[18],而且只发生在极少数的青霉属和曲霉属类群中,逐级代谢为茶碱和3-甲基黄嘌呤[19]。
结 果
1小鼠VILI模型的复制
首先,观察不同通气策略小鼠肺组织病理改变,评价动物模型复制情况。从肺组织肉眼观察发现,在HV组和H-PIP组小鼠肺组织可见充血水肿,有5例小鼠肺组织表面可见暗红色斑片状病灶。镜下观察显示正常对照组肺泡结构正常(图1A);LV组和L-PIP组也未见明显形态学异常(图1B、C);在HV组和H-PIP组,可见肺泡间隔增厚并有中性粒细胞浸润,肺泡腔内红细胞渗出,还有嗜伊红染色的水肿液和纤维素(图1D、E)。另外,用BCA法测定BALF中总蛋白的量(表1)。在损伤性肺通气组,如H-PIP组和HV组BALF中的总蛋白量比正常对照组分别升高了约4.03和2.09倍。结合病理改变及肺泡腔中蛋白渗出、总蛋白量明显增加等指标,可认为该模型是成功的。
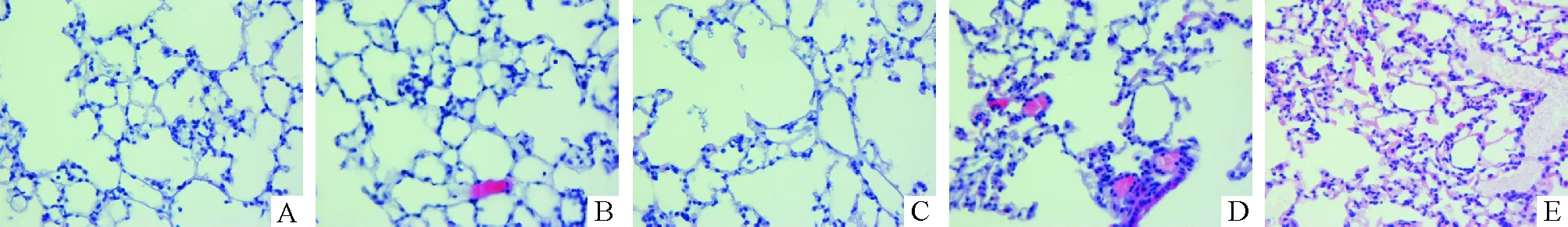
Figure 1. Pathological changes of mouse lung tissues after exposure to different strategies of mechanical ventilation (HE staining,×400).A: control group; B: LV group; C: L-PIP group; D: HV group; E: H-PIP gourp.
图1不同通气策略下小鼠肺组织的病理改变
2不同通气模式对NGALmRNA表达的影响
正常肺组织有少量NGAL mRNA的表达。LV组通气2 h后,NGAL mRNA的表达比对照组升高了3.63倍(P<0.01)。 HV组NGAL mRNA的表达也较对照组升高了3.29倍(P<0.01),但是HV组与LV组相比,NGAL mRNA的表达没有显著差异(P>0.05)。在压力控制型机械通气中,NGAL mRNA的表达比正常组仍是增加的,分别为对照组的2.10和41.9倍(P<0.01),在H-PIP组NGAL mRNA的表达水平最高,提示损伤性机械通气策略能使NGAL mRNA的表达显著增加,见图2。
表1急性肺损伤小鼠BALF中总蛋白含量
Table 1. Total protein in BALF in mouse model of ALI(mg/L.Mean±SD.n=6)

GroupTotalproteininBALFControl621.12±8.67LV1137.50±3.12HV1304.33±4.89L⁃PIP1266.67±2.78H⁃PIP2500.00±4.09∗
*P<0.05vscontrol.
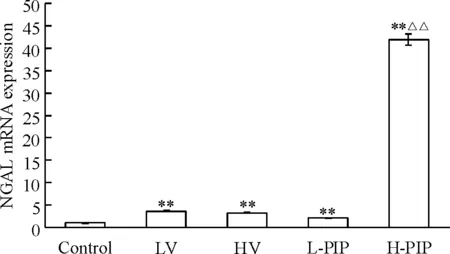
Figure 2. Expression of NGAL mRNA in mouse lung tissues after exposure to different strategies of mechanical ventilation detected by real-time RT-PCR. Mean±SD.n=6.**P<0.01vscontrol;△△P<0.01vsHV group.
图2实时定量RT-PCR测定不同通气策略下小鼠肺组织NGALmRNA的表达
3不同通气模式对NGAL蛋白表达的影响
NGAL的蛋白表达变化与其mRNA的变化趋势基本一致。在BALF中H-PIP组NGAL的蛋白表达量较其它组明显增高,约是正常对照组的4倍、HV组的2倍(均P<0.01);而且其在BALF内的量明显高于在血清和肺组织的表达量。在LV组和L-PIP组,NGAL蛋白表达稍微升高,在肺组织、BALF和血清中的表达水平无明显差异(P>0.05),见图3。
4NGAL蛋白在VILI小鼠动物模型中的作用部位
NGAL主要表达在肺组织的血管内皮细胞和浸润的中性粒细胞中,见图4B、C,还有少量表达在气道上皮细胞。这提示血管的内皮细胞和气道上皮细胞也参与了VILI的形成。
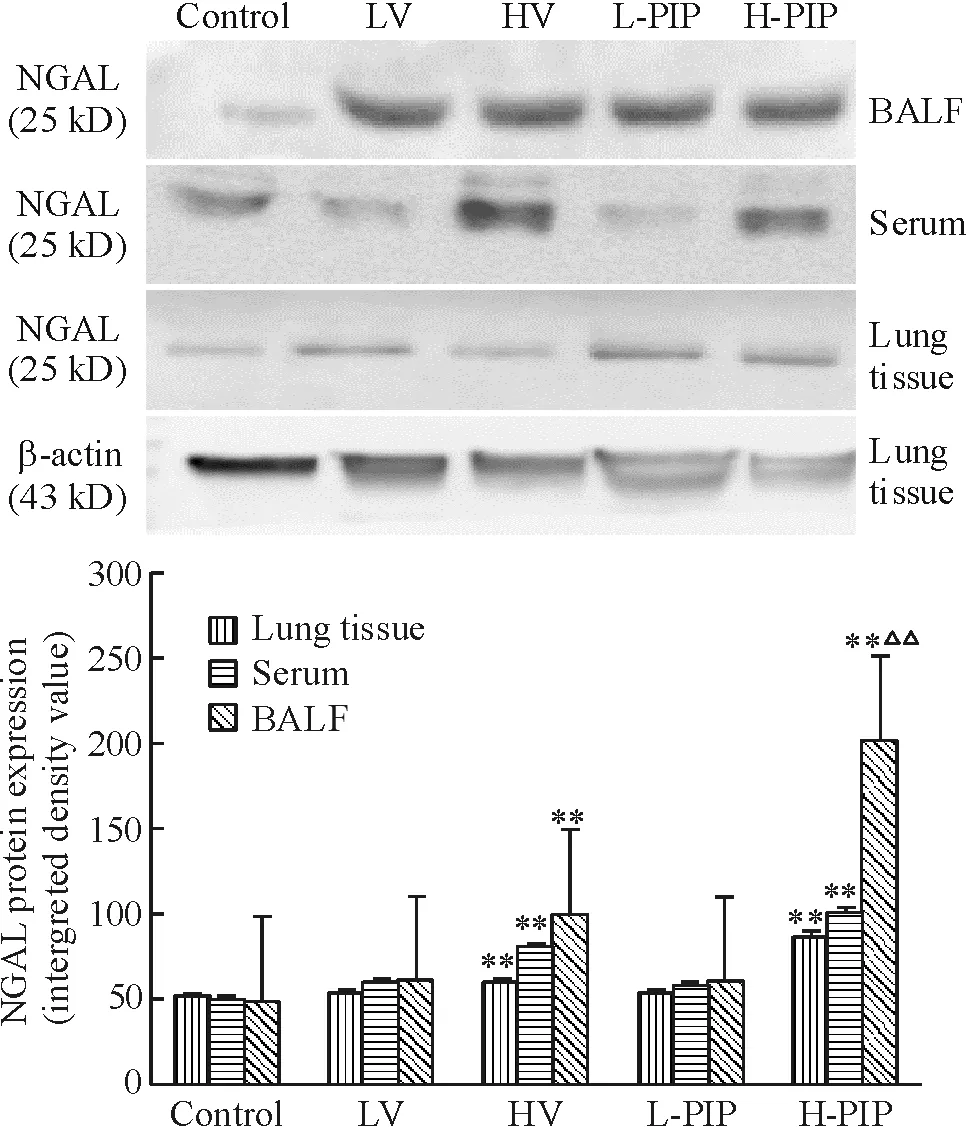
Figure 3. Expression of NGAL protein in lung tissues, BALF and serum of mice after exposure to different strategy of mechanical ventilation detected by Western blotting. Mean±SD.n=6.**P<0.01vscontrol group;△△P<0.01vsHV group.
图3免疫印迹检测不同通气策略下小鼠肺组织、BALF及血清NGAL蛋白的表达
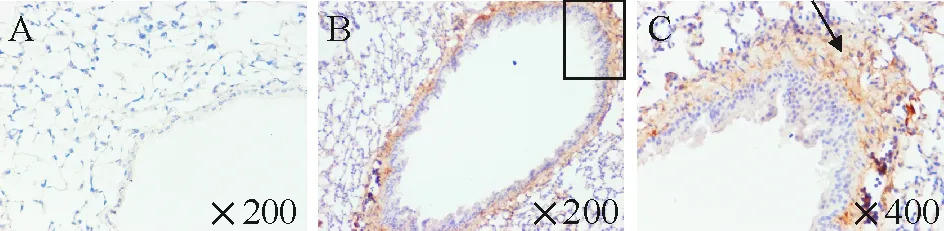
Figure 4. Location of NGAL expression in mouse lung tissues in the injurious mechanic ventilation model detected by immunohistochemistry. A:negative control; B and C: the intense expression of NGAL in vascular endothelial cells and infiltrating neutrophil (arrow) after injurious mechanic ventilation.
图4免疫组织化学法检测在损伤性通气肺组织中NGAL的空间定位
讨 论
如今实验研究中的大多数鉴别的生物标志物主要来源于血浆、血清、肺水肿液、BALF和呼气冷凝液(exhaled breath condensate,EBC)。这些生物标志物可分为细胞因子,如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-1β、IL-6、IL-8、IL-10等;肺上皮细胞的特异蛋白,如表面活性蛋白A、B、D(surfactant protein A、B、D,SP-A、SP-B、SP-D);内皮细胞激活的标记物,如黏附分子E-选择素、L-选择素等[5-6]。有临床研究中发现SP-D在保护性通气策略是明显升高,而TNF-α、IL-1β、IL-6、IL-8却明显降低。TNF-α、IL-1β和IL-8具有促炎效应,而IL-10、sTNFR1和sTNFR2具有抗炎的功能,IL-6和NO在不同的时空条件下具有抗炎或促炎的双重效应,并具有潜在的免疫调节功能。但无论是动物或是体外细胞实验还是临床实验都发现这些蛋白的表达水平及其变化和潮气量或呼气末正压有一定的相关性。因此,合理选择通气模式及参数调整是减少VILI的关键之一。目前临床常用定容型和定压型的2种通气策略。小潮气量(≤10 mL/kg)通气是定容型通气设置潮气量的原则。压力控制型通气模式中一般认为平台压≤ 30 cmH2O可有效避免呼吸机相关的肺损伤,故设置的压力通常在10~20 cmH2O,一般不超过30 cmH2O。我们的实验选择了临床上最常见的2种通气模式观察到NGAL在损伤性通气策略组升高显著,高吸气末峰压组和大潮气量通气组NGAL mRNA和蛋白的表达明显升高,提示NGAL是对机械刺激敏感的传感蛋白,它可能参与了VALI的发病机制。
有关NGAL在VILI中的表达情况文献报道较少。Yan等[7]对大鼠颈动脉损伤的动物模型研究中,分离血管平滑肌细胞并给予血管成形支架,机械刺激诱导急性期炎症反应的NGAL表达明显增高,提示机械刺激也能诱导NGAL的表达。Friedl等[8]研究正常生长条件和给予促炎因子刺激后NGAL在上皮细胞中的表达,发现NGAL在支气管杯状细胞和肺泡Ⅱ型上皮细胞表达,而且在炎症肺的支气管和肺泡上皮细胞表达增加。尽管NGAL在肺组织有表达,但是其与VILI相关的分子病理生理机制还不清楚。我们实验中NGAL在VILI小鼠模型中的显著表达提示NGAL可能是ALI发病机制中炎症信号转导蛋白。免疫组化的结果显示NGAL表达位置在肺的上皮细胞,血管内皮细胞和浸润的中性粒细胞。这些结果强力支持NGAL在急性肺损伤(acute lung injury,ALI)炎症过程中的重要性。这些结果也和近来报道的脓毒血症时血循环中NGAL的浓度显著升高,NGAL能抑制中心粒细胞凋亡的报道一致。
综上所述,我们利用VILI小鼠动物模型发现NGAL可以作为判断VILI新的潜在的生物标记物。在临床工作中检测血清或BALF中NGAL的水平,可能会为识别VILI高危病人提供依据。但是,NGAL在VILI发生机制中的作用还需要基因沉默或抗体阻断等体外实验进一步加以论证。
[参考文献]
[1]Tremblay L, Valenza F, Ribeiro SP, et al. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model [J]. J Clin Invest, 1997, 99(5): 944-952.
[2]Martin TR, Pistorese BP, Chi EY, et al. Effects of leukotriene B4 in the human lung. Recruitment of neutrophils into the alveolar spaces without a change in protein permeability[J]. J Clin Invest,1989, 84(5):1609-1619.
[3]刘静,李绍梅,薛雯,等.原发性肾病综合征并发急性肾损伤患者血清及肾组织中NGAL的表达及意义[J].中国病理生理杂志,2012,28(11):1982-1985.
[4]Schmidt-Ott KM, Mori K, Kalandadze A, et al. Neutrophil gelatinase-associated lipocalin-mediated iron traffic in kidney epithelia[J]. Curr Opin Nephrol Hypertens,2006, 15(3): 442-449.
[5]Parsons PE, Eisner MD, Thompson BT, et al. Lower tidal volume ventilation and plasma cytokine markers of inflammation in patients with acute lung injury[J]. Crit Care Med,2005, 33(1):1-6.
[6]Ye SQ, Simon BA, Maloney JP, et al. Pre-B-cell colony enhancing factor as a potential novel biomarker in acute lung injury[J]. Am J Respir Crit Care Med,2005, 171(4): 361-370.
[7]Yan ZQ, Sirsjo A, Bochaton-Piallat ML, et al. Augmented expression of inducible NO synthase in vascular smooth muscle cells during aging is associated with enhanced NF-κB activation[J]. Arterioscler Thromb Vasc Biol,1999, 19(12):2854-2862.
[8]Friedl A, Stoesz SP, Buckley P, et al. Neutrophil gelatinase- associated lipocalin in normal and neoplastic human tissues: cell type-specific pattern of expression[J]. Histochem,1999,31(7): 433-441.
