肌肽对高糖诱导的H9c2细胞损伤的拮抗作用*
2013-04-13齐晓丹宁小美李淑艳张春晶
师 岩, 齐晓丹, 张 伟, 张 帆, 宁小美, 李淑艳, 张春晶△
(齐齐哈尔医学院 1生物化学教研室, 4计算机教研室,黑龙江 齐齐哈尔 161006;齐齐哈尔医学院附属第三医院 2内分泌科, 3心胸外科,黑龙江 齐齐哈尔 161000)
糖尿病已经成为危害人类健康的重要疾病之一,继发于糖尿病的糖尿病心肌病(diabetic cardiomyopathy,DCM) 是部分糖尿病患者发生心力衰竭和死亡的重要原因,严重影响患者的生活质量,因此对 DCM 患者的早期干预治疗有着重要的意义。2004年,美国糖尿病学会(American Diabetes Association, ADA)年会提出了糖尿病及其慢性并发症都有统一发病机制,即高血糖损伤的共同基础——氧化应激。氧化应激在 DCM 的发生发展中发挥重要作用,大量氧自由基及活性氧(reactive oxygen species,ROS)直接损伤心肌细胞及血管内皮细胞,引起细胞凋亡,最终表现为心肌细胞功能障碍[1-2]。因此抗氧化治疗成为防治糖尿病心肌病的一个有效途径。大量研究显示[3],肌肽作为一种内源性的抗氧化剂,它具有水溶性好、性质稳定、分子量小、易于被机体利用等优点[4]。本实验以体外培养的大鼠心肌细胞H9c2为对象,建立高糖诱导心肌细胞损伤模型,观察肌肽拮抗高糖诱导的心肌细胞损伤及其作用机制,为肌肽在临床用于防治糖尿病心肌病并发症提供理论依据。
材 料 和 方 法
1材料
H9c2细胞由本实验室保存(中国医学科学院基础医学研究所基础医学细胞中心);肌肽(Sigma),胎牛血清(HyClone),0.25%胰酶-0.02%EDTA(吉诺生物医药技术有限公司),DMEM培养基(Gibco),DCFH-DA(Sigma)。活化caspase-8、caspase-9和caspase-3抗体(Abcam)。流式细胞仪(Becton)。Bio-Rad Gel-Doc凝胶成像系统。
2方法
2.1心肌细胞培养 H9c2细胞常规培养在含10%胎牛血清的DMEM培养液中,于37℃、5% CO2条件下培养。
2.2实验分组及预处理方式 细胞分组:(1)正常对照组(NC组):葡萄糖浓度为5.5 mmol/L;(2)高糖损伤组(HG组):葡萄糖浓度分别为20、25和30 mmol/L;(3)高糖+肌肽预保护组(Car+HG组)提前6 h加入浓度20 mmol/L肌肽预保护。
2.3MTT法检测细胞存活率细胞以2×104/well的密度接种于96孔培养板中,用含10%胎牛血清的DMEM培养液于37 ℃、5% CO2孵箱中培养24 h,弃培养液,换不含血清的新鲜DMEM培养液培养6 h,使细胞同步化。分组给药同上,每组设6个平行孔,继续培养24 h、48 h和72 h后,加入50 μL新鲜配制的1 g/L MTT,37 ℃、5%CO2培养4 h后,弃去培养液,每孔加入150 μL DMSO,37 ℃轻摇10 min溶解紫色结晶。30 min内置酶标仪于490 nm波长下测定吸光度(A)。
2.4DCFH-DA探针检测ROSH9c2细胞用0.25%胰酶-0.02% EDTA消化,以(1.5~2)×108/L接种于60 mm培养板中。常规培养至75~80%,用不完全DMEM培养液培养48 h。细胞分组同上,每组3个复皿。在经过处理的细胞中加入10 μmol/L DCFH-DA,37 ℃、5%CO2孵育20~30 min。细胞沉淀先用PBS洗2次,再用1 mL PBS液重悬细胞后收集至1.5 mL离心管中,然后用流式细胞术测定荧光强度,其激发波长为488 nm,发射波长为510 nm。
2.5Westem blotting检测蛋白表达收集并裂解细胞,提取蛋白。以等量蛋白上样进行SDS-PAGE。电泳结束后转移至 NC 膜上,5%脱脂奶粉37 ℃封闭90 min,抗活化caspase-8、caspase-9和caspase-3抗体4 ℃过夜孵育。1∶2 000 HRP-标记的抗体室温下孵育1 h,ECL Plus 检测。同时以GAPDH作内参照,采用Bio-Rad Gel-Doc凝胶成像系统对Western blotting结果进行分析。
3统计学处理
运用SPSS 16.0统计软件分析。数据用均数±标准差(mean±SD)表示,组间差异采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1肌肽对高糖诱导H9c2细胞存活率的影响
与对照组相比,不同浓度葡萄糖刺激24 h后,H9c2细胞的存活率差异无统计学意义(P>0.05),见图1。20、25和30 mmol/L葡萄糖处理48 h和72 h后,与24 h相比细胞存活率降低,随着高糖刺激时间和高糖浓度的增加,细胞存活率逐渐降低,差异均有统计学意义(P<0.05),见图1,提示细胞存活率具有时间、浓度依赖性。30 mmol/L葡萄糖刺激48 h后,细胞存活率小于40%,25 mmol/L葡萄糖刺激48 h后,细胞存活率约50%,提示25 mmol/L浓度能兼顾体现高糖导致的氧化应激损伤和适当的细胞死亡率,因此本实验选择25 mmol/L为常规高糖刺激组。高糖刺激72 h细胞死亡率过高,选择高糖刺激48 h,既可造成心肌细胞可逆性氧化应激损伤,又能较好反应抗氧化剂肌肽对心肌的保护作用。25 mmol/L葡萄糖刺激48 h并加入肌肽预保护的细胞中,细胞的存活率较其它高糖组显著提高,可由高糖损伤组的57.74%±2.43%增加到82.62%±2.61%,差异有统计学意义(P<0.05)。

Figure 1. Effects of different concentrations of high glucose on the survival rate of H9c2 cells detected by MTT assay.Mean±SD.n=6.*P<0.05vsnormal control (NC) group.
图1MTT检测不同浓度高糖对H9c2细胞存活率的影响
2肌肽清除细胞内自由基的作用
流式细胞术检测结果见图2,25 mmol/L高糖刺激H9c2细胞48 h后细胞DCFH-DA的平均荧光强度(mean fluorescence intensity, MFI)(红色荧光)与正常对照组细胞(蓝色荧光)相比,荧光强度增加42.0%±3.2%,表示ROS水平明显增高(P<0.05),而给予20 mmol/L肌肽后,荧光强度(绿色荧光)与高糖组细胞相比降低了35.0%±2.7%(P<0.05),且与正常细胞相近,说明肌肽可明显抑制高糖引起的氧化应激反应。
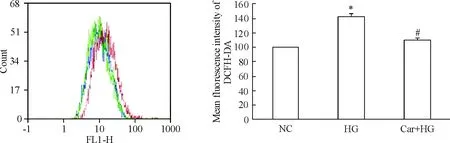
Figure 2. Flow cytometry analysis of DCFH-DA fluorescence intensity. Normal control (NC) group:blue fluorescence; high glucose (HG, 25 mmol/L) group:red fluorescence; carnosine(Car, 20 mmol/L)+HG group:green fluorescence. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图2流式细胞术检测高糖诱导H9c2细胞48h后细胞内DCFH-DA荧光强度
3Westernblotting分析肌肽对细胞caspase家族蛋白表达影响
Western blotting检测结果及灰度扫描后的目的条带与GAPDH比值见图3。高糖组与正常对照组相比, caspase-3相对含量(6.41±0.65vs2.21±0.53)、caspase-8相对含量(7.32±0.91vs1.15±0.49)和caspase-9相对含量(4.07±0.54vs0.51±0.31)均明显增多(P<0.05)。肌肽预保护组与高糖组相比,caspase-3相对含量(4.71±0.59vs6.41±0.65)和caspase-9相对含量(2.95±0.41vs4.07±0.54)均显著降低(P<0.05),但caspase-8相对含量(7.64±0.89vs7.32±0.91)较高糖组无显著改变(P>0.05)。以上数据表明,高糖可诱导心肌细胞凋亡,而肌肽可通过下调caspase-9和 caspase-3蛋白表达水平而抑制凋亡。
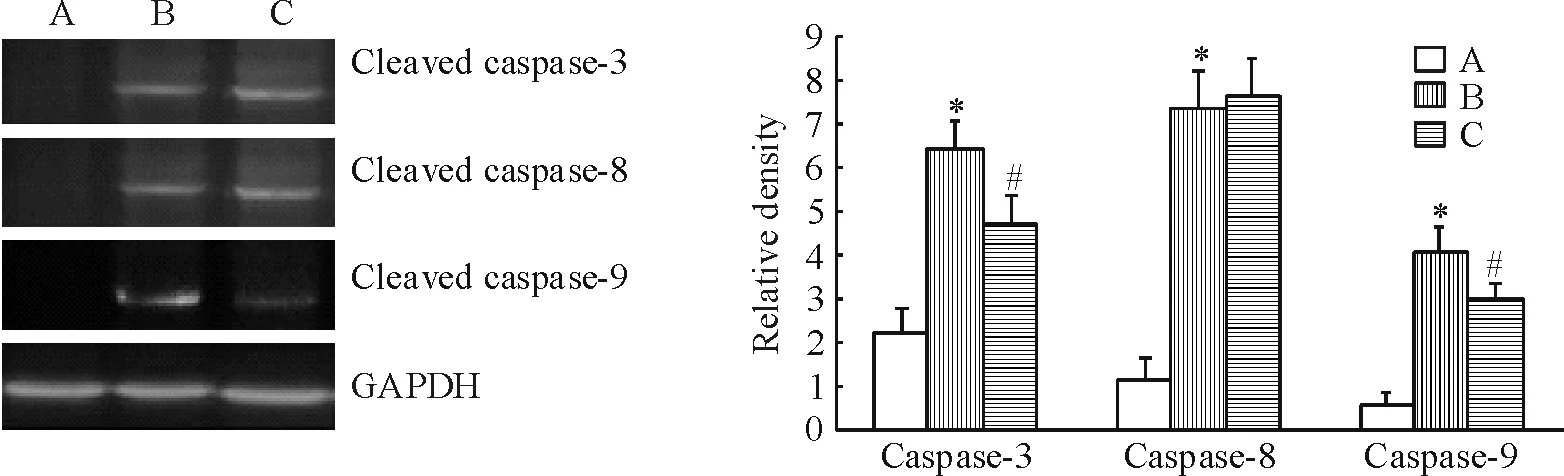
Figure 3. Protein expression of activated caspase-3, -8 and -9 in H9c2 cells detected by Western blotting. A:normal control(NC) group; B:high glucose(HG,25 mmol/L) group; C: carnosine(Car,20 mmol/L)+HG group. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsHG group.
图3Westernblotting法检测活化caspase-3、-8和-9蛋白的表达
讨 论
1972 年,Rubler 等发现糖尿病患者患有的特异性心肌病变,后被定义为DCM。该疾病包括了微血管病变和心肌细胞代谢紊乱引起的心脏病变。DCM是心肌对糖尿病的急性反应而导致的慢性病理改变,这些急性反应包括基因表达异常、信号转导改变及细胞凋亡[5]。H9c2细胞源于胚胎期大鼠心脏,保持很多心肌细胞的特征,可用于高糖的体外研究。我们以MTT法检测H9c2心肌细胞在不同高糖浓度、不同时点的细胞存活率,建立高糖诱导的细胞损伤模型组。研究证明,糖尿病心肌病的重要发病机制之一是高血糖损伤心肌细胞引起ROS生成增多[6]。Fiordalis等[7]在STZ诱导的糖尿病大鼠心脏标本中也发现,DCM增加心肌细胞凋亡的同时,心肌细胞内ROS增加了2倍以上,导致机体氧化应激加强。ROS所致的氧化应激是造成细胞凋亡的重要环节。我们通过DCFH-DA探针检测ROS,证明了高糖诱发心肌细胞损伤与氧化应激密切相关。近年来Mohammad等[8]证明了抗氧化剂在预防ROS引起的心肌细胞损伤方面可以发挥有益作用。肌肽作为一种内源性抗氧化剂,具有多种抗氧化作用,可以有效清除活性氧和自由基,对于改善与治疗2型糖尿病并发症有很好应用前景[9],在防治糖尿病肾病、糖尿病视网膜病、糖尿病心血管病及糖尿病神经系统损害等方面已有报道[10]。我们曾发现:一定浓度的肌肽能有效抑制高糖诱导的人脐静脉内皮细胞凋亡,氧化应激在糖尿病血管病变中的损伤作用已得到证实[11]。为了进一步证明肌肽这种抗氧化剂在糖尿病心血管疾病中的作用,本实验以H9c2细胞为对象,建立高糖损伤模型,研究肌肽抑制高糖诱导的心肌细胞损伤作用及机制。糖尿病心肌病大鼠心肌细胞氧化应激损伤会导致细胞凋亡,其发生主要由2条信号通路介导,即外在途径和内在途径[12]。外在途径是死亡受体介导的信号通路,即胞外凋亡信号与膜上的凋亡受体相结合使caspase-8激活, 活化的caspase-8又激活caspase-3, 诱导凋亡的级联反应[13];内在途径是线粒体介导的信号通路,即各种损伤因素通过促进线粒体释放细胞色素C等信号分子,然后激活caspase-9和caspase-3而介导细胞凋亡[14]。Caspase蛋白酶家族引发一系列级联反应,剪切底物使凋亡得以进行,在介导细胞凋亡中起着中心作用。迄今为止,已发现至少13种caspase家族成员参与了细胞凋亡,但在心肌细胞凋亡中以caspasc-3、-8和-9的作用最为重要。为了研究肌肽抑制高糖诱导的细胞损伤的作用,我们利用Western blotting方法重点检测了caspase家族蛋白中caspase-3、-8和-9的表达量。高糖诱导心肌细胞48 h后,高糖组中caspase-3、-8和-9均高表达。Bojunga[15]等人的研究同样认为,高血糖增加心肌细胞凋亡的过程中,增加了心肌Fas受体和caspase-8的表达,说明高糖诱导心肌细胞凋亡可以通过外在途径和内在途径2条信号通路。而肌肽预保护组的caspase-9和caspase-3表达量降低,caspase-8表达量没有明显变化,因此推测肌肽作用于高糖环境下的心肌细胞,可以通过线粒体信号通路介导抗氧化作用,抑制caspase-9和caspase-3表达,保护心肌细胞免受高糖诱导的氧化应激和凋亡损伤,而与外在途径死亡受体介导的信号通路关系不大。
[参考文献]
[1]Chen J,Cha-Molstad H,Szabo A,et al. Diabetes induces and calcium channel blockers prevent cardiac expression of proapoptotic thioredoxin-interacting protein[J].Am J Physiol Endocrinol Metab,2009,296(5):E1133-E1139.
[2]王时俊, 邹云增, 孙爱军, 等. 氧化应激在乙醛引起的心肌细胞凋亡中的作用[J].中国病理生理杂志, 2008, 24(8): 1464-1468.
[3]Boldyrev AA. Carnosine: new concept for the function of an old molecule[J]. Biochemistry (Mosc), 2012, 77(4):313-326.
[4]Hipkiss AR, Cartwright SP, Bromley C, et al.Carnosine: can understanding its actions on energy metabolism and protein homeostasis inform its therapeutic potential? [J].Chem Cent J,2013, 7:38.
[5]Cai L, Kang YJ.Cell death and diabetic cardiomyopathy[J]. Cardiovasc Toxicol,2003,3(3):219-228.
[6]Inoguehi T, Li P, Umeda F, et al.High glucose level and fatty acid stimulate reactive oxygen species production through protein kinase C-dependent activation of NAD(P)H oxidase in cultured vascular cells[J]. Diabetes,2000,49(11):1939-1945.
[7]Fiordaliso F, Bianehi R, Staszewsky L, et al. Antioxidant treatment attenuates hyperglycemia-induced cardiomyocyte death in rats[J].J Mol Cell Cardiol,2004,37(5):959-968.
[8]Dallak MM,Mikhailidis DP,Haidara MA,et al.Oxidative stress as a common mediator for apoptosis induced-cardiac damage in diabetic rats[J].Open Cardiovasc Med J,2008,2:70-78.
[9]周莉莉,桂书彦,杨雁, 等.L-carnosine对NIT-1胰岛细胞的影响及机制[J].中国病理生理杂志, 2012, 28(7): 1281-1286.
[10] Hipkiss AR. Carnosine and its possible roles in nutrition and health[J]. Adv Food Nutr Res, 2009,57:87-154.
[11] 师岩,房绍红,周宏博.肌肽对高糖诱导的人脐静脉内皮细胞凋亡的影响[J].哈尔滨医科大学学报,2010,44(6):527-530.
[12] Tsai CY, Wang CC, Lai TY,et al.Antioxidant effects of diallyl trisulfide on high glucose-induced apoptosis are mediated by the PI3K/Akt-dependent activation of Nrf2 in cardiomyocytes[J]. Int J Cardiol, 2013 Feb 27.[Epub ahead of print]
[13] 马小茹,王淑秋,刘月霞, 等. 灵芝孢子粉对2型糖尿病大鼠附睾组织Cyt-C和半胱天冬酶的影响[J].中国病理生理杂志, 2009, 25(12): 2460-2462.
[14] 韦金儒,张雅莉.3-硝基酪氨酸与糖尿病心肌病大鼠心肌细胞凋亡[J].中国病理生理杂志, 2011, 27(2): 243-248.
[15] Bojunga J, Nowak D, Mitrou PS, et al. Antioxidative treatment prevents activation of death-receptor and mitochondrion-dependent apoptosis in the hearts of diabetic rats[J].Diabetologia,2004,47(12):2072-2080.
