脂肪间充质干细胞早期干预对野百合碱诱发的肺动脉高压大鼠肺小动脉功能的影响*
2013-04-13梁敏烈谢良地李宏亮郑苏梨王华军
梁敏烈, 谢良地, 李宏亮, 郑苏梨, 王华军
(福建医科大学附属第一医院,福建省高血压研究所,福建 福州 350005)
肺动脉高压(pulmonary arterial hypertension,PAH)是指临床上以肺血管阻力进行性升高,并最终导致右心室衰竭及死亡为特征的多种心肺疾病所共有的病理生理过程。近年来,国外的一些研究表明干细胞移植治疗有助于改善肺血管的内皮功能,降低肺动脉压力并且改善肺小动脉的重构[1-3]。脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADMSCs)是从脂肪组织中分离出的多潜能干细胞,具有自体来源丰富、取材方便、避免免疫排斥、多向分化等特点[4-6],成为种子细胞研究的新热点。近期,我们研究表明,归巢于PAH模型大鼠体内的ADMSCs能诱导分化为内皮样细胞[7];而且,研究发现ADMSCs移植于野百合碱(monocrotaline,MCT)诱导的PAH大鼠,可以减轻肺动脉压力,同时改善肺小动脉的重构[8]。但是,ADMSCs移植对MCT诱发的PAH大鼠肺小动脉功能的影响目前尚未明确。因此,本研究采用ADMSCs早期移植于MCT诱导的PAH大鼠,观察其肺小动脉的内皮依赖性舒张(endothelium-dependent relaxation,EDdR)、非内皮依赖性舒张(endothelium-independent relaxation,EDiR)以及收缩功能(vasoconstrictive function,VCF)的变化,旨在进一步探讨ADMSCs在PAH治疗中的作用。
材 料 和 方 法
1材料
1.1动物清洁级Sprague-Dawley(SD)大鼠,雄性,5周龄,体质量100~150 g,上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)20070005。动物饲养条件:每笼4只,恒温(22±2)℃,恒湿(55±5)%,人工光照明暗各12 h/d,24 h自由摄食饮水。
1.2主要试剂牛血清白蛋白(Bovogen);Ⅰ型胶原酶、DMEM-F12培养基、胎牛血清和胰蛋白酶(Gib-ico);小鼠抗大鼠CD31单克隆抗体(Abcam);兔抗大鼠CD34单克隆抗体(Santa Cruz);FITC标记山羊抗小鼠IgGⅡ抗和FITC标记山羊抗兔IgGⅡ抗(北京中杉金桥生物技术有限公司);FITC anti-rat CD45、FITC anti-rat CD29和PE anti-rat CD90(Biolegend);重组腺病毒载体Ad5-EGFP(北京正阳基因有限公司);MCT、乙酰胆碱(acetylcholine, ACh)和内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)阻断剂左旋硝基精氨酸甲酯(NG-nitro-L-arginine methyl ester, L-NAME) (Sigma);硝普钠(sodium nitroprusside, SNP)(北京双鹤药业);去甲肾上腺素(norepinephrine, NE)(中国远大医药有限公司);氯化钠(NaCl)、氯化钾(KCl)、硫酸镁(MgSO4)、氯化钙(CaCl2)、磷酸二氢钾(KH2PO4)、碳酸氢钠(NaHCO3)、葡萄糖(glucose)和氢氧化钠(NaOH)均为国产分析纯。
2方法
2.1大鼠ADMSCs分离、培养、鉴定及荧光标记取清洁级5周龄雄性SD大鼠4只,颈椎脱臼处死,无菌条件下取双侧腹股沟区皮下脂肪,参照文献[9-10]报道的方法进行大鼠ADMSCs的分离和培养。采用流式细胞仪(FACSCalibur型,BD)测定细胞表面抗原CD29、CD31、CD34、CD45和CD90表达的方法对传代培养的ADMSCs进行鉴定。取生长良好的第3代ADMSCs,培养至细胞达50%融合时,加入感染复数(multiplicity of infection, MOI)为100的Ad5-EGFP重组腺病毒感染ADMSCs,24 h后更换新的培养基,72 h后荧光显微镜(PUSIX-70型,Olympus)观察细胞中绿色荧光蛋白的表达情况,并收集细胞备用。
2.2动物分组及动物模型的制备90只清洁级5周龄雄性SD大鼠适应性饲养2周(标准饲料,自由饮水)后按照随机数字表法随机分为正常对照组(control组,n=30)、MCT诱导组(PAH组,n=30)和MCT诱导+ ADMSCs早期干预组(ADMSCs-EI组,n=30)。实验第1天,实验动物根据本小组已建立的方法[11],给大鼠腹腔一次性注射MCT 40 mg/kg复制PAH模型,对照组腹腔注射等量生理盐水代替MCT;腹腔注射MCT后1周,ADMSCs-EI组大鼠经左颈外静脉一次性注射绿色荧光蛋白标记的1 mL ADMSCs (1×106),对照组和PAH组经左颈外静脉一次性注射相同体积的生理盐水。分别于ADMSCs移植后1、2、3周检测各项指标。
2.3动物生存质量观察观察实验各组大鼠的活动、毛发、呼吸、食欲、体质量等变化,随访动物的存活情况。
2.4肺动脉平均压(mean pulmonary artery pressure, MPAP)测定参考孙波等[12]报道的方法,建立右心导管法测量大鼠MPAP[11]。大鼠以10%水合氯醛(3 mL/kg)腹腔内注射麻醉后,从右颈外静脉插管至肺动脉干,接压力换能器和PowerLab生理信息采集与处理系统(ADInstruments),待压力波形稳定后开始实时记录肺动脉压,取其平均值。
2.5离体肺小动脉环功能测定
2.5.1大鼠离体肺小动脉环的制备测压后,迅速开胸取出大鼠肺叶,立即置于预先备好的、95% O2和5% CO2混合气体饱和的4 ℃ Krebs液(mmol/L:NaCl 118.3,KCl 4.7,MgSO41.2,CaCl22.52,KH2PO41.2,NaHCO324.2,葡萄糖 11.0,10% NaOH滴定至pH 7.4)中,在体视显微镜下分离肺叶内肺小动脉,取血管直径介于100~200 μm的肺小动脉,用显微外科剪去除血管周围的脂肪及结缔组织,将肺小动脉剪成3 mm的血管环,操作过程中避免过度牵拉,以防损伤内皮。随后用显微外科镊将肺小动脉血管环套于两个直径50 μm三角形钨丝挂钩上,其中一个连接张力换能器,连接记录装置(PowerLab生理信息采集与处理系统),另一个连接微调装置以调节负荷张力。肺小动脉环分别置于持续通入95% O2+5% CO2混合气体充分饱和、37 ℃恒温的、10 mL Krebs液的四腔离体组织灌流系统(ADInstruments)浴槽中。实验之前,肺小动脉环张力负荷0.5 g,每隔15 min 换1次Krebs液,平衡90 min。以高钾Krebs液(含K+60 mmol/L)检验动脉环收缩性,收缩稳定后,2次收缩幅度相差<10%则开始正式用于实验。
2.5.2检测大鼠离体肺小动脉环对不同浓度ACh、SNP和NE的张力变化反应(1)ACh诱导的EDdR:待肺小动脉血管环张力平衡后,用NE(1×10-5mol/L)预收缩引起最大收缩张力后,按浓度累积法向浴槽Krebs液中依次加入(1×10-10~1×10-4) mol/L的ACh,描记张力变化曲线。(2) SNP诱导的EDiR:待张力恢复至初始值,浴槽中先用eNOS抑制剂L-NAME(1×10-4mol/L)孵育30 min后,用NE(1×10-5mol/L)预收缩引起最大收缩张力后,按浓度累积法向浴槽Krebs液中依次加入(1×10-10~1×10-4)mol/L的硝普钠,描记张力变化曲线。(3) NE诱导的收缩:待张力恢复至初始值,按浓度累积法向浴槽Krebs液中依次加入(1×10-10~1×10-5)mol/L的NE,描记张力变化曲线。
以上各步间隔均用37 ℃ Krebs液洗脱30~45 min,每隔15 min 换液1次,待张力恢复至初始值才进行下一步实验。以上溶液、试剂均于实验当天配制。EDdR和EDiR反应表示为血管舒张张力占NE(1×10-5mol/L)预收缩反应的百分比;诱导动脉环收缩反应的程度表示为血管收缩张力占NE(1×10-5mol/L)最大收缩反应的百分比,并计算浓度累积效应曲线的半数效应浓度(EC50),收缩或舒张敏感性用 pD2值表示,即EC50以10为底的负对数值。
2.6荧光显微镜观察分别于荧光标记的ADMSCs早期移植于大鼠后1、2、3周随机各取ADMSCs-EI组大鼠1只,脱臼法处死后取肺组织做冰冻切片,荧光显微镜观察ADMSCs 迁移及定植情况。
3统计学处理
采用SPSS 13.0软件分析。数据以均数±标准差(mean±SD)表示。组间差异应用单因素方差分析,两两比较采用LSD法,量效关系数据采用重复测量数据的方差分析,以P<0.05为差异有统计学意义。
结 果
1大鼠ADMSCs培养、鉴定和荧光标记情况
大鼠ADMSCs原代培养6 h,可见细胞贴壁,呈小圆形,大小不等。2~4 d后细胞伸展,短梭形或小多角形,核呈椭圆形,较大,绝大部分细胞的生长呈现明显的聚集性。1周后集落迅速增多,达到70%~80%融合,予以传代培养。传至第3代,可见细胞形态均一,梭形为主,胞浆丰富,核大,见图1A。流式细胞仪检测第3代ADMSCs表面标志,结果显示细胞表达CD90和CD29阳性率分别为97.9%和86.6%,而CD34、CD45和CD31阳性率仅分别为37.9%、6.2%和0.9%。经Ad5-EGFP重组腺病毒转染ADMSCs,MOI为100时,第3天在荧光显微镜下可见所有ADMSCs均有绿色荧光信号,达到细胞移植标记要求,见图1B。
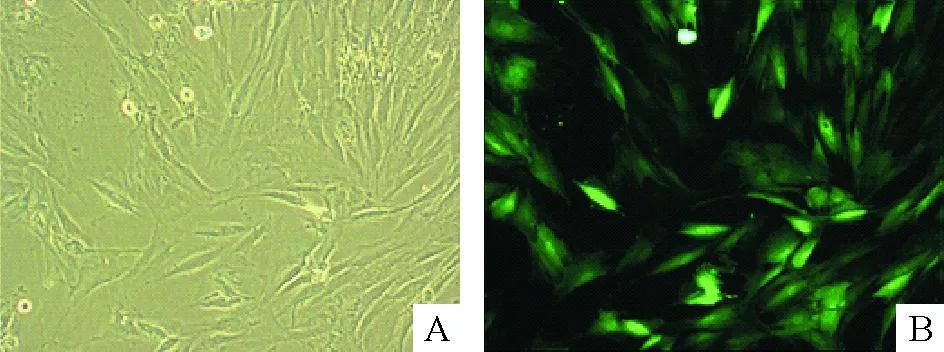
Figure 1. The morphological characteristics and fluorescent labeling of cultured rat ADMSCs (×100).A: phase-contrast microscopic images of log-phase ADMSCs;B: GFP-labeled ADMSCs observed under fluorescence microscope. The transfection efficiency at MOI 100 was >90%.
图1大鼠ADMSCs细胞形态及荧光标记
2GFP标记的ADMSCs在大鼠肺组织中的定植
GFP标记的ADMSCs经颈外静脉移植后迁移到肺循环中, 在早期移植后第1、2、3周,ADMSCs-EI组大鼠的肺组织经冰冻切片荧光显微镜检测发现,其血管壁均可见绿色荧光细胞分布,表明经静脉早期移植的ADMSCs均可以在大鼠肺组织中定植存活,见图2。
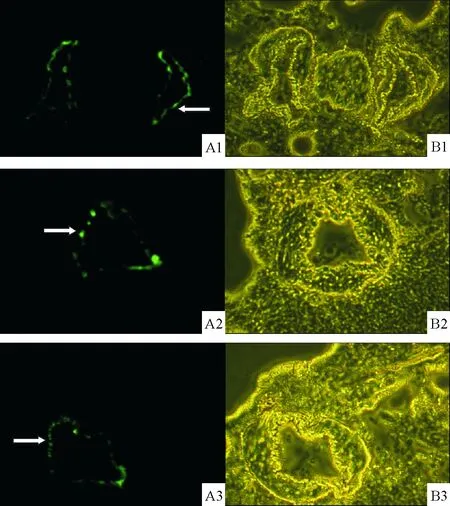
Figure 2. GFP-labeled ADMSCs in lung tissue frozen sections observed under fluorescence microscope (×200). A1~3: fluorescence microscopic images of ADMSCs-EI group, 1, 2 and 3 weeks after early intervention of ADMSCs; B1~3: phase-contrast microscopic images of the same vision. Green fluorescent cells (white arrows) were located in lung vessels.
图2GFP标记的ADMSCs定植于肺组织的荧光显微镜观察
3动物生存质量情况
腹腔注射野百合碱后1周,PAH组大鼠活动逐渐减少,毛发晦涩无光泽,呼吸急促,消瘦,体质量下降或不增;对照组大鼠无上述改变。而PAH组大鼠症状进一步加重,其中2只实验结束前近24 h未进食;ADMSCs-EI组大鼠食欲逐渐恢复,体重渐增加,呼吸平稳,毛发有光泽,活动良好。实验过程中各组动物均无死亡现象。
4ADMSCs早期移植对PAH模型大鼠MPAP的影响
与对照组相比,腹腔注射MCT后3、4周,PAH组大鼠MPAP呈时间依赖性升高(均P<0.05);同时,与PAH组比较,ADMSCs早期移植后2、3周,ADMSCs-EI组大鼠MPAP显著下降(均P<0.05)。在ADMSCs-EI组大鼠中,早期移植后3周与早期移植后1周比较,MPAP明显增高(P<0.05),见表1。
表1ADMSCs早期移植对大鼠肺动脉平均压的影响
Table 1. Changes of mean pulmonary arterial pressure (MPAP) of rats 1,2 and 3 weeks after early transplantation of ADMSCs (mmHg. Mean±SD.n=10)
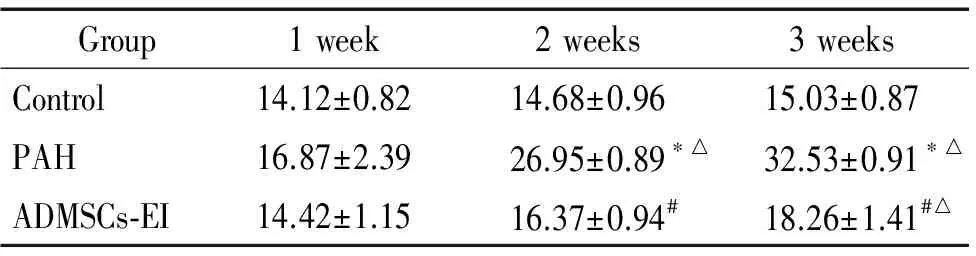
Group1week2weeks3weeksControl14.12±0.8214.68±0.9615.03±0.87PAH16.87±2.3926.95±0.89∗△32.53±0.91∗△ADMSCs⁃EI14.42±1.1516.37±0.94#18.26±1.41#△
*P<0.05vscontrol group;#P<0.05vsPAH group at the same time points;△P<0.05vs1 week in the same group.
5ADMSCs早期移植对PAH模型大鼠肺小动脉EDdR、EDiR以及VCF的影响
与对照组比较,腹腔注射MCT后2周,PAH组大鼠肺小动脉环对不同浓度ACh诱导的EDdR明显减弱,其浓度-效应曲线明显右移,pD2值明显降低(P<0.05);同时,与PAH组相比,ADMSCs早期移植后1周,ADMSCs-EI组大鼠肺小动脉环EDdR明显改善(P<0.05);但是,SNP诱导的EDiR和NE诱导的VCF在3组间无显著差异(均P>0.05)。与对照组相比,腹腔注射MCT后3、4周,PAH组大鼠肺小动脉环的EDdR和EDiR呈显著降低,其浓度-效应曲线显著右移,pD2值显著降低(均P<0.05);同时,与PAH组相比,ADMSCs早期移植后2、3周,ADMSCs-EI组大鼠肺小动脉环EDdR和EDiR明显改善(均P<0.05);但是,NE诱导的VCF在3组间无显著差异(均P>0.05)。在ADMSCs-EI组大鼠中,早期移植后3周与早期移植后1周比较,肺小动脉环的EDdR明显减弱,其浓度-效应曲线明显右移,pD2值明显降低(均P<0.05),见图3。
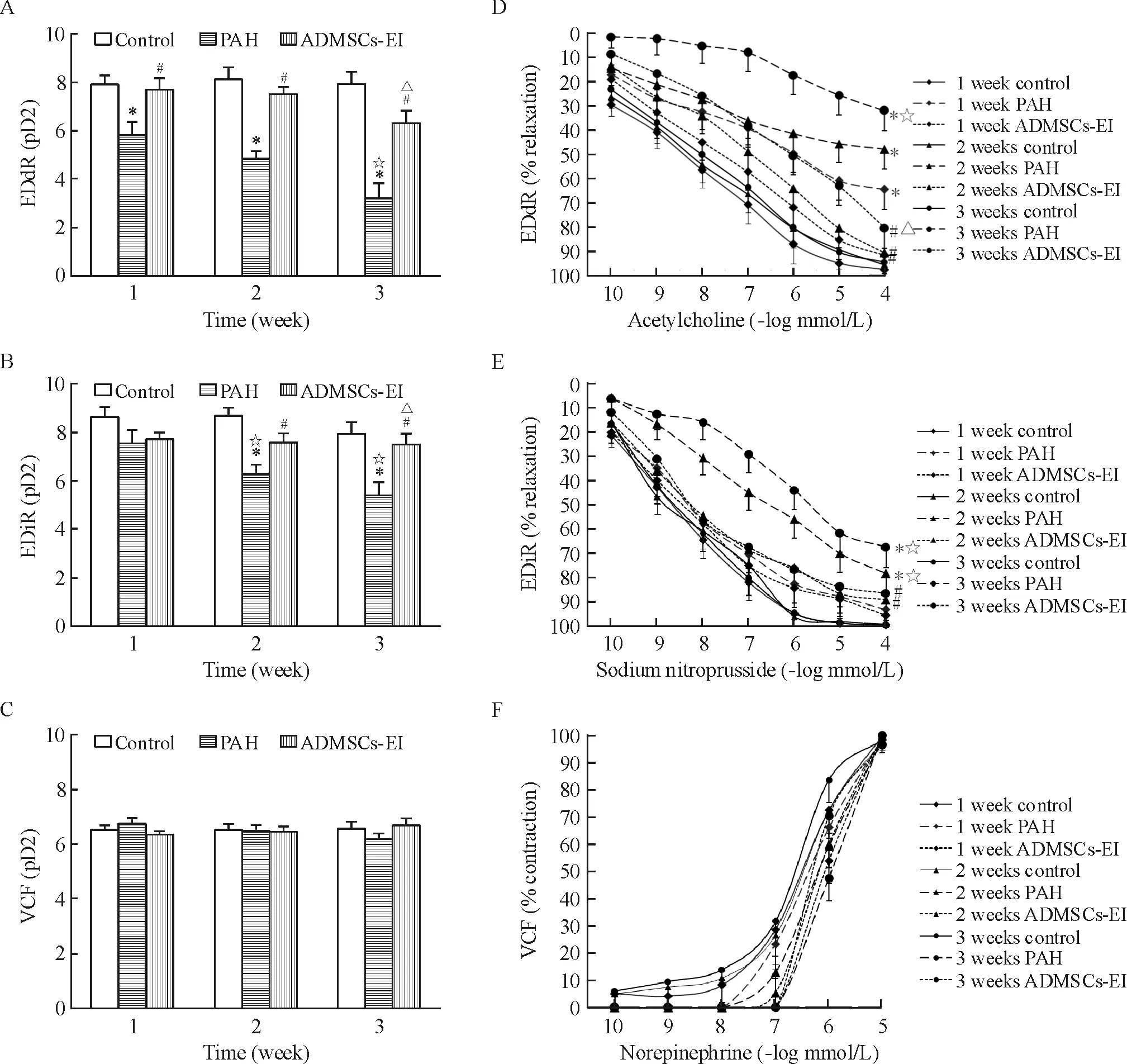
Figure 3. Effects of early transplantation of ADMSCs on pulmonary arteriolar EDdR, EDiR and VCF in MCT-treated rats. A~C: the pD2 values of EDdR, EDiR and VCF; D~F: the % relaxation of EDdR and EDiR, and the % contraction of VCF. Mean±SD.n=8.*P<0.05vscontrol group;#P<0.05vsPAH group;☆P<0.05vsPAH group at 1 week;△P<0.05vsADMSCs-EI group at 1 week.
图3ADMSCs早期移植对MCT模型大鼠肺小动脉EDdR、EDiR、VCF的影响
讨 论
本研究中我们观察到MCT腹腔注射后2周, PAH组大鼠肺小动脉环的EDdR明显减弱,而MPAP和肺小动脉环的EDiR、VCF没有明显变化,提示肺小动脉环的EDdR受损先于肺动脉压力的增高。正常的肺血管舒缩功能依赖于肺血管内皮的完整性,分子水平研究提示肺血管内皮功能受损为肺动脉高压关键始动因素,肺血管内皮受损和功能障碍是肺动脉高压发生发展的主要环节。许多研究[13-15]发现,MCT诱导的肺动脉高压,大鼠肺动脉对ACE的反应性下降,提示着内皮功能受损导致了一氧化氮(nitric oxide, NO)合成、分泌下降,内皮依赖的舒血管能力下降。本研究还观察到MCT腹腔注射后3、4周, PAH组大鼠MPAP呈时间依赖性升高,同时肺小动脉环的EDdR和EDiR呈时间依赖性降低,但是VCF没有明显变化,提示MCT所致大鼠肺动脉压力升高不仅与肺小动脉EDdR受损关系密切,同时还与EDiR密切相关。Muruyama等[16]研究发现,离体的肺小动脉环同时对硝普钠的舒张反应下降,说明MCT诱导PAH大鼠肺血管舒张功能的损伤不仅限于内皮依赖的血管舒张,可能与NO血管舒张作用下游效应有关,包括细胞内环磷酸鸟苷的合成与分解,肺动脉平滑肌细胞内游离钙离子稳态调节异常等。本研究小组前期研究发现MCT诱导PAH大鼠的肺动脉血管重构时,肺动脉平滑肌细胞存在钙离子通道的电压门控钙通道α1C亚单位、兰尼定受体3、肌浆网/内质网Ca2+-Mg2+ATP酶泵2a 及三磷酸肌醇受体1 mRNA和蛋白表达异常[17]。另外,Khan等[18]采用MCT诱导的PAH模型大鼠,一次腹腔注射MCT 60 mg/kg,3周后检测离体叶外型肺动脉环收缩功能,结果显示叶外型肺动脉环对去甲肾上腺素诱导的收缩反应减弱,并认为与Rho激酶活化偶联障碍有关。而本研究尚未发现这种现象,考虑主要可能与所研究的肺动脉部位不同有关。
本研究结果显示,GFP标记的ADMSCs早期经颈外静脉移植后1、2、3周均可以在MCT诱导PAH模型大鼠的肺组织血管壁中定植存活。ADMSCs早期移植MCT诱导PAH模型大鼠后1周,其肺小动脉环的EDdR较PAH组有明显改善;ADMSCs早期移植后2、3周,其MPAP及肺小动脉环的EDdR、EDiR均较PAH组有显著改善。实验动物移植ADMSCs后,生存状况明显改善,食欲渐渐恢复,毛发有光泽,活动良好。本课题组在前期的研究中发现,归巢于PAH模型大鼠体内的ADMSCs能诱导分化为内皮样细胞,并认为ADMSCs对血管内皮有修复功能[7]。脂肪干细胞具有很强的自我增殖能力。在特定的条件下,可以诱导分化为多种组织细胞[19-20]。同时,脂肪干细胞具有一定的旁分泌能力,可以分泌具有生物活性的血管内皮生长因子、肝细胞生长因子等多种促血管生长因子, 促进新生血管形成,加速内皮细胞的生长,修复损伤的内皮[21-22]。何志旭等[23]研究发现骨髓间充质干细胞移植后可通过形成新生血管建立侧枝循环,有效减轻野百合碱诱导的肺动脉高压和肺组织病变程度。Liu等[24]报道了ADMSCs治疗利用动静脉分流的方法建立的肺高血流量诱导的PAH模型大鼠。分流术造模12周后,给予大鼠静脉注射5×107ADMSCs,细胞移植2周后,结果显示,细胞移植的PAH大鼠血流动力学异常和右心室肥厚发生逆转,肺小动脉重塑改善;同时,HGF和eNOS表达增强,肺血管床数量增加,改善肺血管阻力。本课题组前期采用ADMSCs治疗MCT诱导的PAH模型大鼠,一次腹腔注射MCT 40 mg/kg,2周后给予ADMSCs治疗,结果显示肺动脉压力明显降低且肺小动脉重塑明显改善[8]。同时研究发现,ADMSCs降低肺动脉压力可能与钙离子通道变化有关[25]。另外,本课题组研究发现脂肪组织基质血管组分移植可明显改善阿霉素诱导的心力衰竭大鼠心功能,部分机制可能与促进心肌组织血管再生有关。因此,我们有理由认为ADMSCs移植治疗可以修复受损的内皮,并改善内皮依赖与非内皮依赖的舒血管作用及分泌舒血管因子,调节血管张力和促进血管新生。
另外,本研究还发现在ADMSCs-EI组大鼠中,早期移植后3周与早期移植后1周比较, MPAP仍是升高,肺小动脉环的EDdR仍是减弱,因此,我们推测ADMSCs早期干预,仅是延缓MCT诱导的肺动脉高压和肺小动脉血管功能损害的进展。因此,目前关于ADMSCs移植的最佳时机仍需要进一步研究。
[参考文献]
[1]Zhao Q, Liu Z, Wang Z,et al. Effect of prepro-calcitonin gene-related peptide-expressing endothelial progenitor cells on pulmonary hypertension[J]. Ann Thorac Surg, 2007, 84(2): 544-552.
[2]Raoul W, Wagner-Ballon O, Saber G, et al. Effects of bone marrow-derived cells on monocrotaline- and hypoxia-induced pulmonary hypertension in mice[J]. Respir Res, 2007, 8:8.
[3]Zeng C, Wang X, Hu X, et al. Autologous endothelial progenitor cells transplantation for the therapy of primary pulmonary hypertension[J]. Med Hypotheses, 2007, 68(6):1292-1295.
[4]McIntosh K, Zvonic S, Garrett S, et al. The immunogenicity of human adipose-derived cells: temporal changesinvitro[J]. Stem Cells, 2006, 24(5):1246-1253.
[5]Madonna R, De Caterina R.Invitroneovasculogenic potential of resident adipose tissue precursors[J]. Am J Physiol Cell Physiol, 2008, 295(5): C1271-C1280.
[6]Madonna R, De Caterina R. Adipose tissue: a new source for cardiovascular repair[J]. J Cardiovasc Med, 2010, 11(2): 71-80.
[7]陈明, 谢良地, 谢镇国, 等. 脂肪间充质干细胞的归巢研究[J].中华心血管病杂志, 2011, 39(5 Suppl): 455.
[8]谢镇国,谢良地,陈明, 等.脂肪间充质干细胞对野百合碱诱发的大鼠肺动脉重构的影响[J].中华心血管病杂志, 2011, 39(5 Suppl): 345.
[9]庄伟, 谢良地, 黄杰, 等. 人脂肪组织基质血管组分的分离培养[J]. 福建医科大学学报, 2008, 42(3): 256-258.
[10] 连帆, 王子, 范文哲, 等. 经肝动脉同种异体脂肪干细胞移植治疗小鼠自身免疫性肝炎的实验研究[J].中国病理生理杂志, 2011, 27(7): 1389-1392.
[11] 林培森, 谢筱露, 谢良地, 等. 大鼠肺小动脉重构发生在肺动脉压增高之前[J]. 中华高血压杂志, 2007, 15(10): 839-843.
[12] 孙波,刘文利. 右心导管测定大鼠肺动脉压的实验方法[J]. 中国医学科学院学报,1984, 6(6): 465-466.
[13] Madden JA, Keller PA, Effros RM, et al. Responses to pressure and vasoactive agents by isolated pulmonary arteries from monocrotaline-treated rats[J]. J Appl Physiol, 1994, 76(4): 1589-1593.
[14] Mathew R, Zeballos GA, Tun H, et al. Role of nitric oxide and endothelin-1 in monocrotaline-induced pulmonary hypertension in rats[J]. Cardiovasc Res, 1995, 30(5): 739-746.
[15] Mathew R, Huang J, Shah M, et al. Disruption of endothelial-cell caveolin-1alpha/raft scaffolding during development of monocrotaline-induced pulmonary hypertension[J]. Circulation, 2004, 110(11): 1499-1506.
[16] Muruyama J, Maruyama K. Impaired nitric oxide-depen-dent responses and their recovery in hypertensive pulmonary arteries of rat[J]. Am J Physiol, 1994, 266(6 Pt 2): H2476-H2488.
[17] Xie L,Lin P,Xie H, et al. Effects of atorvastatin and losartan on monocrotaline-induced pulmonary artery remo-deling in rats[J]. Clin Exp Hypertens, 2010, 32(8): 547-554.
[18] Khan I, Oriowo MA, Chandrasekhar B, et al. Attenuated noradrenaline-induced contraction of pulmonary arteries from rats treated with monocrotaline: role of rho kinase[J]. J Vasc Res, 2005, 42(5): 433-440.
[19] van Dijk A, Niessen HW, Zandieh Doulabi B, et al. Differentiation of human adipose-derived stem cells towards cardiomyocytes is facilitated by laminin[J]. Cell Tissue Res, 2008, 334(3): 457-467.
[20] Madonna R, Willerson JT, Geng YJ. Myocardin A enhances telomerase activities in adipose tissue mesenchymal cells and embryonic stem cells undergoing cardiovascular myoge-nic differentiation[J]. Stem Cells, 2008, 26(1): 202-211.
[21] Rehman J, Traktuev D, Li J, et al. Secretion of angioge-nic and antiapoptotic factors by human adipose stromal cells[J]. Circulation, 2004, 109(10): 1292-1298.
[22] Nakagami H, Maeda K, Morishita R, et al. Novel autologous cell therapy in ischemic limb disease through growth factor secretion by cultured adipose tissue-derived stromal cells[J]. Arterioscler Thromb Vasc Biol, 2005, 25(12): 2542-2547.
[23] 何志旭, 汪浩文, 尚峰, 等. 骨髓间充质于细胞治疗实验性肺动脉高压后肺组织结构的变化[J]. 中国病理生理杂志, 2009, 25(10): 1907-1911.
[24] Liu K, Liu R, Cao G, et al. Adipose-derived stromal cell autologous transplantation ameliorates pulmonary arterial hypertension induced by shunt flow in rat models[J]. Stem Cells Dev, 2011, 20(6):1001-1010.
[25] 郑苏梨, 谢良地, 李宏亮, 等. 脂肪间充质干细胞对野百合碱诱发的肺动脉高压大鼠肺动脉钙离子通道的影响[J]. 中国病理生理杂志, 2013, 29(6): 961-968.
