沉默bim的表达对缺氧所致大鼠心肌细胞凋亡的影响*
2013-12-01李菊香孙国芳吴延庆程晓曙
夏 珍, 李菊香, 丁 浩, 孙国芳, 洪 葵, 吴延庆, 程晓曙
(南昌大学第二附属医院心内科,江西省分子中心医学重点实验室,江西南昌330006)
冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease),由于冠状动脉管腔粥样硬化而狭窄或阻塞,导致心肌缺血和缺氧而引起的心脏病,具有较高的致病率和致死率。心绞痛、心肌梗死和缺血性心脏病等共同的病理基础都是心肌缺血缺氧,导致细胞凋亡[1]。因此,如何保护缺血损伤的心肌细胞是医学上急待解决的问题。
Bim是Bcl-2家族中仅含BH3结构功能域的重要促凋亡蛋白。DNA损伤、血清饥饿、紫杉醇等刺激均可影响Bim的表达来引起细胞的凋亡[2-4]。Bim作为细胞凋亡的关键调控蛋白,对于缺氧损伤诱导的心肌细胞凋亡发挥了怎样的生物学作用,是否介导了缺氧刺激诱导心肌细胞凋亡,目前在国内外未见报道。在本研究中,我们首先原代培养心肌细胞,通过小干扰RNA技术沉默bim的表达,然后建立缺血缺氧损伤模型,观察Bim在缺氧诱导心肌细胞凋亡中的作用,为今后将Bim作为阻断缺氧诱导心肌细胞凋亡的靶点奠定基础。
材料和方法
1 材料
1.1 动物 出生1~3 d Sprague-Dawley大鼠,由南昌大学医学院实验动物科学部提供,动物合格证为医动字021-9602。
1.2 主要试剂 DMEM培养基和胎牛血清购自Gibco。抗α-横纹肌肌动蛋白免疫组化试剂盒和FITC羊抗兔IgG购自武汉博士德。MTT细胞存活率检测试剂盒购自Ameresco。Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物有限公司。总蛋白提取试剂盒购自普利莱基因技术有限公司。脂质体Lipofectamine 2000购自Invitrogen。bim-siRNA购自Invitrogen。I抗 Bim、p-p38 MAPK、p38 MAPK、Bax、Bcl-2及β-actin购自Santa Cruz。II抗辣根过氧化物酶IgG购自北京中杉金桥公司。
2 方法
2.1 原代心肌细胞培养及鉴定 取出生1~3 d乳鼠心脏,用含双抗(青霉素+链霉素)的磷酸盐缓冲液清洗3次,剥除筋膜、脂肪等多余组织,用剪刀将心脏剪成1 mm×1 mm×1 mm大小的组织,用0.08%胰酶和1.00%Ⅱ型胶原酶消化组织,离心收集细胞以15%胎牛血清的DMEM培养基充分重悬,200目滤网过滤细胞悬液至培养皿,置37℃、5%CO2培养箱培养,经差速贴壁2 h,使成纤维细胞贴壁。然后小心吸出未贴壁心肌细胞悬液接种到放有盖玻片的培养皿中,加入0.1%BrdU抑制成纤维细胞的增殖。24 h后第1次换液,48 h后取出玻片,用37℃ PBS漂洗,4%甲醛固定,加大鼠抗α-横纹肌肌动蛋白单克隆Ⅰ抗1∶50,于4℃湿盒过夜,加FITC羊抗小鼠IgG 1∶50,孵育30 min,缓冲盐水洗2次,DAPI封片剂染核,显微镜下观察。
2.2 缺氧模型的建立和转染 配置模拟缺氧溶液,以95%N2~5%CO2预饱和1 h,置换正常培养基,放入缺氧盒中通95%N2~5%CO230 min后密闭缺氧盒,放置于37℃孵箱中缺氧。我们通过前期实验,发现Bim在心肌细胞缺氧12 h表达最高。将bim-siRNA和阴性对照siRNA通过脂质体转染乳鼠心肌细胞。按操作说明用不含血清的DMEM培养基稀释适当量的Lipofectamine 2000和bim-siRNA混合形成转染试剂混合液,加入心肌细胞密度为90% 的6孔板中,轻轻摇晃混合。在CO2培养箱中培养6 h后换有血清的培养基培养。转染48 h后,将心肌细胞置于缺氧盒中缺氧12 h。实验分为5组:(1)正常对照组;(2)缺氧组;(3)缺氧+阴性对照siRNA组;(4)缺氧+脂质体组;(5)缺氧+bim-siRNA组。Invitrogen公司设计、合成了3对bim-siRNA序列,将3对bim-siRNA转染心肌细胞,筛选沉默效率最高的Bim-siRNA用于后续实验。siRNA-1上游引物5’-AACAGAUGUAAGUUAACGAUUUCCG-3’,下游引物5’-UGGUCAAUACUACAUGUGAUACCUU-3’;siRNA-2上游引物 5’-AACAGUUGUAAGAUAACCAUUU-GCG-3’,下游引物 5’-CGCAAAUGGUUAUCUUACAACUGUU-3’;siRNA-3 上游引物 5’-ACAGAUUGUAGAUACAACAUUUGCG-3’,下游引物 5’-CAUGGUUCGUAAUACAACUGACUUU-3’;阴性对照:上游引物 5’-GUCCUCGACCUAGUUACGUTT-3’,下游引物5’-UCUAGACACAGUCGGAGAGTT-3’。
2.3 心肌细胞搏动率和节律 在倒置显微镜下连续观察60 s,分别计数10个高倍视野有自发搏动的细胞个数,进行摄像记录心肌细胞自发搏动频率。细胞搏动率(%)=搏动细胞数/细胞总数×100%。同时观察心肌细胞搏动节律的变化情况。
2.4 乳酸脱氢酶(lactate dehydrogenase,LDH)活性的测定 将各组经不同处理后的细胞培养液收集起来,取适量利用全自动生化分析仪测定LDH的活性。
2.5 MTT法测定细胞存活率 取96孔板种植细胞,密度为1×105cells/well,空白孔加不含细胞的培养液(每组4孔)。经实验干预后,每孔加入20μL MTT溶液(5 g/L),避光,继续温育4 h,小心吸弃上清,终止培养,然后加入150μL DMSO,摇床振摇15 min,使结晶充分溶解,酶标仪读取492 nm处吸光度(absorbance,A)。结果以细胞存活率表示。细胞存活率(%)=处理组A值/对照组A值×100%。
2.6 流式细胞术检测细胞凋亡率 转染48 h、缺氧12 h后用胰酶消化收集各组细胞。按Annexin VFITC试剂盒提供的操作说明,主要步骤为:用胰酶消化收集细胞,PBS洗涤细胞2次,加入500μL Binding Buffer重悬细胞,分别加入 Annexin V-FITC及PI各5μL混匀,室温避光反应5~15 min后,在1 h内用流式细胞仪检测各组细胞凋亡率。
2.7 Western blotting检测各蛋白表达水平 取各组心肌细胞,根据总蛋白提取试剂盒提取细胞总蛋白,用全自动生化分析仪(Beckman)测定蛋白质浓度。根据蛋白浓度取适量进行SDS-PAGE电泳分离蛋白。将蛋白转移到硝酸纤维素膜后,将膜置于5%脱脂奶粉的TBST中摇床上封闭2 h,用TBST洗膜10 min,共 3 次,分别用 Bim、Bax、Bcl-2、p-p38 MAPK、p38 MAPK和β-actin的I抗按适当比例4℃孵育过夜,再洗膜3次,加入辣根过氧化物酶标记的小鼠抗兔IgG孵育2 h,最后洗膜3×10 min,进行显色,胶片曝光,结果用LabWorks 3.0软件,以目的条带/β-actin的灰度值进行分析。
3 统计学处理
数据以均数 ±标准差(mean±SD)表示,采用SPSS13.0统计软件包进行软件分析,多组间比较采用方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
结 果
1 原代心肌细胞的成功培养及鉴定
于倒置显微镜下观察,细胞呈放射状、不规则三角形或梭形,并伸出伪足相互接触交织成网,呈片状有节律搏动。免疫组化结果显示,抗体阳性的心肌细胞胞浆内可见棕色颗粒,见图1。
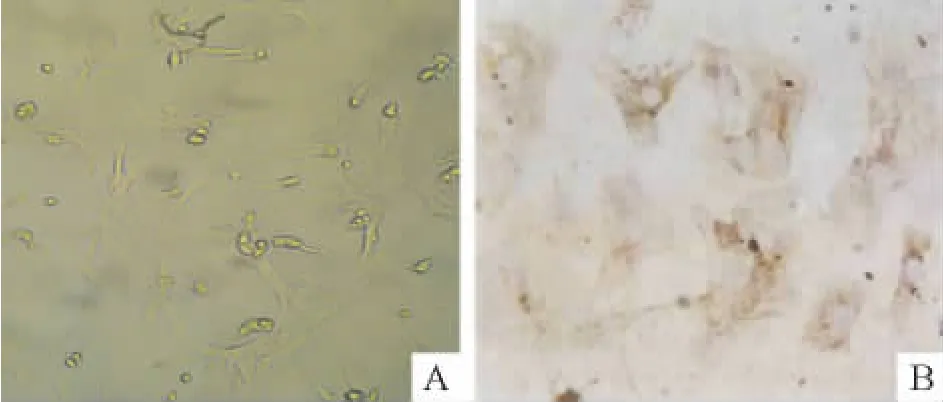
Figure 1.Identification of the cardiomyocytes(×200).A:inverted microscopy;B:immunohistochemical staining forα-actin of striated muscle.图1 心肌细胞的鉴定
2 筛选有效bim-siRNA
与阴性对照siRNA组比较,3对bim-siRNA均能显著降低Bim蛋白的表达,其中以第2对沉默效率最高(P <0.01),其沉默效率达86.73%,见图 2。
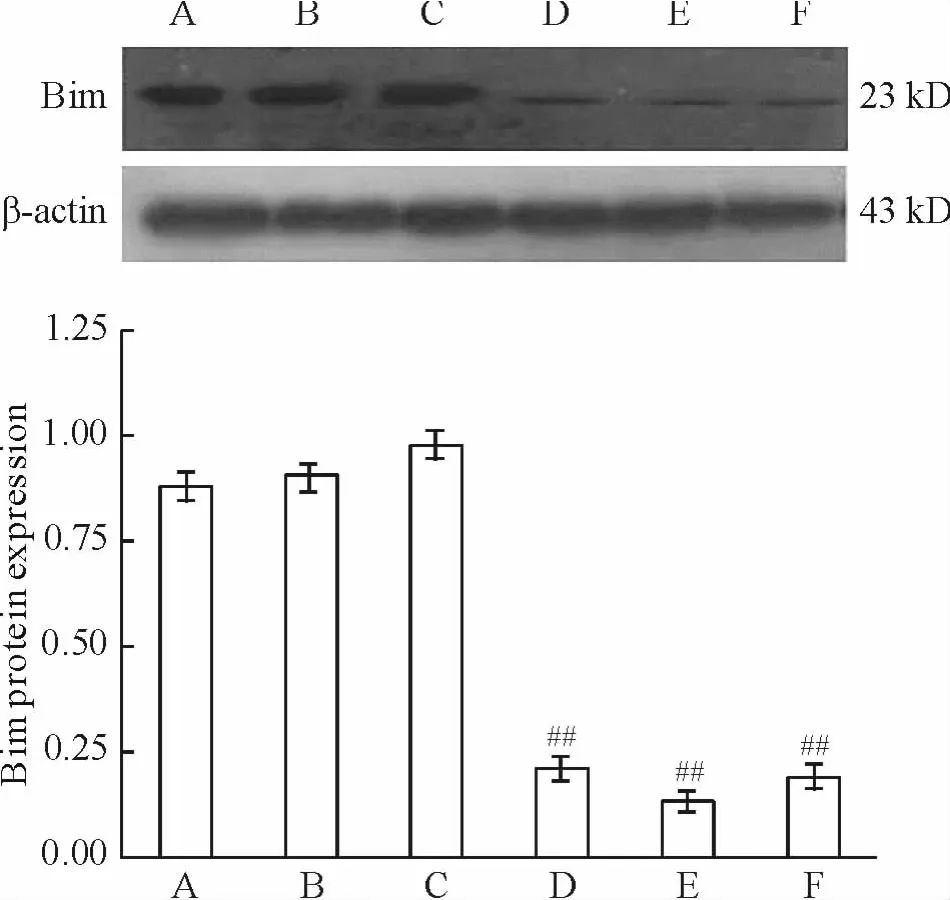
Figure 2.The effects of siRNAs on expression of Bim.A:hypoxia group;B:hypoxia+liposome group;C:hypoxia+negative control siRNA group;D:hypoxia+siRNA-1 group;E:hypoxia+siRNA-2 group;F:hypoxia+siRNA-3 group.Mean ± SD.n=6.##P <0.01 vs hypoxia+negative control siRNA group.图2 bim-siRNA转染心肌细胞对Bim表达的影响
3 转染bim-siRNA和缺氧对心肌细胞搏动频率和节律的影响
空白对照组心肌细胞搏动频率为150 beats/min左右,搏动呈同步性,收缩明显而有力,节律规则;缺氧刺激后心肌细胞搏动频率显著减慢(P<0.01),搏动幅度减小,节律不规则;而转染bim-siRNA能抑制缺氧导致的这一作用(P<0.05或 P<0.01),见表1。
4 转染bim-siRNA和缺氧对心肌细胞LDH释放、细胞存活率及凋亡率的影响
与空白对照组比较,缺氧组心肌细胞培养液中LDH活性明显增高(P<0.01),细胞存活率明显降低(P <0.05),细胞凋亡率明显增高(P <0.01);而进行bim-siRNA转染后,心肌细胞培养液中LDH较缺氧+阴性对照siRNA组明显下降(P<0.01),细胞存活率明显增加(P<0.05),细胞凋亡率明显下降(P<0.01),而阴性对照siRNA组则与缺氧组无明显差异,见表2、图3。这说明通过 RNA干扰下调Bim表达能抑制缺氧导致心肌细胞的凋亡。
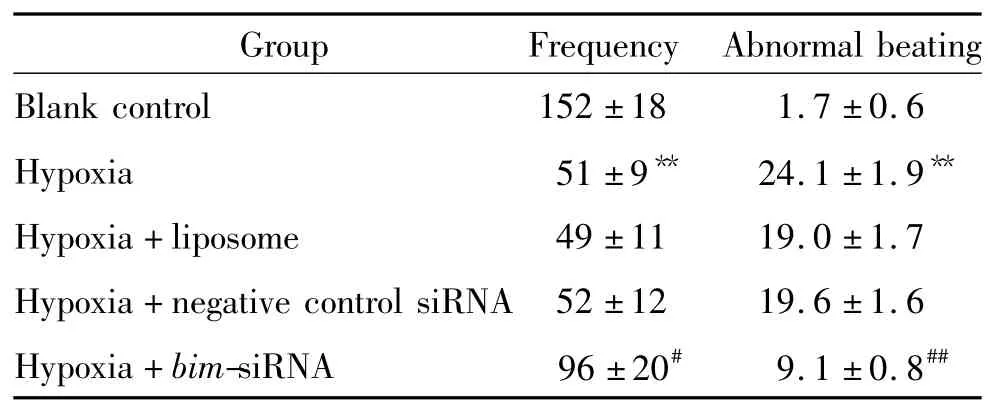
表1 转染bim-siRNA和缺氧对心肌细胞搏动频率和节律的影响Table 1.The changes of frequency and rhythm of cardiomyocyte beating after bim-siRNA transfection and hypoxia(beats/min.Mean ±SD.n=8)
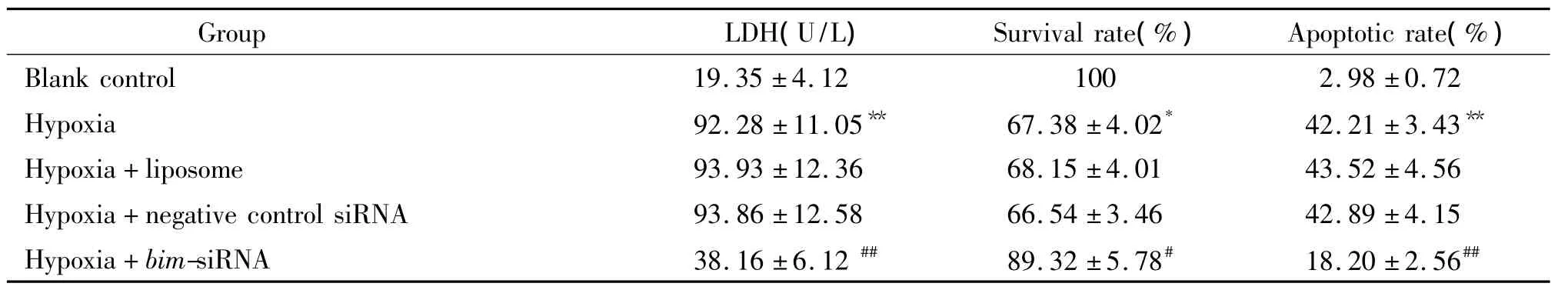
表2 转染bim-RNA和缺氧对心肌细胞LDH释放、细胞存活率及细胞凋亡率的影响Table 2.The changes of LDH release,survival rate and apoptotic rate of cardiomyocytes treated with Bim-siRNA transfection and hypoxia(Mean±SD.n=8)
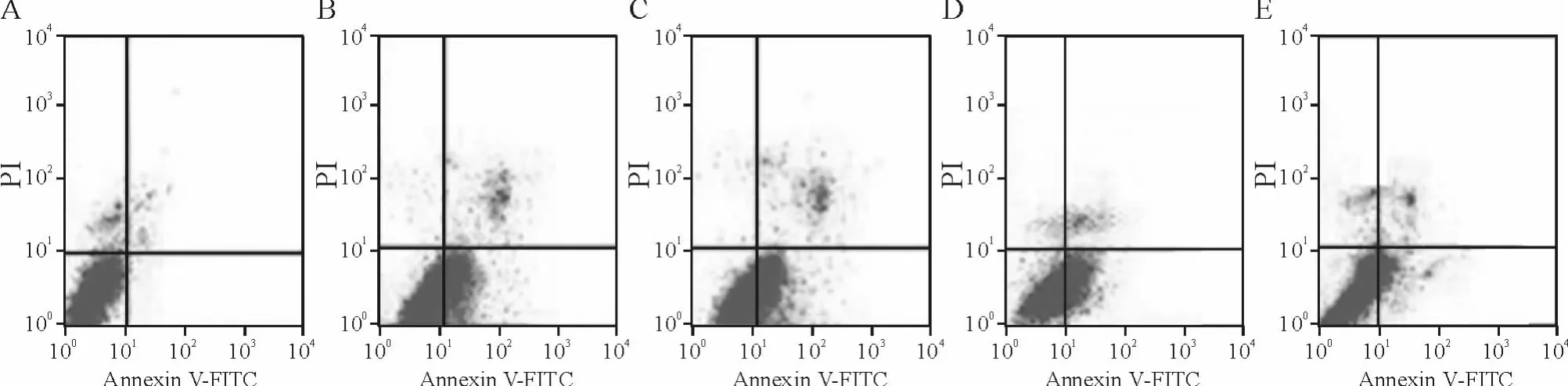
Figure 3.The changes of apoptotic rate of cardiomyocytes treated with bim-siRNA transfection and hypoxia.A:blank control group;B:hypoxia group;C:hypoxia+liposome group;D:hypoxia+negative control siRNA group;E:hypoxia+bim-siRNA group.图3 转染bim-siRNA和缺氧对心肌细胞凋亡率的影响
5 Western blotting检测心肌细胞 Bax、Bcl-2、pp38 MAPK和p38 MAPK蛋白表达水平
Western blotting结果显示,与空白对照组比较,缺氧干预后,心肌细胞内p-p38 MAPK和Bax的表达明显增加(P <0.05),Bcl-2表达下降(P <0.01);而通过bim-siRNA转染下调Bim表达后,能抑制缺氧导致的这一作用(P<0.05),而p38 MAPK表达无明显变化。缺氧组与缺氧+阴性对照siRNA组、缺氧+脂质体组之间相比,差异无统计学意义(P>0.05),见图4。
讨 论
Bim是Bcl-2家族中仅含BH3结构域的促凋亡蛋白,是一种重要的凋亡调节蛋白。它广泛分布于机体各种组织,与调节细胞凋亡的功能密切相关,具有促凋亡活性。在正常细胞中,Bim与细胞浆中的微管蛋白相结合,形成复合体,此时的Bim是无活性的,当受到凋亡信号刺激后,Bim就会从复合体上解离出来游离在细胞浆中,激活 caspase酶联反应,最终导致细胞凋亡。有研究表明,Bim在三氧化二砷诱导卵巢癌细胞的凋亡的过程中发挥重要作用,它是调控三氧化二砷诱导卵巢癌细胞化疗敏感和耐药的主要机制[5]。Bim可直接促进糖皮质激素诱导淋巴细胞恶性肿瘤的凋亡[6]。而关于Bim在缺血缺氧刺激下对心肌细胞凋亡的作用报道甚少,沉默bim的表达对缺氧致心肌细胞凋亡的影响目前尚未见报道。因此,本实验利用原代培养的心肌细胞制备缺氧损伤模型,模拟临床上心肌缺血缺氧损伤诱导细胞凋亡,用小干扰RNA沉默bim的表达,观察心肌细胞凋亡的变化情况。结果显示,缺氧损伤可诱导心肌细胞的凋亡,降低其存活率,增加p-p38 MAPK和Bax的表达,降低Bcl-2的表达;而下调Bim的表达能抑制缺氧损伤导致的上述作用。
越来越多的研究表明,心血管疾病的发生发展是基于细胞凋亡的基础之上的[7-8]。多种刺激均可诱导心肌细胞凋亡,如缺氧、缺血再灌注、氧化应激及肿瘤坏死因子α[9-11]。在本实验研究中我们可以得出,心肌细胞缺氧损伤后,细胞的存活率下降、LDH释放量增加、凋亡率明显升高,而下调Bim的表达能够降低缺氧对心肌细胞的损伤作用、提高心肌细胞的存活率,减少LDH的释放。说明下调Bim的表达对缺血缺氧造成的心肌细胞损伤具有保护作用,这也为心肌缺血缺氧性疾病的治疗提供一种可能途径。
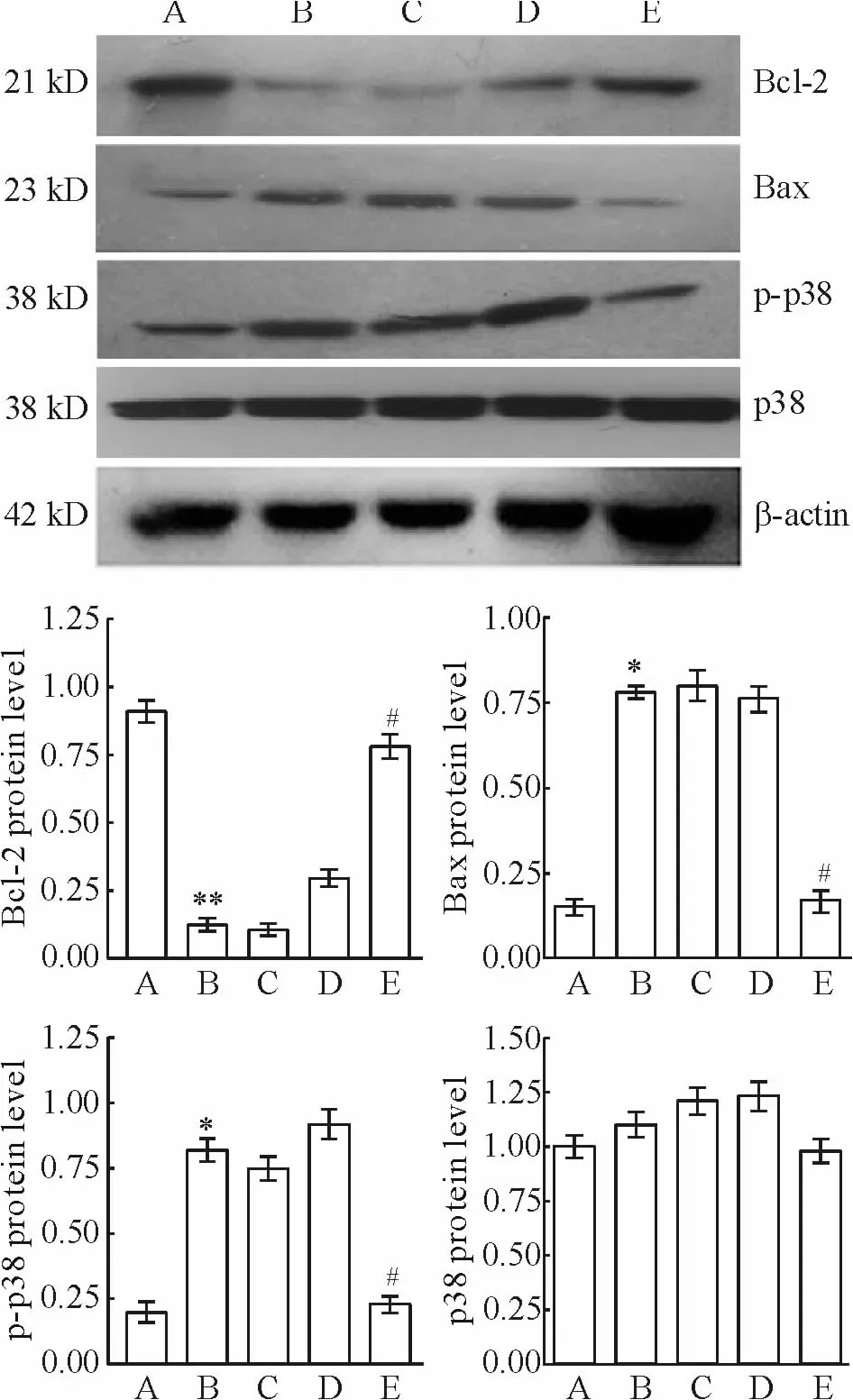
Figure 4.The changes of Bax,Bcl-2,p-p38 MAPK and p38 MAPK protein levels in cardiomyocytes treated with bim-siRNA transfection and hypoxia.A:blank control group;B:hypoxia group;C:hypoxia+liposome group;D:hypoxia+negative control siRNA group;E:hypoxia+bim-siRNA group.Mean ± SD.n=8.*P <0.05,**P <0.01 vs blank control group;#P < 0.05 vs hypoxia+negative control siRNA group.图4 转染bim-siRNA和缺氧处理后心肌细胞Bax、Bcl-2、pp38 MAPK和p38 MAPK蛋白表达水平的变化
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族在细胞生物学活动中发挥重要作用,可调节多种细胞的基因转录、增殖、分化和凋亡[12]。p38是MAPK家族中一个重要的细胞内信号通路,有研究报道,氧化应激、缺血再灌注损伤等通过下调p38表达,进而减少或抑制心肌细胞的凋亡[13-14]。研究表明,丝裂原活化蛋白激酶在心脏疾病的诱导和应激刺激下,参与肥大、重塑、收缩和心脏衰竭等过程,通过抑制 p38 MAPK信号通路,Dusp1/4基因才能发挥心脏保护作用[15]。Bim诱导缺血缺氧的心肌细胞凋亡,涉及复杂的细胞内信号转导途径,至今尚未阐明。文献报道,Bim诱导心肌细胞凋亡受PI3K/Akt、JNK等多种途径的影响[16-17]。也有文献报道,p38 MAPK信号转导途径参与了Bim诱导细胞凋亡的过程[18]。在本实验中我们观察缺氧后以及沉默bim表达后心肌细胞内p38 MAPK和磷酸化p38 MAPK的表达水平。结果显示:缺氧损伤使磷酸化的p38 MAPK水平升高,细胞凋亡率增加,说明缺氧损伤激活了p38 MAPK信号通路。Bim表达下调能够抑制缺氧导致磷酸化的p38 MAPK蛋白表达升高的作用,进一步证明下调bim的表达可抑制缺氧导致的心肌细胞凋亡的作用,同时也说明Bim可能通过p38 MAPK途径介导缺氧致心肌细胞损伤。bax是促凋亡基因,bcl-2是抑制凋亡基因。Bax蛋白表达下降、Bcl-2蛋白表达升高表明细胞凋亡被抑制。本实验结果显示,心肌细胞予缺氧处理后,促凋亡蛋白Bim水平升高,Bax表达上调,Bcl-2表达下降,而沉默bim的表达可抑制缺氧导致的上述作用,再次证明下调Bim的表达能抑制缺氧诱导的心肌细胞凋亡的作用。
综上所述,下调Bim的表达能抑制缺氧所致的心肌细胞存活率下降、凋亡率增加,进而发挥心肌保护作用,其机制可能与抑制p38 MAPK、Bax水平及增强Bcl-2表达有关。这为冠心病的临床治疗提供一个新思路。
