原发性干燥综合征患者毒蕈碱型乙酰胆碱受体亚型3及其受体的变化及临床意义
2013-04-09黄翠平周京国谢文光青玉凤胡程飞
黄翠平,周京国,谢文光,青玉凤,殷 玲,胡程飞
(川北医学院附属医院风湿血液科,四川南充 637000)
ChinJAllergyClinImmunol, 2013, 7(2):120-124
干燥综合征(Sjogren’s syndrome,SS)分为原发性干燥综合征(primary Sjogren’s syndrome, pSS)和继发性干燥综合征(secondary Sjogren’s syndrome, sSS),是以泪腺及唾液腺等外分泌腺体受累为主的慢性炎性自身免疫性疾病。主要临床特点为泪腺和唾液腺分泌减少,形成干燥性角膜结膜炎和口腔干燥,也可累及呼吸道、消化道、泌尿道、神经、肌肉、关节等,造成多系统、多器官受损。pSS是不伴有其他任何疾病的单纯性SS;sSS患者除了SS以外,还合并类风湿关节炎、系统性红斑狼疮、系统性硬化等其他疾病。国内成人pSS患病率为0.29%~0.77%,30~50岁女性占全部pSS病例的90%左右[1]。希腊2006年流行病学调查显示pSS患病率为0.09%[2]。pSS的发病主要与环境、遗传、免疫及内分泌代谢有关,但具体发病机制至今仍不清楚。
毒蕈碱型乙酰胆碱受体(muscarinic acetylcholine receptor),简称M受体,是一种单链跨膜糖蛋白,属于G蛋白偶联受体超家族,起着在周围神经系统介导腺体分泌、平滑肌收缩、心肌收缩等重要生理功能。M受体蛋白相对分子质量约51 000~66 000,由460~590个氨基酸残基组成,N端在胞膜外,C端在胞质内,7次跨过细胞膜。M型受体已分出多种亚型,其中毒蕈碱型乙酰胆碱受体亚型3(muscarinic acetylcholine receptor M3,CHRM3)主要分布在外分泌腺上,神经和平滑肌也有少量分布。乙酰胆碱(acetylcholine,ACh)与腺体腺泡细胞膜上CHRM3结合后,引起泪腺、气管和支气管腺体、唾液腺、消化道腺体和汗腺分泌增加。
本文应用实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测pSS患者CHRM3 mRNA表达,用酶联免疫吸附试验检测pSS患者血浆中抗毒蕈碱型乙酰胆碱受体M3亚型抗体(M3 muscarinic acetylcholine receptor antibody,CHRM3-Ab)浓度,并与临床指标进行分析,以探讨其在pSS发病机制中可能的作用。
材料和方法
研究对象及分组
pSS组:选择川北医学院附属医院风湿科2010年4月至2011年12月门诊及住院pSS患者43例,诊断均符合2002年pSS的欧洲修订分类诊断标准[3]。正常对照组:同期29名川北医学院附属医院健康体检女性。收集pSS患者及健康体检女性临床资料及实验室指标。本研究得到当地伦理委员会支持,且所有参与者均知情同意。
方法
主要仪器和试剂:低温高速离心机5417R(Eppendorf公司,USA),7900 Real-Time PCR仪(ABI公司,USA),Beckman Immage免疫分析仪(Beckman公司,USA)。荧光染料试剂盒Power SYBR Green PCR Master Mix(ABI公司,USA),TRIZOL试剂(Invitrogen公司)。
pSS患者常规检测指标测定:血细胞沉降率(erythrocyte sedimentation rate, ESR)按魏氏法进行操作,类风湿因子(rheumatoid factor, RF)与C反应蛋白(C-reaction protein,CRP)用速率散射比浊法(rate nephelometry method)检测,使用美国Beckman公司Immage免疫分析仪,试剂为Beckman公司配套试剂。
总RNA提取及cDNA合成:采用抽签法随机选择21例pSS患者及24名健康女性,收集其晨起空腹外周静脉血,去血浆血液用磷酸盐缓冲液补充至原体积,将制备好的细胞悬液缓慢置于等体积淋巴细胞分离液上,离心后吸取白色云雾状细胞,再离心洗涤后加入Trizol试剂(Invitrogen),充分震荡混匀放置5 min,再添加氯仿,混匀后室温静置3 min;离心后吸出上层水相至另一eppendorf微型离心管,加等体积异丙醇并充分混匀,室温静置30 min;离心、弃上清液,加入1 ml 75%乙醇洗涤沉淀,离心后吸干乙醇,空气中干燥;加入无RNA酶溶解RNA。取RNA样品电泳,在1.0%普通琼脂糖凝胶图谱中显示3条带,紫外分光光度仪测定A260/A280(1.8~2.0者采用)。取总RNA于42℃反应60 min,逆转录为cDNA,冻存于-40℃备用。
CHRM3及内参β-actin基因表达的实时荧光定量PCR检测:实时荧光定量PCR检测两组外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)CHRM3转录水平。用于扩增CHRM3及内对照β-actin基因的引物由上海生工生物工程公司合成,序列如表1所示。CHRM3的PCR产物为107 bp,β-actin的PCR产物为128 bp。采用25 μl反应体系,包括12.5 μl Power SYBR Green PCR Master Mix,各1 μl 10 pmol/L 引物,2 μl cDNA,8.5 μl双蒸水。反应条件为95℃ 10 min 先预热,再95℃ 1 min,60℃ 15 s,72℃ 1 min,共40个循环,最后延伸72℃ 5 min。每份标本均作复孔,复孔间的Ct值差异控制在0.5以内。所有扩增均在ABI 7900 Real-Time PCR仪上进行。
反应结束后作溶解曲线。以目的基因的Ct值减去内参的Ct值为△Ct,2-△Ct值表示目的基因mRNA表达水平的高低。

表1 CHRM3及内对照β-actin基因的引物序列
CHRM3:毒蕈碱型乙型胆碱受体亚型3
酶联免疫吸附试验检测两组血浆CHRM3-Ab浓度:采集43例pSS患者及29名健康女性晨起空腹外周静脉血,分离出血浆并分装,所有血浆样品在-80℃ 冻存。在酶标包被板上设标准品、空白、待测样品孔,待测样品最终稀释5倍;置37℃温育30 min 后反复洗涤待测孔5次,拍干后每孔加入酶标试剂,再置37℃温育30 min后重复上述洗涤过程,拍干后每孔先加入显色剂A,再加入显色剂B,轻轻震荡混匀,37℃避光显色15 min,再在每孔加终止液终止反应,以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。
统计学处理

结 果
临床资料及实验室指标比较
pSS组所有患者均为女性,年龄25~63岁,平均(49.1±10.8)岁,病程1~15年,平均(5.7±3.0)年。正常对照组女性年龄33~57岁,平均(43.7±6.5岁)。两组年龄构成比差异无统计学意义(P>0.05)。两组白细胞计数、淋巴细胞绝对值、血小板计数、白蛋白及球蛋白水平的比较,差异均有统计学意义(P<0.05),其中淋巴细胞绝对值及球蛋白水平的差异更为显著(P<0.01)(表2)。
CHRM3转录水平及CHRM3-Ab比较
pSS组CHRM3转录水平及CHRM3-Ab均显著高于正常对照组,差异有统计学意义(P<0.05)(表3)。
CHRM3转录水平、CHRM3-Ab与临床指标的相关性分析
pSS组CHRM3-Ab浓度与血细胞沉降率、IgG呈负相关(r分别=-0.452、-0.470,均P<0.05),与其他临床指标无相关性(均P>0.05)。CHRM3转录水平与各临床指标均无相关性(均P>0.05)(表4)。
正常对照组CHRM3-Ab浓度与中性粒细胞绝对值呈负相关(r=-0.679,P<0.05),与其他临床指标之间无相关性(均P>0.05)。CHRM3转录水平与各临床指标之间均无相关性(均P>0.05)(表5)。
表2pSS组与正常对照组实验室指标比较
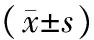

分组白细胞计数(×109/L)中性粒细胞绝对值(×109/L)淋巴细胞绝对值(×109/L)血红蛋白(g/L)血小板(×109/L)尿素(mmol/L)尿酸(μmol/L)白蛋白(g/L)球蛋白(g/L)正常对照组63±1733±0924±091276±841604±50542±092595±385431±11274±30pSS组50±1729±1314±091402±8341246±59940±122539±747406±50329±73P值<005>005<001>005<005>005>005<005<001
pSS:原发性干燥综合征
表3pSS组与正常对照组CHRM3转录水平及CHRM3-Ab比较
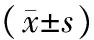

分组CHRM3转录水平CHRM3⁃Ab(pmol/L)正常对照组000009±00000414144±7104pSS组000014±00003022729±15481P值<005<001
pSS:原发性干燥综合征;CHRM3:毒蕈碱型乙酰胆碱受体亚型M3;CHRM3-Ab:毒蕈碱型乙酰胆碱受体M3亚型抗体;CHRM3转录表达水平以2-△Ct计算

表4 pSS患者CHRM3转录水平、CHRM3-Ab与实验室指标相关性
pSS:原发性干燥综合征;CHRM3:毒蕈碱型乙酰胆碱受体亚型M3;CHRM3-Ab:毒蕈碱型乙酰胆碱受体M3亚型抗体
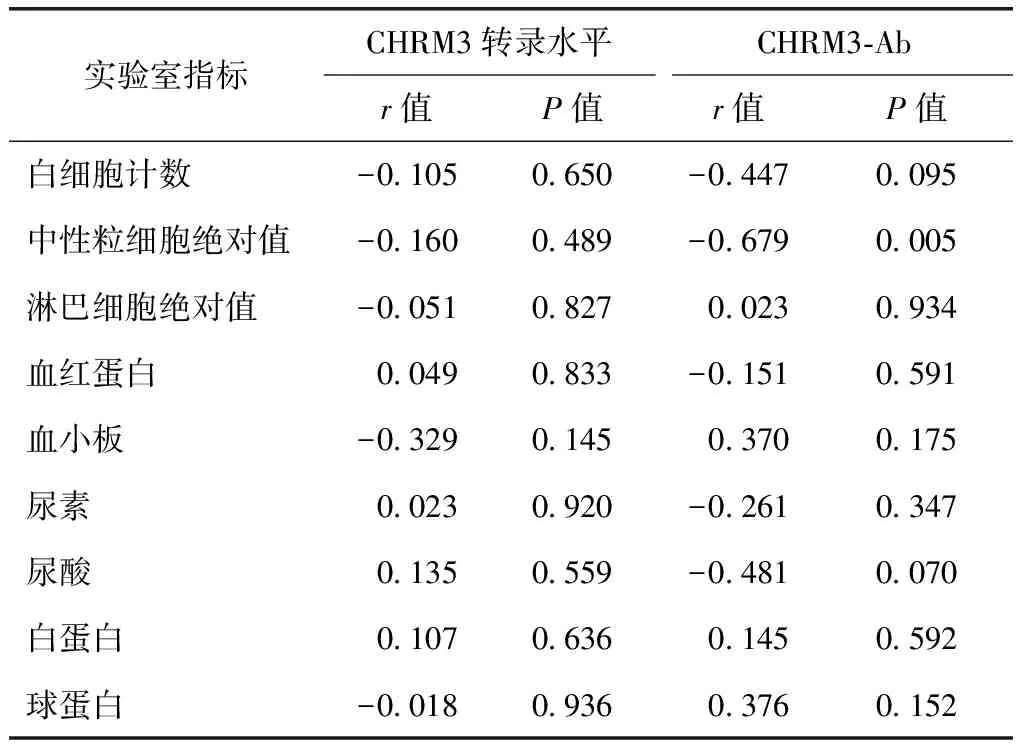
表5 正常对照组CHRM3转录水平、CHRM3-Ab与临床指标的相关性
pSS:原发性干燥综合征;CHRM3:毒蕈碱型乙酰胆碱受体亚型M3;CHRM3-Ab:毒蕈碱型乙酰胆碱受体M3亚型抗体
讨 论
Beroukas等[4]发现在pSS患者的唇腺组织石蜡切片标本中腺泡细胞膜上CHRM3数目有显著上调,CHRM3上调与神经递质传导抑制作用一致,并认为这种抑制作用可能与pSS患者血清中存在的特殊抗体对CHRM3的拮抗有关。Koo等[5]用SS患者纯化的IgG作用于合成CHRM3肽,发现IgG能够与CHRM3肽特定的表位结合。He等[6]用人工合成CHRM3肽序列研究发现,pSS患者CHRM3-Ab可与CHRM3肽特定的序列结合,与类风湿关节炎及系统性红斑狼疮患者比较,CHRM3-Ab阳性率在pSS患者中明显升高,但文中并没有关于pSS患者CHRM3-Ab的定量报道。本研究发现,pSS患者CHRM3-Ab浓度显著高于正常对照组,推测CHRM3-Ab可能在pSS的发病过程中发挥了一定的作用。
有文献报道,在人类PBMCs中有CHRM3表达[7-8]。Kawashima和Fuji[9]研究发现,淋巴细胞中有Ach及M受体的表达,并提及ACh及毒蕈碱型乙酰胆碱受体激动剂经CHRM3介导可能引起T、B淋巴细胞内信号改变。本文通过对pSS患者及健康体检者PBMCs的研究发现,pSS患者CHRM3 mRNA表达量显著高于正常对照组,推测CHRM3可能参与了pSS的发病,其具体影响机制还有待进一步研究。
pSS病变主要累及柱状上皮细胞构成的外分泌腺,以唾液腺和泪腺为主。病理特点为腺体间质有大量淋巴细胞浸润、腺体导管管腔扩张或狭窄等,小唾液腺上皮细胞有破坏和萎缩。Waterma等[10]研究发现,将SS患者血清中纯化的CHRM3-Ab用于动物实验,其可拮抗小鼠膀胱平滑肌上的CHRM3,抑制小鼠膀胱平滑肌副交感神经系统ACh信号的有效传递。2010年,Iizuka等[11]用CHRM3肽免疫小鼠后,发现小鼠血清中有高滴度的CHRM3-Ab,而唾液中含量少。本研究发现,pSS患者PBMCs中CHRM3表达及血浆中CHRM3-Ab浓度均明显高于正常对照组,二者可能通过一定的作用机制参与pSS的发病过程。笔者推测,可能由于pSS的某些病理机制使体内CHRM3的表达反馈性升高,诱导产生大量CHRM3-Ab,过多的CHRM3-Ab与CHRM3结合,影响正常神经递质Ach与CHRM3的结合及其后受体系统信号的有效传导,从而影响了唾液腺及泪腺等的分泌,使pSS患者表现出口干及眼干症状。
本研究还发现,pSS组及正常对照组就白细胞计数、淋巴细胞绝对值、血小板计数、白蛋白及球蛋白水平的比较,差异均有统计学意义,且其中淋巴细胞绝对值及球蛋白水平的差异更为显著,提示pSS的发病过程有炎性反应及免疫因素的参与。pSS患者CHRM3-Ab浓度与血细胞沉降率及IgG呈负相关,推测CHRM3-Ab可能参与了pSS的炎性反应与免疫调节。加强对CHRM3和CHRM3-Ab的研究,有望为pSS的治疗带来新契机。
[1]张乃峥.临床风湿病学[M].上海:上海科学技术出版社,1999:287-299.
[2]Alamanos Y, Tsifetaki N, Voulgari PV, et al. Epidemiology of primary Sjogren’s syndrome in north-west Greece, 1982-2003[J]. Rheumatology, 2006, 45:187-191.
[3]Vitali C, Bombardieri S, Jonsson R, et al.Classification criteria for Sjogren’s syndrome:a revised version of the European criteria proposed by the American-European Consensus Group[J].J Ann Rheum Dis, 2002, 61:554-558.
[4]Beroukas D, Goodfellow R, Hiscock J, et al. Up-regulation of M3-muscarinic receptors in labial salivary gland acini in primary Sjögren’s syndrome[J]. Lab Invest, 2002, 82:203-210.
[5]Koo NY, Li J, Hwang SM, et al. Functional epitope of muscarinic type 3 receptor which interacts with autoantibodies from Sjogren’s syndrome patients[J]. Rheumatology (Oxford), 2008, 47:828-833.
[6]He J, Guo JP, Ding Y, et al .Diagnostic significance of measuring antibodies to cyclic type 3 muscarinic acetylcholine receptor peptides in primary Sjogren’s syndrome[J]. Rheumatology (Oxford), 2011, 50:879-884.
[7]Hellström-Lindahl E, Nordberg A. Muscarinic receptor subtypes in subpopulations of human blood mononuclear cells as analyzed by RT-PCR technique[J]. J Neuroimmunol, 1996, 68:139-144.

[9]Kawashima K, Fuji T. Expression of non-neuronal acetylcholine in lymphocytes and its contribution to the regulation of immune function[J]. Front Biosci, 2004,9:2063-2085.
[10] Waterman SA, Gordon TP, Rischmueller R. Inhibitory effects of muscarinic receptor autoantibodies on parasympathetic neurotransmission in Sjögren’s syndrome[J]. Arthritis Rheum, 2000, 43:1647-1654.
[11] Iizuka M, Wakamatsu E, Tsuboi H, et al. Pathogenic role of immune response to M3 muscarinic acetylcholine receptor in Sjögren’s syndrome-like sialoadenitis[J]. J Autoimmun, 2010, 35:383-389.
