ETS1基因多态性与原发性干燥综合征的相关性
2013-04-09徐涓娟吴子燕栾海霞田新平李永哲张奉春
孙 菲,李 萍,徐涓娟,陈 华,吴子燕,栾海霞, 张 文,田新平,李永哲,张奉春
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,北京 100032)
ChinJAllergyClinImmunol,2013,7(2):103-108
原发性干燥综合征(primary sjögren’s syndrome,pSS)是一种多发于中老年女性,以外分泌腺受累为主要特征的慢性自身免疫性疾病。研究表明,遗传因素对pSS疾病的发病、临床表现及自身抗体的产生等都有一定影响[1]。和其他一些相关疾病如系统性红斑狼疮(systemic lupus erythematosus,SLE)相比,pSS的遗传背景研究相对落后[2]。
近年来,SLE等其他自身免疫性疾病的大规模候选基因关联分析和全基因组关联分析研究(genome-wide association studies,GWAS)为pSS的遗传背景研究提供了很好的线索与依据。包含汉族人群在内的2项关于SLE的GWAS均表明ETS1基因多态性与SLE密切相关[3-4],在其他人群中也有研究证实了ETS1与类风湿关节炎(rheumatoid arthritis,RA)及炎性肠病的相关性[5-6]。但目前国内外尚无关于ETS1与pSS的相关性研究。本研究选取了ETS1基因上2个单核苷酸多态性(single nucleotide polymorphism,SNP)位点(rs6590330和rs1128334),旨在汉族人群中验证ETS1基因多态性是否与pSS遗传易感性相关。
对象和方法
对象
严格按照2002年干燥综合征国际分类诊断标准[7]收集2008年9月至2011年11月期间在北京协和医院就诊的pSS患者临床资料。同时,选择北京协和医院体检中心的健康体检者作为对照,健康对照者均无自身免疫性疾病史及家族史。本研究所纳入的研究对象均为汉族人。
方法
基因组DNA提取:抽取pSS患者和健康对照者静脉血2 ml,乙二胺四乙酸(EDTA)抗凝,采用全血基因组DNA快速提取试剂盒(北京百泰克生物技术有限公司)提取基因组DNA。将2 ml全血与4 ml红细胞裂解液混匀,离心、弃上清后再次加入红细胞裂解液使红细胞完全裂解,在离心沉淀后的白细胞中加入2 ml细胞核裂解液使DNA析出,后加入1 ml蛋白沉淀液离心弃去蛋白质,加入2 ml异丙醇使DNA沉淀,离心后得到的DNA中加入2 ml 70%乙醇洗涤,待DNA晾干加入1 ml溶解液,分光光度计测量浓度(>20 ngμl)及纯度(A260280=1.7~1.9),琼脂糖电泳示DNA无降解,DNA置于―20℃冰箱保存备用。
基因分型:所有研究对象的DNA样本通过Sequenom MassArray系统进行分型。聚合酶链反应(polymerase chain reaction,PCR)扩增及延伸引物使用MassARRAY Assay Design 3.0软件进行设计(表1),由博淼生物科技有限公司进行合成。首先通过多重PCR扩增出含有所选SNP位点的目的DNA片段,然后经过虾碱酶(shrimp alkaline phosphatase,SAP)消化反应去除PCR扩增体系中未反应的碱基及非特异性产物。SAP反应后的扩增产物进行位点特异性延伸反应,反应产物经脱盐处理后转移至厂家提供的384孔SpectroCHIP阵列,最后使用MALDI-TOF-MS进行等位基因检测,质谱结果采用MassARRAY TYPER软件进行分析。
统计学处理
最终分型数据使用PLINK 1.07统计软件进行分析。Hardy-Wemberg平衡定律检验所选SNP位点在人群中的分布情况。关联分析中,各SNP位点等位基因频率和基因型频率进行2×2和2×3列联表的χ2检验。计算比值比(odd ratio,OR)、双侧95%可信区间(confidence interval,CI)和P值,以P值<0.05为差异有统计学意义。各遗传模型(加性模型、显性模型、隐性模型)下的分析通过logistic回归进行显著性检验。
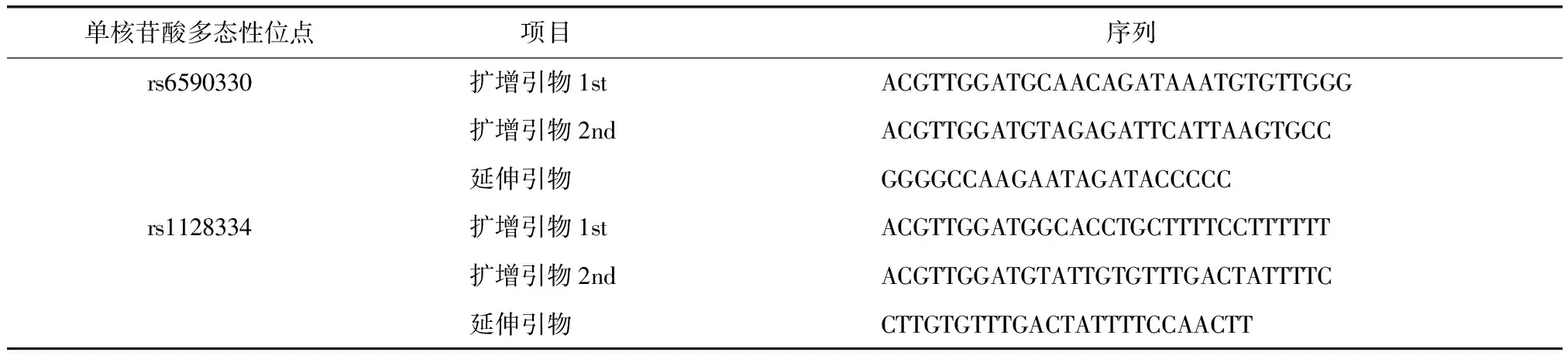
表1 单核苷酸多态性位点rs6590330和rs1128334引物序列
结 果
一般资料
pSS组:共纳入pSS患者261例,其中女250例,男11例,平均年龄(47.6±12.6)岁。抗SSA抗体阳性患者235例,抗SSB抗体阳性患者120例(双扩散法)。
对照组:共纳入597例健康体检者,其中女576例,男21例,平均年龄(49.5±9.3)岁。
基因分型质量和Hardy-Wemberg平衡检验
rs6590330和rs1128334分型成功率分别为94.5%和36.9%,rs1128334分型成功率小于80.0%,所以不能进行下一步分析。Hardy-Wemberg平衡定律检验,rs6590330在pSS组和对照组中均符合遗传平衡定律(P>0.05),具有群体代表性。
rs6590330在pSS组和对照组间的关联分析
A等位基因频率在pSS组中分别为42.5%、44.9%、12.6%、65.0%和35.0%,在对照组中分别为41.8%、47.5%、10.6%、65.6%和34.4%,基因型和等位基因分布差异在两组间无统计学意义[基因型χ2=0.822,P=0.663;等位基因χ2=0.059,P=0.808,OR=1.028,95%CI为(0.823,1.283)](表2)。3种不同遗传模型下分析显示,两组间差异无统计学意义(均P>0.05)(表3)。
rs6590330与性别的关联分析
pSS多发于女性,性别因素在一定程度上影响疾病的发生。因此,本研究去除男性研究对象后,进一步行数据分析。结果显示,两组间差异仍无统计学意义[基因型χ2=1.252,P=0.535;等位基因χ2=0.342,P=0.558,OR=1.070,95%CI为(0.854,1.340)](表4)。
rs6590330与抗SSA和抗SSB抗体间的关联分析
将抗SSA和抗SSB抗体阳性的pSS组患者分别与对照组比较,同样rs6590330位点的基因型和等位基因频率在抗体阳性组与对照组之间分布差异无统计学意义(均P>0.05)(表5)。

表2 rs6590330基因型和等位基因在pSS组与对照组间比较
pSS:原发性干燥综合征

表3 3种遗传模型下rs6590330的分析
pSS:原发性干燥综合征

表4 女性rs6590330基因型和等位基因在pSS组和对照组的分布
pSS:原发性干燥综合征

表5 rs6590330与抗SSA抗体和抗SSB抗体相关性分析
a与对照组相比,χ2=1.457,P=0.483;b与对照组相比,χ2=1.814,P=0.404;c与对照组相比,比值比=1.049,95%可信区间(0.834,1.320);d与对照组相比,比值比=0.960,95%可信区间(0.710,1.296)
讨 论
尽管pSS是一种主要累及外分泌腺的自身免疫性疾病,但在临床特征和发病机制方面却与其他自身免疫性疾病如SLE存在一些共同点,如抗SSA和抗SSB等抗体的产生[8]、B淋巴细胞过度活化及干扰素-α(interferon-α,IFN-α)信号通路激活[9]等。在遗传背景方面,同样与其他自身免疫性疾病密切相关,pSS患者的一级亲属患有pSS、SLE或其他自身免疫性疾病的风险更大[10];且与其他自身免疫性疾病存在着一些共同的遗传易感区域,如人类白细胞抗原(human leukocyte antigen,HLA)基因区域及HLA基因以外的STAT4和IRF5等基因[11-12]。鉴于ETS1基因与SLE和RA等疾病的相关性,以及pSS与这些疾病在遗传背景方面有一定程度的重叠性,所以认为ETS1基因可能同样与pSS易感性相关。然而,本研究未发现ETS1基因和pSS之间存在任何相关性。这说明ETS1基因多态性与疾病的相关性在不同疾病中存在着差异。
ETS1基因位于染色体11q23.3上,其编码产物是ETS转录因子家族成员之一,含有一个保守的靶基因结合域,可识别靶基因上的保守的GGAAT DNA序列,进而调节靶基因的表达。ETS1可广泛的参与多种免疫细胞的生长发育、调控细胞因子的基因表达,从而发挥免疫调节功能[13]。首先,ETS1是B细胞终末分化的负调节蛋白,ETS1缺陷的B细胞在数目正常的情况下,分泌IgM的浆细胞比例明显升高[14];且有研究表明,ETS1是通过抑制转录因子B淋巴细胞诱导成熟蛋白1(Blimp-1)来调控浆细胞的分化[15]。另一方面,ETS1可促进辅助T1细胞(T helper cell 1,Th1)、抑制Th17细胞的分化[16-17],还可影响自然杀伤(natural killer,NK)细胞和NK T细胞的发育[18]。已有研究表明,SLE患者中ETS1基因mRNA表达水平较健康对照降低[19]。目前的研究证实,ETS1在免疫调节及SLE疾病发生过程中起到一定作用[20]。对于pSS这种以B细胞过度活化为特征并伴有其他多种免疫细胞功能紊乱及多种细胞因子分泌异常的疾病[21],ETS1基因功能是否会参与pSS疾病发生有待于去证实。本研究初步从ETS1基因多态性出发,并未发现ETS1与pSS的相关性,但并不能完全否认其在pSS中可能存在的作用。
本研究选取ETS1基因上和汉族人群SLE相关性最密切的2个SNP位点,由于rs1128334分型成功率过低未能进一步分析。rs6590330位点A等位基因和AA基因型频率在pSS组中升高,这种趋势和SLE中的研究结果一致[3-4]。但这种分布差异在基因型和等位基因频率的基本分析及各遗传模型下的分析中都无统计学意义。关于SLE的研究发现,一些SNP位点与疾病本身不存在相关性,而与疾病的某些亚型密切相关[22]。所以,本研究将pSS组患者按性别及抗体产生情况进行分组并进一步分析。由于样本数量有限,研究只针对女性pSS组、抗SSA抗体组和抗SSB抗体组进行了分析,结果仍未发现任何相关性。
通过本研究发现,rs6590330与pSS不存在相关性。这可能是由于SLE和pSS疾病之间遗传背景的差异造成的,即ETS1基因多态性对两种疾病易感性的影响有所不同。另外,ETS1基因上与pSS密切相关的可能是rs6590330以外的其他位点。最后,还应考虑到本研究样本量和SLE的研究相比相对有限,对pSS其他临床表现的亚型分析尚不能开展,有待于进一步扩大样本量去验证。总之,本研究发现与SLE等疾病密切相关的ETS1基因多态性与pSS的易感性并不相关,这说明ETS1基因并非pSS与其他自身免疫性疾病的共同易感基因。
[1]Segal BM, Nazmul-Hossain AN, Patel K, et al. Genetics and genomics of Sjogren’s syndrome: research provides clues to pathogenesis and novel therapies[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2011, 111:673-680.
[2]Scofield RH. Genetics of systemic lupus erythematosus and Sjogren’s syndrome[J]. Curr Opin Rheumatol, 2009, 21:448-453.
[3]Han JW, Zheng HF, Cui Y, et al. Genome-wide association study in a Chinese Han population identifies nine new susceptibility loci for systemic lupus erythematosus[J]. Nat Genet, 2009, 41:1234-1237.
[4]Yang W, Shen N, Ye DQ, et al. Genome-wide association study in Asian populations identifies variants in ETS1 and WDFY4 associated with systemic lupus erythematosus[J]. PLoS genetics, 2010, 6:1000841.
[5]Dubois PC, Trynka G, Franke L, et al. Multiple common variants for celiac disease influencing immune gene expression[J]. Nat Genet, 2010, 42:295-302.
[6]Chatzikyriakidou A, Voulgari P, Georgiou I, et al. Altered sequence of the ETS1 transcription factor may predispose to rheumatoid arthritis susceptibility[J]. Scand J Rheumatol, 2013, 42:11-14.
[7]Vitali C, Bombardieri S, Jonsson R, et al. Classification criteria for Sjogren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group[J]. Ann Rheum Dis, 2002, 61:554-558.
[8]Harley JB, Scofield RH, Reichlin M. Anti-Ro in Sjogren’s syndrome and systemic lupus erythematosus[J]. Rheum Dis Clin North Am, 1992, 18:337-358.
[9]Mavragani CP, Crow MK. Activation of the type I interferon pathway in primary Sjogren’s syndrome[J]. J autoimmunity,2010,35:225-231.
[10] Jonsson R, Bolstad AI, Brokstad KA, et al. Sjogren’s syndrome-a plethora of clinical and immunological phenotypes with a complex genetic background[J]. Ann N Y Acad Sci, 2007, 1108:433-447.
[11] Korman BD, Alba MI, Le JM, et al. Variant form of STAT4 is associated with primary Sjogren’s syndrome[J]. Genes Immun, 2008, 9:267-270.
[12] Miceli-Richard C, Gestermann N, Ittah M, et al. The CGGGG insertiondeletion polymorphism of the IRF5 promoter is a strong risk factor for primary Sjogren’s syndrome[J]. Arthritis Rheum, 2009, 60:1991-1997.
[13] Russell L, Garrett-Sinha LA. Transcription factor Ets-1 in cytokine and chemokine gene regulation[J]. Cytokine, 2010, 51:217-226.
[14] Bories JC, Willerford DM, Grevin D, et al.I ncreased T-cell apoptosis and terminal B-cell differentiation induced by inactivation of the Ets-1 proto-oncogene[J]. Nature,1995,377:635-638.
[15] John SA, Clements JL, Russell LM, et al. Ets-1 regulates plasma cell differentiation by interfering with the activity of the transcription factor Blimp-1[J]. J Biol Chem,2008,283:951-962.
[16] Grenningloh R, Kang BY, Ho IC. Ets-1, a functional cofactor of T-bet, is essential for Th1 inflammatory responses[J]. J Exp Med, 2005, 201:615-626.
[17] Moisan J, Grenningloh R, Bettelli E, et al.Ets-1 is a negative regulator of Th17 differentiation[J]. J Exp Med, 2007, 204:2825-2835.
[18] Choi HJ, Geng Y, Cho H, et al.Differential requirements for the Ets transcription factor Elf-1 in the development of NKT cells and NK cells[J].Blood, 2011,117:1880-1887.
[19] Li Y, Sun LD, Lu WS, et al. Expression analysis of ETS1 gene in peripheral blood mononuclear cells with systemic lupus erythematosus by real-time reverse transcription PCR[J]. Chin Med J (Engl), 2010, 123:2287-2288.
[20] Leng RX, Pan HF, Chen GM, et al. The dual nature of Ets-1: focus to the pathogenesis of systemic lupus erythematosus[J]. Autoimmun Rev, 2011,10:439-443.
[21] Voulgarelis M, Tzioufas AG. Pathogenetic mechanisms in the initiation and perpetuation of Sjogren’s syndrome[J]. Nat Rev Rheumatol, 2010,6:529-537.
[22] Li P, Cao C, Luan H, et al. Association of genetic variations in the STAT4 and IRF7KIAA1542 regions with systemic lupus erythematosus in a Northern Han Chinese population[J]. Hum Immunol, 2011, 72:249-255.
