系统性红斑狼疮患者外周血干扰素α、白介素6和肿瘤坏死因子α水平
2013-04-09周晶晶汪国生李向培厉小梅
周晶晶,汪国生,李向培,厉小梅,钱 龙
(安徽医科大学附属省立医院风湿免疫科,合肥 230001)
ChinJAllergyClinImmunol, 2013, 7(2):109-114
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种典型的免疫功能紊乱、累及多系统的自身免疫性疾病,主要表现为T、B淋巴细胞异常活化、增殖和分化,产生多种自身抗体[1-2]。SLE发病机制不明,主要由免疫异常、基因突变、性激素及环境等多种因素共同参与。研究发现,SLE患者体内多种细胞因子存在异常,且血清中异常细胞因子类型不同,其临床表现也不相同,提示SLE患者体内不同细胞因子谱可能引发了不同的临床特征[3]。近年来,血清干扰素α(interferon α,IFN-α)异常升高在SLE发病中的重要性日益受到关注,同时白介素6(interleukin 6,IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的异常高表达在SLE患者中也普遍存在。本研究检测SLE患者血清中IFN-α、IL-6及TNF-α的水平,分析其与实验室及临床指标的相关性,为了解SLE的发病机制,评估患者病情,指导临床治疗奠定基础。
对象和方法
对象及分组
SLE组:选取安徽医科大学附属省立医院风湿免疫科门诊及住院SLE患者共45例,诊断均符合1997年美国风湿病协会(American College of Rheumatology,ACR)制定的SLE分类标准。其中男3例,女42例,年龄(14~72)岁,平均年龄31.6岁。依据SLE疾病活动指数(SLE disease activity index,SLEDAI)[4]对疾病活动度进行评估,<10分为稳定期,33例患者;≥10分为活动期,12例患者。根据抗双链DNA(double-stranded DNA,dsDNA)抗体将SLE患者分为抗dsDNA抗体阳性组及阴性组。根据血红蛋白水平将SLE患者分为血红蛋白正常组(男120~160 g/L,女110~150 g/L)及减低组(男<120 g/L,女<110 g/L)。
正常对照组:自安徽医科大学附属省立医院健康志愿者20名,性别和年龄均与SLE患者相匹配。
方法
试剂及主要仪器:人IFN-α、IL-6、TNF-α酶联免疫吸附试剂盒(ELISA Kit)购自美国eBioscience公司。自动洗板机及酶标仪均产自奥地利。-80℃超低温冰箱购自日本SANYO公司。
样本采集和血清分离:清晨空腹采集SLE患者和健康对照者肘静脉血3 ml,EDTA抗凝,室温静置2 h,待其析出血清,3 000 r/min离心10 min,留取上层血清,分装至Eppendorf管中,置于-80℃冰箱保存。
血清IFN-α、IL-6、TNF-α检测:所有操作按试剂盒说明书进行,简单步骤如下:润板,Wash Buffer浸润微孔板;加血清样本;加人生物素标记抗体(Biotin);室温(18℃~25℃)孵育2 h,洗涤;加亲和素-辣根过氧化物酶(HRP),室温(18℃~25℃)孵育1 h,洗涤,加TMB显色,避光孵育10~15 min;加终止液;读取酶标仪上A450值,根据标准曲线,计算出待测样本中各细胞因子浓度(ng/L)。
实验室检查:SLE患者相关实验室检查包括血常规、尿常规、血细胞沉降率(erythrocyte sedimentation rate,ESR)、C-反应蛋白、免疫球蛋白及补体,上述指标均在安徽医科大学附属省立医院医学检验中心完成;抗核抗体全套滴度、抗dsDNA抗体及红斑狼疮活动指标的检测在安徽医科大学附属省立医院风湿病实验室完成。所有检测均按照国际统一标准进行。
临床指标:观察并记录SLE患者皮疹、口腔溃疡、发热、关节痛、肾脏受累、血细胞减低等临床表现。
统计学处理
结 果
血清IFN-α、IL-6及TNF-α水平
SLE组血清IFN-α及IL-6浓度显著高于正常对照组,两组比较差异均有统计学意义(均P<0.05);而血清TNF-α水平与正常对照组相比,差异无统计学意义(P>0.05)(表1)。其中SLE活动期患者血清IFN-α
水平明显高于稳定期患者[(9.79±12.04)ng/Lvs.(3.13±3.47)ng/L,P<0.05]。
SLE患者血清IFN-α、IL-6、TNF-α间相关性
SLE患者血清IFN-α水平与TNF-α水平呈正相关(r=0.303,P<0.05),而与IL-6无相关性;IL-6水平与TNF-α也无相关性。
SLE血清IFN-α、IL-6、TNF-α与实验室指标的关系
SLE患者中抗dsDNA抗体阳性组血清IFN-α、IL-6 水平明显高于抗dsDNA抗体阴性组(均P<0.05);血红蛋白减低组血清IFN-α水平显著高于血红蛋白正常组(P<0.05)(表2)。
SLE患者血清IFN-α水平与抗dsDNA抗体呈正相关(r=0.368,P<0.05),与血红蛋白水平呈负相关(r=-0.354,P<0.05);IL-6水平与抗dsDNA抗体(r=0.437,P<0.05)及ESR均呈正相关(r=0.526,P<0.01);TNF-α水平与各实验室指标均无相关性。
表1SLE患者和正常对照者血清IFN-α、IL-6、TNF-α水平比较
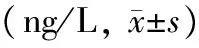
SLE:系统性红斑狼疮;IFN-α:干扰素α;IL-6:白介素6;TNF-α:肿瘤坏死因子α;*与正常对照组相比,P<0.05
表2SLE患者血清IFN-α、IL-6、TNF-α比较
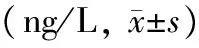
SLE:系统性红斑狼疮;IFN-α:干扰素α;IL-6:白介素6;TNF-α:肿瘤坏死因子α;*与抗dsDNA阴性组相比,P<0.05;#与血红蛋白正常组相比,P<0.05
SLE患者血清IFN-α、IL-6、TNF-α与SLEDAI及临床指标的关系
SLE患者血清IFN-α水平与SLEDAI积分呈正相关(r=0.427,P<0.01)(图1)。
SLE患者中出现皮疹者14例(31%),出现口腔溃疡者9例(20%),出现发热者8例(18%),出现关节炎者15例(33%),出现肾脏受累11例(24%),出现血液系统损害者13例(29%)。血清IFN-α水平和血液系统损害有密切的关系,其在有血液系统受累的患者中表达水平明显升高,差异有统计学意义(P<0.05)。血清IL-6水平在伴有发热、关节炎或血液系统损害的患者中明显高于无上述临床表现的患者,差异有统计学意义(P<0.01或P<0.05)。血清TNF-α表达增高与多种临床表现相关,但差异均无统计学意义(P>0.05)(表3)。

图1SLE患者血清IFN-α水平与SLEDAI的相关性
Fig1Correlation between the level of IFN-α and SLEDAI in SLE patients
SLE:系统性红斑狼疮;IFN-α:干扰素α;SLEDAI:SLE疾病活动指数
表3SLE患者临床特征与血清IFN-α、IL-6、TNF-α的关系
临床表现例数(n)IFN⁃αIL⁃6TNF⁃α检测值P值检测值P值检测值P值皮疹 有14567±7200179672±11420189663±10640215 无31333±377246±216317±447口腔溃疡 有9450±2700922169±1890511185±1090412 无36422±565420±746562±897发热 有8636±96104891631±24430001550±8870514 无37408±513295±284208±176关节炎 有15655±10270726742±12150048597±9960328 无30424±573273±244325±333肾脏受累 有11897±13130248536±7060388581±9510313 无34378±427402±789270±132血液系统损害 有13571±7130036445±3890042666±12230454 无32274±367220±178500±703
SLE:系统性红斑狼疮;IFN-α:干扰素α;IL-6:白介素6;TNF-α:肿瘤坏死因子α
讨 论
细胞因子的分泌调控着人体的正常免疫反应,当其分泌异常时,机体免疫高度活化,可诱发自身免疫性疾病。近年来多项研究均证明,参与免疫调节的细胞因子网络失调在SLE发病及疾病进展中发挥着重要作用。
IFN-α主要由浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)合成分泌,主要在机体受到外界细菌或病毒等刺激的情况下产生,具有抗病毒和免疫调节功能。然而,机体内源性核酸物质或核酸含有的免疫复合物也可激活pDCs,使其产生大量IFN-α,从而导致SLE发病。本研究发现,SLE患者血清中IFN-α水平较正常人明显升高,这与Willis等[5]的研究报道一致。IFN-α是SLE的标志性细胞因子,也是研究最多的与SLE相关的细胞因子,其与疾病活动度、病情轻重及免疫活化等密切相关[6]。本研究显示,SLE活动期患者IFN-α水平明显高于稳定期患者,且IFN-α浓度与SLEDAI积分呈正相关。
动物实验显示[7-8],I型IFN受体α链信号通路可促进自身抗体的产生及肾脏疾病的发生,而敲除I型IFN受体α链基因可阻止NZB小鼠及NZM 2328小鼠疾病进展,降低溶血性贫血的发生率,提高小鼠存活率。另外,干扰素调节因子5(interferon regulatory factor 5,IRF5)是SLE患者IFN-α产生相关基因,其表达与I型IFN的活性及抗dsDNA抗体的产生密切相关[9]。本研究也观察到抗dsDNA抗体阳性患者血清IFN-α水平高于抗dsDNA抗体阴者,血红蛋白减低及血液系统损害患者血清IFN-α水平高于正常者。同时,IFN-α水平与抗dsDNA抗体呈正相关、与血红蛋白水平负相关,以上结果与先前文献报道共同说明了IFN-α在SLE疾病发生发展中的重要性。
在对SLE细胞因子的研究中,另外两个较为重要的细胞因子IL-6、TNF-α也已得到广泛共识。SLE是典型的辅助T细胞2(T help cell 2,Th2)细胞因子介导的自身免疫性疾病,其中IL-6是一种重要的Th2细胞因子。IL-6可由多种细胞分泌产生,并且影响多种细胞的功能。其中最重要的作用是促进细胞的活化与分化,参与T、B淋巴细胞等细胞介导的炎性反应[10]。多项研究显示,SLE患者血清中IL-6水平显著升高,且与疾病活动度、血清抗dsDNA抗体呈正相关[5,11-12]。另有研究报道,狼疮肾炎患者尿液中IL-6水平明显升高,且与血清抗dsDNA抗体滴度相关[13]。本研究也显示,SLE患者外周血IL-6水平明显升高,且抗dsDNA抗体阳性患者水平明显高于抗dsDNA抗体阴性患者,同时IL-6水平与抗dsDNA抗体呈正相关。研究中发现,SLE患者血清IL-6水平与血沉呈明显正相关,而在IFN-α、TNF-α却未发现此关系,说明IL-6可反映机体的慢性炎性状态。在对血清IL-6与SLE临床症状的相关性分析中发现,血清IL-6水平与发热、关节炎及血液系统损害有显著的相关性。由于IL-6可由多种细胞分泌产生,可引起包括急性时相蛋白和发热等多种效应,因此本研究观察到在伴有发热的患者血清IL-6水平明显高于无发热患者。此外,发热、关节炎、白细胞或血小板减少是SLE疾病活动度评估指标,而多项研究已证实IL-6水平与SLE疾病活动度正相关,本研究显示在具有以上临床的表现的患者中IL-6水平明显高于无上述症状的患者。
在对SLE的研究中,另外一个较为重要的细胞因子为TNF-α。与IL-6类似的是,TNF-α也可由多种细胞合成,包括T、B淋巴细胞及活化的单核巨噬细胞等。Arora等[14]报道,SLE患者血清中TNF-α水平较正常人显著升高,认为TNF-α在SLE发病机制中有重要的作用。然而也有观点认为,TNF-α在SLE发病中的作用是有争议的[15]。在狼疮鼠模型研究中,发现减少NZB/W小鼠TNF-α的产生可使小鼠发生肾炎,且含高水平TNF-α的小鼠疾病仅轻度活动,认为TNF-α缺陷是该株小鼠发生狼疮样改变的重要因素[16];另有研究发现,TNF-α在MRL/lpr小鼠血清及肾脏组织中高表达,其水平与靶器官炎性程度相关[17]。本研究未发现SLE患者与正常对照者血清TNF-α水平明显的统计学差异,也未观察到TNF-α与某种临床表现明显的相关性;仅发现血清TNF-α水平与IFN-α呈正相关,这可能是由于选取样本量较少,未能使其达到统计学意义所致。但有研究报道,TNF-α 水平在稳定期SLE患者中高于活动期SLE患者及正常人,认为TNF-α也可能是SLE的保护性细胞因子[18]。由于TNF-α在SLE发病机制中的作用各个研究结果不一致,仍有待于进一步深入研究。
SLE患者体内存在多种细胞因子的异常分泌,这些异常分泌的细胞因子是免疫细胞功能紊乱的产物,其可激活免疫细胞,导致免疫紊乱进一步加剧。因此,深入研究SLE患者体内细胞因子网络的异常,对明确SLE的发病及转归,指导SLE的治疗具有重要意义。
[1]Hoffman RW. T cells in the pathogenesis of systemic lupus erythematosus [J]. Clin Immunol, 2004, 113:4-13.
[2]Yurasov S, Wardemann H, Hammersen J, et al. Defective B cell tolerance checkpoints in systemic lupus erythematosus [J]. J Exp Med, 2005, 201:703-711.
[3]Lee HM, Sugino H, Nishimoto N. Cytokine networks in systemic lupus erythematosus [J]. J Biomed Biotechnol, 2010, 2010: 676284. doi: 10.1155/2010/676284.
[4]Bombardier C, Gladman DD, Urowitz MB, et al. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE [J]. Arthritis Rheum, 1992, 35:630-640.
[5]Willis R, Seif AM, McGwin G Jr, et al. Effect of hydroxychloroquine treatment on pro-inflammatory cytokines and disease activity in SLE patients: data from LUMINA (LXXV), a multiethnic US cohort [J]. Lupus, 2012, 21:830-835.
[6]Hooks JJ, Moutsopoulos HM, Geis SA, et al. Immune interferon in the circulation of patients with autoimmune disease [J]. N Engl J Med, 1979, 301:5-8.
[7]Santiago-Raber ML, Baccala R, Haraldsson KM, et al. Type-I interferon receptor deficiency reduces lupus-like disease in NZB mice [J]. J Exp Med 2003, 197:777-788.
[8]Agrawal H, Jacob N, Carreras E, et al. Deficiency of type I IFN receptor in lupus-prone New Zealand mixed 2328 mice decreases dendritic cell numbers and activation and protects from disease [J]. J Immunol, 2009, 183:6021-6029.
[9]Niewold TB, Kelly JA, Flesch MH, et al. Association of the IRF5 risk haplotype with high serum interferon-alpha activity in systemic lupus erythematosus patients [J]. Arthritis Rheum, 2008, 58:2481-2487.
[10] Naka T, Nishimoto N, Kishimoto T. The paradigm of IL-6: from basic science to medicine [J]. Arthritis Res, 2002, 4:S233-S242.
[11] Ripley BJ, Goncalves B, Isenberg DA, et al. Raised levels of interleukin 6 in systemic lupus erythematosus correlate with anaemia [J]. Ann Rheum Dis, 2005, 64:849-853.
[12] Sabry A, Sheashaa H, EI-Husseini A, et al. Proinflammatory cytokines (TNF-alpha and IL-6) in Egyptian patients with SLE: its correlation with disease activity [J]. Cytokine, 2006, 35:148-153.
[13] Iwano M, Dohi K, Hirata E, et al. Urinary levels of IL-6 in patients with active lupus nephritis [J]. Clin Nephrol, 1993, 40:16-21.
[14] Arora V, Verma J, Marwah V, et al. Cytokine imbalance in systemic lupus erythematosus: a study on northern Indian subjects [J]. Lupus, 2012, 21:596-603.
[15] Postal M, Appenzeller S. The role of Tumor Necrosis Factor-alpha (TNF-α) in the pathogenesis of systemic lupus erythematosus [J]. Cytokine, 2011, 56:537-543.
[16] Kontoyiannis D, Kollias G. Accelerated autoimmunity and lupus nephritis in NZB mice with an engineered heterozygous deficiency in tumor necrosis factor [J]. Eur J Immunol, 2000, 30:2038-2047.
[17] Yokoyama H, Kreft B, Kelley VR. Biphasic increase in circulating and renal TNF-alpha in MRL-lpr mice with differing regulatory mechanisms [J]. Kidney Int, 1995, 47:122-130.
[18] Gómez D, Correa PA, Gómez LM, et al. Th1/Th2 cytokines in patients with systemic lupus erythematosus: is tumor necrosis factor alpha protective [J]. Semin Arthritis Rheum, 2004, 33:404-413.
