甲状腺癌miRNA-146与BRAF突变的相关性研究
2013-03-22姚廷敬彭德峰朱金海朱正志马小开王岩岩
姚廷敬,彭德峰,朱金海,朱正志,周 锐,马小开,崔 振,王岩岩
甲状腺癌(thyroidcarcinoma)是一种十分常见的内分泌腺恶性肿瘤,也是近年世界上发病率上升最快的恶性肿瘤之一,在北美与亚太地区已列入常见肿瘤的前10 位,但其作用机制仍不明了。细针穿刺细胞学活检是术前诊断甲状腺肿瘤的金标准,然而仍有20%~30%不能确定者,目前尚无理想的肿瘤标志物用于甲状腺癌诊断,因此探讨甲状腺癌的的早期诊断方案就具有重要的临床意义。miRNA 是上个世纪末发现的一种单链小分子RNA,在体内参与了一系列生理过程。miRNA-146 是最近发现的一种免疫调控因子,在自身免疫疾病进展中的作用已经成为研究热点,有望成为一种诊断的生物学标志物。此外,ARAF 癌基因是目前研究最多的具有特异性的甲状腺癌基因,其突变是甲状腺癌常见的基因突变。本研究对甲状腺癌中ARAF 突变与miRNA-146 表达相关性进行分析,希望为甲状腺癌诊断提供参考,现报告如下。
1 资料与方法
1.1 一般资料 选取2009年4月~2012年4月我院收治的甲状腺癌患者30 例作为观察组,其中乳头状癌19 例、滤泡状癌6、未分化癌5 例,所有患者复符合甲状腺癌诊断标准[1]。将患者术中切下的肿瘤组织进行石蜡固定;选取正常甲状腺组织28 例作为对照组,2 组患者在年龄、性别构成等资料无显著性差异(P >0.05),具有可比性,见表1。
表1 2 组人群一般资料比较(±s)
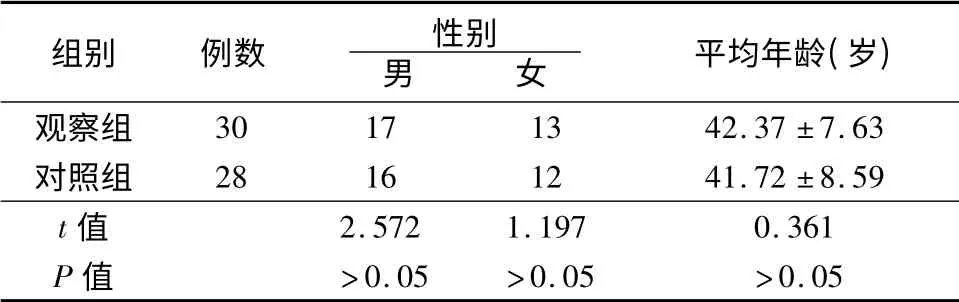
表1 2 组人群一般资料比较(±s)
组别例数性别男女平均年龄(岁)观察组30171342.37 ±7.63对照组28161241.72 ±8.59 t 值2.5721.1970.361 P 值>0.05>0.05>0.05
1.2 实验方法 分以下几步进行:
1.2.1 免疫组化步骤[2](1)石蜡切片脱蜡至水;(2)3%H2O2室温孵育5~10 min,以消除内源性过氧化物酶的活性;(3)蒸馏水冲洗,PBS 浸泡5 min×3 次;(4)5%~10%正常山羊血清(PBS 稀释1:400)封闭,室温孵育10 min,倾去血清,再滴加AR 鼠单克隆抗体(PBS 稀释1:400)于切片上,37℃孵育1~2 h 或4℃过夜;(5)PBS 冲洗,5 min ×3 次;(6)滴加适量生物素标记二抗于切片标本上,37℃孵育10~30 min;(7)PBS 冲洗,5 min×3 次;(8)滴加适量的辣根酶或碱性磷酸酶标记的链霉卵白素工作液,37℃孵育10~30 min;(9)PBS 冲洗,5 min×3 次;(10)将新配制的DAB 液滴加于切片上,显微镜下显色3~15 min;自来水充分冲洗,苏木紫复染,脱水,透明,封片。
1.2.2 查阅相关文献[3-4]设计引物,上游引物:5’-CTGGCATGTGAGCGCCTGCT-3’,下游引物:5’-CCACTTGGCTGTCCCGGCTG-3’;根据BRAF 常见在15 号外显子T1799 位置突变,将BRAF 第15 号外显子突变频率最高的序列进行扩增。用基因组DNA 作为模板,使用PCR 仪进行扩增;PCR 反应体系30 μl,其中ddH2O 17 μl,缓冲液10 ×buffer3 μl,dNTP5 μl,Taq 聚合酶0.1 U,DNA 模板0.5 μl,MgCl24.5 μl;扩增条件:95℃预变性10 min,90℃变性1 min,60℃退火1 min,70℃延伸1 min。35 个循环后,再72℃延伸10 min。将扩增产物用2%琼脂凝胶电泳,溴化乙锭染色,PCR 产物割胶回收。
1.2.3 电泳限制性酶切 PCR 产物15 μl,10 × buffer2 μl,NciI 内切酶2 μl,双蒸水6 μl,总反应体系25 μl。混匀后38℃过夜,琼脂凝胶电泳,溴化乙锭染色,紫外灯下观察。
1.2.4 DNA 测序 用凝胶与Marker 条带相近的样本进行扩增后测序,BRAF 测序结果与BRAF 基因组序列对比,确定是否突变及突变位点。
1.3 判断标准 每个切片选取5 个视野,取均值。按照着色深浅:0 分未着色,1 分着色较淡,2 分着色较深,3 分着色很深;按照着色范围:0 分阴性,1 分阳性细胞数低于20%,2 分阳性细胞数21%~60%,3 分阳性细胞数61%~75%,4 分阳性细胞数大于75%。采用阳性细胞显色范围与染色深浅相乘的方法进行评分,小于等于3 分为免疫反应阴性,大于3 分为阳性。
1.4 统计学方法 所有研究数据均采用SPSS17.0 统计学软件包进行统计分析,计量资料以±s表示,计量资料采用t 检验,P 值采用双侧检验。若P<0.05 则表示差异有统计学意义。
2 结果
2.1 miRNA-146 在正常组织和甲状腺癌组织中的表达 免疫组化结果显示,30 例甲状腺癌组织中有27 例(90.0%)出现miRNA-146 表达阳性,而在正常组织中miRNA-146 表达为阴性,2 组染色评分均值分别为0.07 和7.34,二者差异具有统计学意义(P<0.05),见表2。
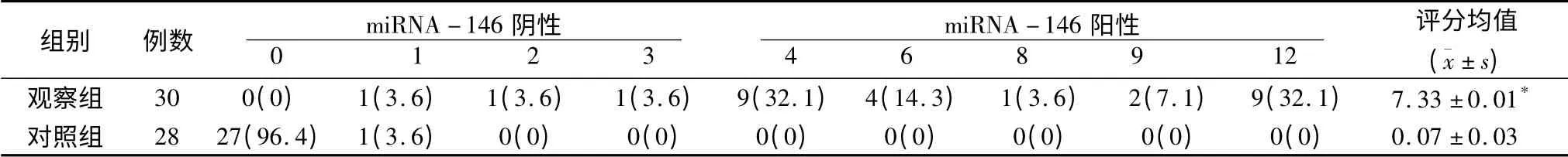
表2 2 组miRNA-146 的表达(n,%)
2.2 BRAF 基因检测 通过BRAF 基因检测,发现在30 例甲状腺癌患者中,有17 例BRAF 基因突变,阳性率为51.0%,BRAF 突变在15 号外显子1 799 位点,为点突变,其中腺嘌呤替换为胞嘧啶(T1799A)。
2.3 甲状腺癌中BRAF 突变与miRNA-146 表达相关性 在甲状腺癌患者中,BRAF 突变阳性组miRNA-146 表达明显高于阴性组,miRNA-146 表达阳性率分别为94.1%(16/17)和76.9%(10/13),miRNA-146 表达评分均值分别问9.51 和4.45,2 组相比,具有统计学差异(P<0.05),见表3。

表3 甲状腺癌中BRAF 突变与miRNA-146 表达关系(n,%)
3 讨论
甲状腺癌(thyroidcarcinoma)是一种十分常见的内分泌腺恶性肿瘤,也是近年世界上发病率上升最快的恶性肿瘤之一,在北美与亚太地区已列入常见肿瘤的前10 位,但其作用机制仍不明了[5]。细针穿刺细胞学活检是术前诊断甲状腺肿瘤的金标准,然而仍有20%~30%不能确定者,目前尚无理想的肿瘤标志物用于甲状腺癌诊断,因此探讨甲状腺癌的的早期诊断方案就具有重要的临床意义。
miRNA 是由Lee 等[6]1993年首先发现并在《Cell》上报道的一段由18~24 个核苷酸构的非编码的单链小分子RNA,其发现被美国《科学》杂志列为2002年世界十大科技突破之首。miRNA 普遍存在于动植物体内并参与了生命过程中的一系列重要进程,包括早期胚胎发育、细胞增殖、细胞分化以及在基因表达调控中的作用等。研究证实[7],miRNA 在物种间具有高度的保守性、时序性和组织特异性。miRNA 在基因转录后水平上,通过与靶mRNA 互补结合,对基因的表达起负调节作用或基因沉默作用。miRNA 的发现使生物学许多领域都焕然一新。目前,已有大量的miRNA 被克隆,新的miRNA 又不断被发现。据推算[8],人类基因组中有约1 000 多个miRNA 基因,单个miRNA 可调节200 多个靶基因,约三分之一的蛋白编码基因受miRNA 的调控。RNA-146 是最近发现的一种免疫调控因子,在自身免疫疾病进展中的作用已经成为研究人点,有望成为一种诊断的生物学标志物。
临床上,BRAF 基因突变常用预测预后不佳的基因标志物[9],其与甲状腺癌的浸润、远处转移和复发有着密切联系。通过检测BRAF 基因突变可以对甲状腺癌活检进行辅助诊断,此外还可以进行筛选BRAF 抑制剂来进行靶向治疗[10]。本研究发现,甲状腺癌组织中,miRNA-146 表达阳性率为90.0%,而在正常组织中miRNA-146 表达为阴性,2 组染色评分均值分别为0.07 ±0.03 和7.33 ±0.01,这说明,miRNA-146是高敏感和特异性强的标志物,可以为甲状腺癌诊断提供依据;对miRNA-146 与BRAF 基因突变相关性进行研究后发现,miRNA-146 表达与BRAF 基因突变密切相关,我们推测BRAF突变可能是通过调控miRNA-146 进而对肿瘤细胞的代谢进行调节。
综上所述,在甲状腺癌中,miRNA-146 表达增加,且miRNA-146 表达与BRAF 基因突变密切相关。但是由于本研究样本数量较少,需要加大样本数,对具体的机理进行深入研究。
[1]张 渊,江 泉,张云霄,等.超声造影在典型及不典型甲状腺癌诊断中的价值[J].中国超声医学杂志,2012,28(1):30-33.
[2]Ohashi K,Sequist LV,Arcila ME,et al.Lung cancers with acquired resistance to EGFR inhibitors occasionally harbor BRAF gene mutations but lack mutations in KRAS,NRAS or MEK1[J].Proc Matl Acad Sai USA,2012,109(31):E2127-E2133.
[3]Pratilas CA,Taylor BS,Ye Q,et al.(V600E)BRAF is associated with disabled feedback inhibition of RAF-MEK signaling and elevated transcriptional output of the pathway[J].Proc Matl Acad Sai USA,2009,106(11):4519-4524.
[4]Chan EK,Satoh M,Pauley KM,et al.Contrast in aberrant microRNA expression in systemic lupus erythematosus and rheumatoid arthritis:is microRNA-146 all we need[J].Arthritis and Rheumatism,2009,60(4):912-915.
[5]Jiang X,Li N.Induction of MiR-17-3p and MiR-106a(corrected)by TNFalpha and LPS[J].Cell biochemistry and function,2011,29(2):164-170.
[6]Lee WS,Yoon SJ,Yoon TK,et al.Effects of bone morphogenetic protein-7(BMP-7)on primordial follicular growth in the mouse ovary[J].Molecular Reproduction and Development,2004,69(2):159-163.
[7]Si LKong Y,Xu X.et al.Prevalence of BRAF V600E mutation in Chinese melanoma patients:Large scale analysis of BRAF and NRAS mutations in a 432-case cohort[J].European journal of cancer,2012,48(1):94-100.
[8]Price TJ,Hardingham JE,Lee CK,et al.Impact of KRAS and BRAF Gene Mutation Status on Outcomes from the Phase III AGITG MAX Trial of Capecitabine Alone or in Combination with Bevacizumab and Mitomycin in Advanced Colorectal Cancer[J].Journal of Clinical Oncology,2011,29(19):2675-2682.
[9]Jones DT,Kocialkowski S,Liu L,et al.Oncogenic RAF1 rearrangement and a novel BRAF mutation as alternatives to KIAA1549:BRAF fusion in activating the MAPK pathway in pilocytic astrocytoma[J].Oncogene,2009,28(20):2119-2123.
[10]Ni S,Huang D,Chen X,et al.C-kit gene mutation and CD117 expression in human anorectal melanomas[J].Human Pathology,2012,43(6):801-807.
