结直肠癌中pERK1/2和pAKT表达模式的临床病理意义以及预测预后的价值
2013-01-29吴全李文东赵景明柏楠郭晏同崔爱民张军
吴全 李文东 赵景明 柏楠 郭晏同 崔爱民 张军
(北京积水潭医院普通外科 北京 100035)
ERK1/2(Extracellular signal-related Kinase1/2)是Ras/Raf/MEK/ERK信号通路中重要分子,被EGFR激活发生磷酸化,穿越核膜进入胞核,抑制NF-κB、AP-1等转录因子,参与抑制肿瘤细胞凋亡、促进细胞周期运行[1]。丝氨酸/苏氨酸激酶(Serine/threonine Kinase,AKT)在转导PI3K 始动的生物信号过程中发生磷酸化并向下调控其目标因子,进而抑制肿瘤细胞凋亡、促进肿瘤血管的生成,PI3K/AKT通路活化也受EGFR、Ras分子调节[2]。不少研究发现在结直肠癌(Colorectal cancer,CRC)中ERK1/2、AKT信号通道异常活化,但是二者磷酸化(Phosphorylation,p)表达模式与CRC临床病理特征的关系各家报道的结果并不完全一致[3~6],并且它们共同预测预后的价值尚有待探讨,本研究针对上述问题运用免疫组化方法检测CRC手术标本中pERK1/2、pAKT表达并进行相关的生存分析,以期丰富它们表达意义的认识。
1 材料与方法
1.1 研究对象 2005年1月至2009年12月接受手术治疗的84例CRC患者,手术切除标本经石蜡切片证实为腺癌。本组病例男45例,女39例,年龄66.9±11.1岁,结肠癌71例,直肠癌13例,临床Ⅰ~Ⅳ期(AJCC/UICC分期)病例分别为22、26、24和12例,另收集13例因腹外伤行结肠或直肠切除病例,作为对照组,其中男8例,女5例,年龄40.0±13.3岁。CRC病例既往无恶性肿瘤病史,术前未接受放化疗,对照病例不合并恶性肿瘤。
1.2 实验方法
1.2.1 免疫组化切片制备 调取上述病例存档石蜡块,采样部位为CRC癌灶和癌旁5cm以远的正常肠黏膜以及对照病例肠黏膜,4μm厚度连续切片,放置于防脱玻片上。
1.2.2 免疫染色 采用MaxVisionTM即用型快速免疫组化一步法。切片常规脱蜡、水化,柠檬酸盐高温高压抗原修复,3%过氧化氢阻断内源性过氧化物酶、山羊血清封闭,滴加相应一抗:pERK1/2(Thr185+Tyr187)鼠单抗(1∶100,ab50011,Abcam Inc,USA)和pAKT(Ser473)兔单抗(1∶150,CST3787,Cell Signaling,USA),4℃过夜;滴加MaxVisionTM2(KIT-5930,福建迈新)工作液于37℃下孵育30min,DAB显色3min,苏木素复染、脱水、透明、中性树脂封片。
1.2.3 结果判断 以黏膜上皮细胞的染色强度和阳性比例数进行综合评定待测因子的表达等级。高倍视野下(400×)观察300个细胞,胞浆或胞核呈淡红棕色评1分,中度着色2分,深染3分,计算各分值细胞比例,代入综合评分IHCs=1分细胞%×1+2分细胞%×2+3分细胞%×3,随机观察5个高倍视野取平均值,IHCs均值<0.1判定为不表达(-),≤0.1—1为弱阳性(+),<1.0-1.5为中等阳性(++),>1.5为强阳性(+++)。
1.3 随访 采用书信与电话相结合的方式,截止日期:2012年11月30日。
1.4 统计学处理 计量资料采用±sD表示,两组间均数比较采用t或t′检验,多组间均数比较采用单因素ANOVA分析,两两比较采用Bonferroni法;计数资料采用百分率表示,率的比较采用χ2检验,相关分析采用Spearman等级相关分析;生存分析采用寿命表法。检验水准取α=0.05,P<0.05认为差异有统计学意义。
2 结 果
2.1 pERK1/2和pAKT表达模式与CRC临床病理特征的关系 在癌组织和正常肠黏膜中均可见pERK1/2和pAKT表达,阳性颗粒分布于胞核及胞浆内,参见图1。在CRC病例中,癌灶pERK1/2和pAKT表达率分别为65.5%和58.3%,癌旁为45.2%和44.0%,癌灶pERK1/2、pAKT表达率与癌旁比较,差异无统计学意义,P>0.05。对照病例肠黏膜pERK1/2、pAKT表达率分别为30.8%、15.4%,显著低于癌灶,P<0.05。pERK1/2单阳性表达病例的肿瘤直径(6.45±2.8cm)显著大于pAKT单阳性病例(4.00±1.9cm),P=0.012;pERK1/2、pAKT双阳性病例LN发生转移的阳性率为52.9%,显著高于双阴性病例(7.1%),P=0.003,见表1。
癌灶pERK1/2表达与pAKT(r=0.247)、肿瘤T分期/浸润深度(r=0.269)、N 分期(r=0.253)、肿瘤分化度(r=0.257)呈显著正相关;癌灶pAKT表达与肿瘤N分期(r=0.292)呈显著正相关,P<0.05;癌灶pERK1/2或pAKT表达与性别、年龄、肠梗阻、CEA和 Hb水平、肿瘤部位、大小、组织学类型、临床分期不相关,P>0.05。
2.2 随访结果 术后随访率81.0%(68/84例),随访期内死亡23例(死亡原因与CRC相关),无局部复发,发生远隔部位转移14例。1、3、5年总体生存率分别为87.2%、42.3%、18.6%,I~IV期5年生存率分别为50.7%、35.9%、19.1%、0%,中位生存时间(月)分别为65.2、41.9、39.4、36.9,I期和III、IV的5年生存率、中位生存时间有统计学差异,P<0.05。
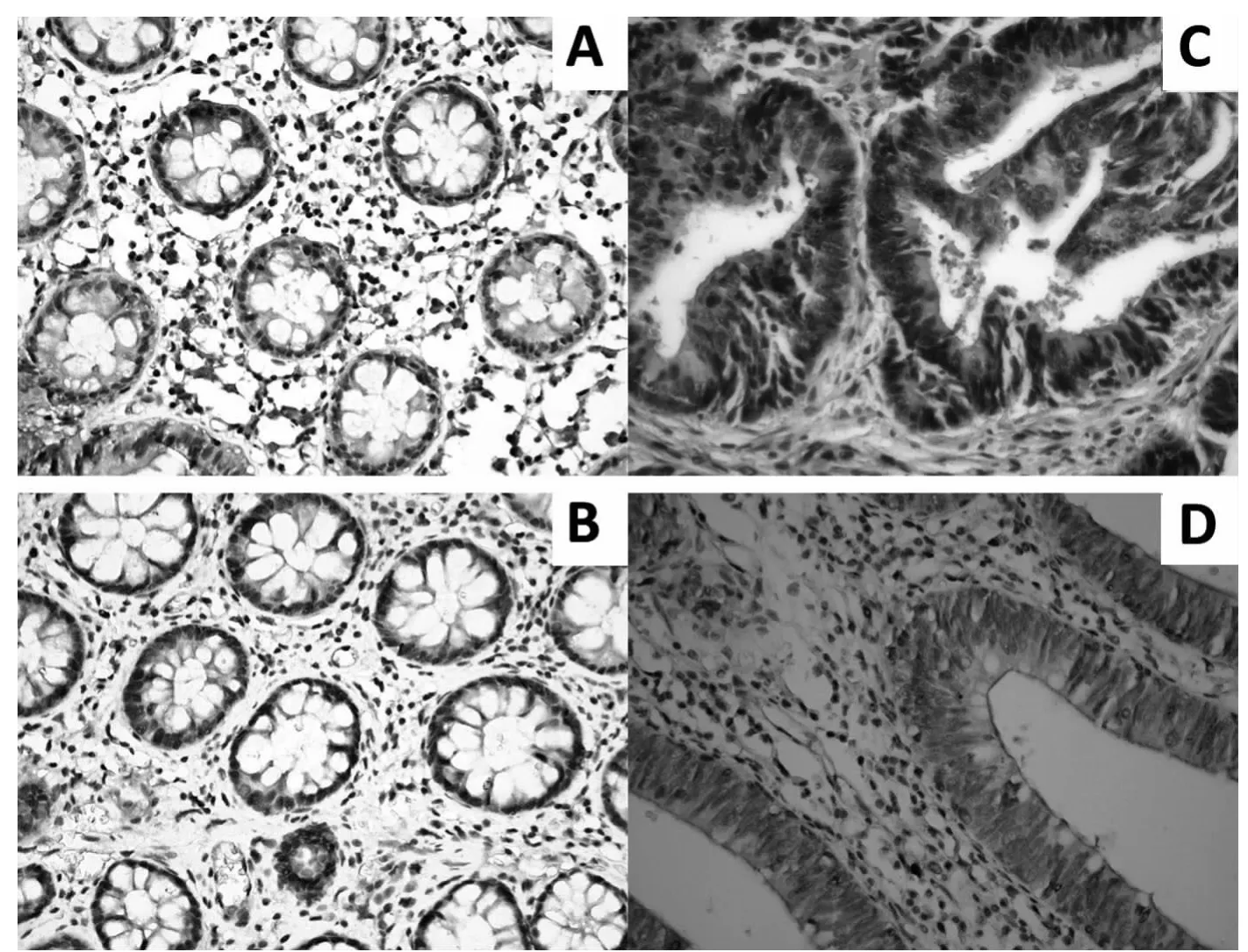
图1 对照病例肠黏膜和CRC癌灶pERK1/2和pAKT的表达(400×)

表1 84例CRC癌灶pERK1/2、pAKT表达模式与临床病理特征的关系
2.3 pERK1/2和pAKT与预后 癌灶pERK1/2(+)病例的5年生存率为31.7%,中位生存时间46.2月,pAKT(+)5年生存率37.1%,中位生存时间48.5月,pERK1/2(+)pAkt(+)5 年生存率28.6%,中位生存时间39.8月,pERK1/2(-)pAKT(-)5年生存率43.1%,中位生存时间56.8月,任二者之间5年生存率、中位生存时间无统计学差异,P>0.05。
3 讨 论
在既往的研究中,pERK1/2、pAKT抗凋亡作用研究较为透彻:磷酸化Bcl-2的Ser-70位点激活Bcl-2的完整抗凋亡功能[7],上调DNA结合蛋白AP-1的活性,促进凋亡抑制因子Bcl-xl表达[8、9],但是它们与CRC临床病理的关系在目前的文献报道中不完全一致。Amsterdam 等人[3]发现pERK1/2表达阳性的结肠癌Kras表达增强,p53表达减弱,提示pERK1/2表达与肿瘤发生相关,相对低分化肿瘤,高分化的肿瘤p53表达水平增强而pERK1/2表达减弱,相类似的,CRC癌灶pAKT表达与肿瘤的分化、T和N分期呈正相关,在LN阴性的乳腺癌病人中,pAKT表达阳性与Her2/neu过表达强烈相关,患者生存期更短[4、6、10],但是 Baba等[5]分析717例CRC却发现pAKT表达阳性与高等级肿瘤(Ⅲ~Ⅳ级)呈显著负相关,阳性表达病例有更长的生存期,他们认为pAKT表达是预后良好的标志。
本研究发现,癌灶pERK1/2和pAKT阳性表达率显著高于对照组,癌灶阳性表达率与癌旁比较有增高的趋势,进一步相关分析发现,癌灶pERK1/2表达与pAKT正相关,并且它们与肿瘤的大小、浸润深度、分化程度、T和N分期显著正相关,尤其是二者共表达显著与N分期相关,这些结果共同提示pERK1/2、pAKT信号通道异常激活是CRC的一个特征变化,我们更倾向于认为二者表达水平上调可能在肿瘤进展、侵袭性增强方面发挥了积极的作用。造成pAKT表达意义在不同研究结果中出现差异的原因,我们推测可能与方法学(pAKT一抗识别的磷酸化位点、阳性判定标准等)以及入选病例不同有关,Baba等人的研究中很多病例有PI3kCA基因突变[5]。
在生存分析中,我们发现pERK1/2、pAKT双阳性表达病例、单阳性病例、双阴性病例的5年生存率和中位生存时间在趋势上依次上升,虽然最终统计学分析无显著性差异,这可能与病例数相对较少有关,但是结果在一定程度上有助于佐证了pERK1/2、pAKT表达与肿瘤恶性程度、侵袭性有关,二者共表达提示肿瘤有更强的侵袭性和转移潜能。由于CRC发生、进展是一个后生渐成的事件,与多基因表达或缺失效应的累积相关,从我们的研究结果看,尚不能体现pERK1/2、pAKT作为独立因子用于预测预后的价值,因此,二者可能更多时候仅在信号传导通路中扮演居中调控的角色。总之,pERK1/2、pAKT在CRC中异常表达提示肿瘤高侵袭性和转移潜能,阻断或下调其表达可能使肿瘤降期,它们有希望成为肿瘤治疗的作用位点。
[1]Balmanno K,Cook SJ.Tumour cell survival signalling by the ERK1/2pathway[J].Cell Death Differ,2009,16(3):368-377.
[2]Datta SR,Brunet A,Greenberg ME.Cellular survival:aplay in three Akts[J].Genes Dev,1999,13(22):2905-2927.
[3]Amsterdam A,Shezen E,Raanan C,et al.Two initiation sites of early detection of colon cancer,revealed by localization of pERK1/2in the nuclei or in aggregates at the perinuclear region of tumor cells[J].Int J Oncol,2012,40(3):782-788.
[4]Henderson-Jackson EB,Helm J,Ghayouri M,et al.Correlation between Mcl-1and pAKT protein expression in colorectal cancer[J].Int J Clin Exp Pathol,2010,3(8):768-774.
[5]Baba Y,Nosho K,Shima K,et al.Phosphorylated AKT expression is associated with PIK3CA mutation,low stage,and favorable outcome in 717colorectal cancers[J].Cancer,2011,117(7):1399-1408.
[6]齐建康,黄晓丽,蒙张敏,等.结肠癌组织中PTEN蛋白表达与P13K/AKT信号通路的关系[J].四川大学学报(医学版),2009,40(4):644-646.
[7]Deng X,Ruvolo P,Carr B,et al.Survival function of ERK1/2as IL-3-activated, staurosporine-resistant Bcl2kinases[J].Proc Natl Acad Sci USA,2000,97(4):1578-1583.
[8]Jazirehi AR,Vega MI,Chatterjee D,et al.Inhibition of the Raf-MEK1/2-ERK1/2Signaling Pathway,BclxL Down-Regulation,and Chemosensitization of Non-Hodgkin’s Lymphoma B Cells by Rituximab [J].Cancer Res,2004,64(19):7117-7126.
[9]Ramljak D,Coticchia CM,Nishanian TG,et al.Epidermal growth factor inhibition of c-Myc-mediated apoptosis through Akt and Erk involves Bcl-xL upregulation in mammary epithelial cells [J].Exp Cell Res,2003,287(2):397-410.
[10]Schmitz KJ,Otterbach F,Callies R,et al.Prognostic relevance of activated Akt kinase in node-negative breast cancer:a clinicopathological study of 99cases[J].Mod Pathol,2004,17(1):15-21.
