超声评分法对甲状腺微小乳头状癌中央区淋巴结转移风险的预测价值
2019-04-12汤靖岚侯春杰胡巧洪何洪峰何跟山鲁科峰
汤靖岚 侯春杰 胡巧洪 何洪峰 何跟山 鲁科峰
癌灶最大径≤10mm的甲状腺乳头状癌被定义为甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC),是一种低度恶性且进展缓慢的甲状腺肿瘤,大部分患者术后预后良好。多项研究提示,中央区淋巴结转移是PTMC患者术后局部复发和预后不良的独立危险因素[1-2],而手术切除原发灶并行患侧中央区淋巴结清扫是改善预后的关键[3-4]。因此,提高术前中央区淋巴结转移的诊断率,对PTMC患者的术式选择和预后改善有着至关重要的作用。笔者收集PTMC癌灶的多项超声特征,筛选出中央区淋巴结转移的独立预测因子,并根据这些因子设计超声评分法进一步在临床上验证其对PTMC中央区淋巴结转移的预测价值。
1 对象和方法
1.1 对象 收集2015年10月至2017年9月经我院手术病理证实为PTMC的278例患者,共316个腺叶伴同侧中央区淋巴结切除标本,其中男96例,女182例,年龄 19~67(40.8±11.2)岁。根据中央区淋巴结转移情况分为转移组和阴性组,其中转移组118个腺叶(37.34%),阴性组198个腺叶(62.66%)。纳入标准:(1)经手术明确PTMC诊断及患侧中央区淋巴结转移情况的初发患者;(2)术前超声图像清晰可查;(3)术后病理信息完善。排除标准:(1)术前超声图像不清晰;(2)病理信息不全;(3)伴有其他头面部、颈部恶性肿瘤病史者。连续纳入2017年10月至2018年3月经我院细针穿刺确诊PTMC的入院待手术患者158例,共206个待切除腺叶伴同侧中央区淋巴结作为验证组(同侧叶多发灶一般仅穿刺直径最大、恶性特征最明显的主要病灶)。其中男 61 例,女 97 例,年龄 25~69(43.5±9.7)岁。两组患者的性别、年龄比较差异均无统计学意义(均P>0.05)。
1.2 检测仪器 Philips IU22彩色多普勒超声诊断仪(荷兰飞利浦公司),线阵探头(频率7~12MHz);声蓝彩色多普勒超声诊断仪(法国声科公司),线阵探头(频率4~15MHz)。
1.3 方法 由2位经验丰富的超声医师分别观察癌灶超声图像并记录以下10个超声特征的诊断结果:(1)癌灶单发/多发;(2)癌灶最大径;(3)癌灶纵横比;(4)癌灶内部回声;(5)癌灶内微钙化;(6)癌灶内部囊性变;(7)癌灶内部血供;(8)癌灶边界;(9)侵犯甲状腺包膜;(10)患侧叶甲状腺实质回声。2位超声医师对彼此的诊断结果互不知情。
1.4 统计学处理 (1)一致性分析:对2位超声医师诊断结果中除(2)和(3)外的8个超声特征做一致性检验,计算Kappa值,当一致性不好时剔除该超声特征,以减少偏倚。(2)独立预测因子筛选:采用SPSS 22.0统计软件,以是否伴有中央区淋巴结转移的病理结果作为因变量,以癌灶的10个超声特征作为待筛选的自变量进行logistic回归分析,筛选出PTMC中央区淋巴结转移的独立预测因子。(3)超声评分法:以每个独立预测因子阳性记1分,阴性记0分作为评分标准,对验证组206个腺叶进行超声评分,并以手术病理作为金标准进行对比,计算超声评分法预测中央区淋巴结转移的ROC曲线AUC,得出最佳诊断评分值,并计算该评分值的灵敏度和特异度。
2 结果
2.1 超声特征一致性检验 对所有超声变量进行统计学赋值,赋值情况见表1。
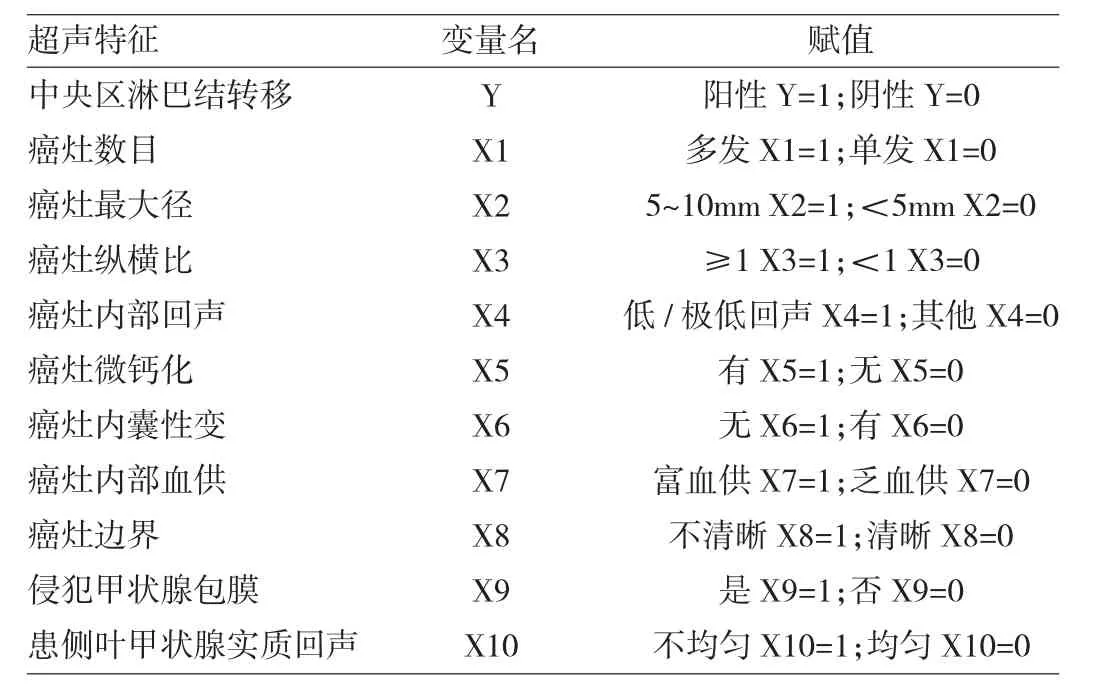
表1 超声特征变量赋值表
对除X2和X3外的8个超声特征做一致性检验,计算Kappa值,Kappa值>0.75一致性好,0.40~0.75一致性较好,<0.40一致性差。本研究中的8个特征一致性均较好,结果见表2。
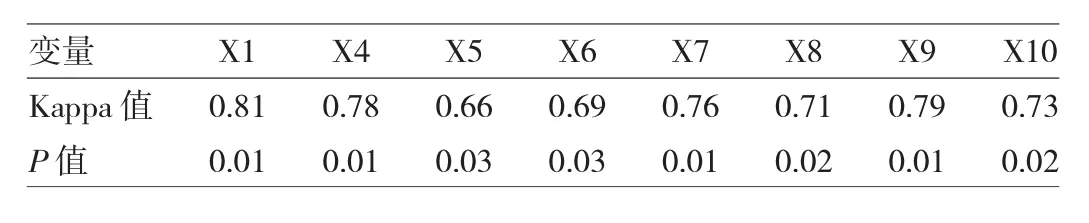
表2 超声特征的一致性分析结果
2.2 超声评分法 最终筛选出的独立预测因子为癌灶多发、癌灶最大径≥5mm、癌灶边界不清以及侵犯甲状腺包膜,见表3。每侧腺叶内PTMC癌灶的超声总评分为:0~4分(癌灶多发1分,单发0分;癌灶最大径≥5mm:是1分,否0分;癌灶边界不清:是1分,否0分;侵犯甲状腺包膜:是1分,否0分)。超声评分法中央区淋巴结转移阳性示例图见图1,阴性示例图见图2。
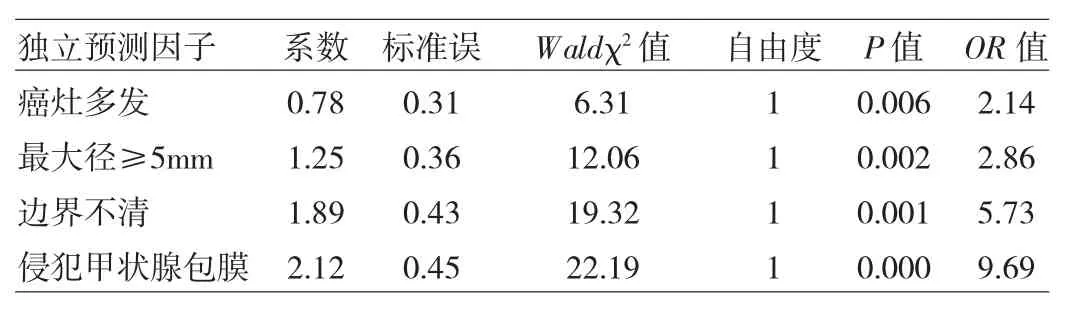
表3 logistic回归分析结果
2.3 ROC曲线分析 验证组206个腺叶中,手术病理证实中央区淋巴结转移阳性66个(32.04%),阴性140个(67.96%)。根据上述评分标准计算验证组206个腺叶各自的超声总评分,并与病理结果作比较,计算出超声评分法的AUC为0.89,预测价值较高。最佳诊断评分值为3分,即当癌灶出现多发、最大径≥5mm、边界不清以及侵犯甲状腺包膜中的任意3个特征时,预测中央区淋巴结转移阳性灵敏度0.788,特异度0.902。见图3。
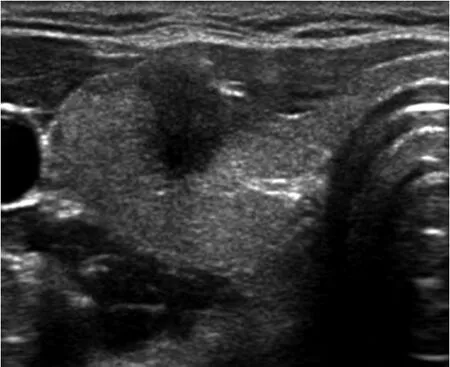
图1 中央区淋巴结转移阳性超声评分法示例图[癌灶最大径9mm(1分),单发灶(0分),边界不清(1分),侵犯甲状腺包膜(1分),该PTMC癌灶超声评分总分3分,预测转移阳性,与病理结果相符]
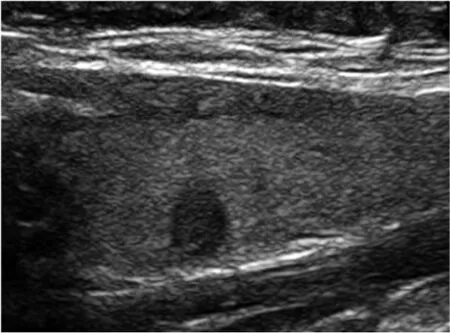
图2 中央区淋巴结转移阴性超声评分法示例图[癌灶最大径5mm(1分),单发灶(0分),边界清晰(0分),未侵犯甲状腺包膜(0分),该PTMC癌灶超声总评分1分,预测转移阴性,与病理结果相符]
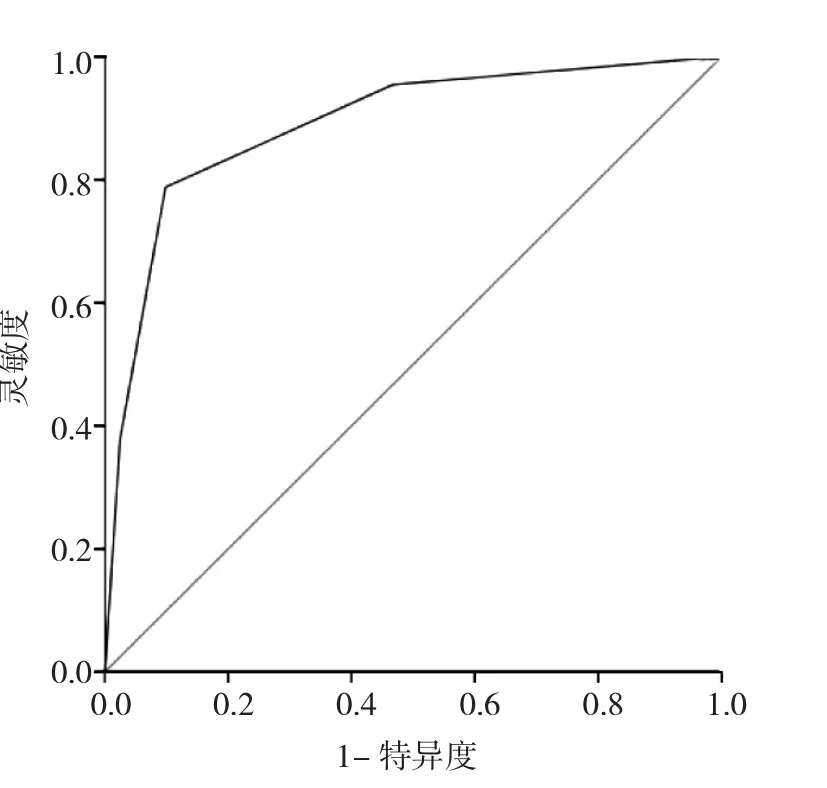
图3 中央区淋巴结转移超声评分法诊断的ROC曲线图
3 讨论
多项研究发现,中央区淋巴结转移是导致PTMC患者术后局部复发的独立危险因素[1-2]。尽管手术切除原发灶并行患侧中央区淋巴结清扫的术式选择是改善此类患者预后的关键,但对术前未发现中央区淋巴结转移的PTMC患者是否应常规进行预防性患侧淋巴结清扫,尚存在较大争议。支持方认为预防性淋巴结清扫能显著降低术后局部复发率,而反对方认为该术式大大增加了术后并发症风险,且对改善预后效果甚微。因此,提高术前中央区淋巴结转移的诊断率,对临床准确选择术式,避免不必要的过度治疗具有至关重要的指导意义。
然而临床触诊和超声检查对中央区淋巴结转移的术前诊断率均不理想,漏诊率约为30%~65%[1,5-6]。本研究所有受试患者共436例(522个腺叶),术后病理确诊中央区淋巴结转移184个,术前超声直接诊断转移102个,漏诊率44.57%,与以往研究结果相符。笔者分析,原因其一是由于PTMC的中央区淋巴结解剖位置隐蔽,超声扫查较难探及,更遑论通过细针穿刺确诊;其二则是转移淋巴结通常体积较小,恶性特征不显著,增加了诊断难度,尤其是当PTMC患者合并桥本甲状腺炎或亚急性甲状腺炎时,中央区淋巴结因反应性增生而肿大,亦会降低超声诊断的灵敏度。
近年来,随着科技的发展和研究的深入,甲状腺癌的超声影像学研究已逐渐转向功能影像学、分子生物学和病理生理学。从理论上讲,癌细胞的侵袭性可通过超声特征直接或间接表现出来,而癌细胞的侵袭性与中央区淋巴结转移直接相关。目前,PTMC癌灶的超声图像特征与中央区淋巴结转移的相关性已得到多项研究证实[7-8]。本研究筛选出的4个独立预测因子:癌灶最大径≥5mm、癌灶多发、癌灶边界不清以及侵犯甲状腺包膜均为甲状腺癌细胞具有较强侵袭性的影像学证据。有研究指出,当癌灶最大径≥5mm时,其肿瘤细胞的生物学行为相较最大径<5mm的癌灶更为活跃,其中央区淋巴结转移风险已与普通甲状腺乳头状癌等同[9]。而一侧腺叶内多灶性的微小乳头状癌,相较单发癌灶扩散性更强,其叠加的荷瘤量往往已超过最大径≤10mm的微小癌范畴,故其中央区淋巴结转移风险大大增加。而当癌灶突破甲状腺包膜后,侵犯腺外组织的肿瘤细胞更容易通过周围组织内的淋巴管侵袭中央区淋巴结。
此外,本研究中发现,癌灶最大径、癌灶边界以及侵犯甲状腺包膜3个超声特征的显示较为清晰直观,诊断正确率较高,而癌灶数目的诊断容易受到多方干扰造成误判。甲状腺良性结节,如结节性甲状腺肿内部发生纤维化、嗜酸性变和出血等变性时会引起超声图像特征的改变,部分结节可出现纵横比失调、边界不清的特征,易将其误诊为癌灶,造成评分高估。而甲状腺弥漫性回声改变以及合并甲状腺多发良性结节则是造成癌灶漏诊,使评分低估的最大干扰因素。因此,癌灶数目的正确判断是影响超声评分准确性的关键因素,超声医师在扫查时务必仔细全面,不要漏掉如锥状叶、腺体边缘等隐蔽位置的癌灶。
本研究超声评分法ROC曲线AUC为0.89,证明该方法对预测PTMC患者中央区淋巴结转移具有较高的诊断效能。该评分法操作简单,便于临床推广应用,作为评分标准的主观超声特征一致性分析结果均较好,证明在不同诊断医师之间具有较高的可重复性和诊断一致性,降低了由医师诊断水平差异造成的人为偏倚。根据预测结果,评分≥3分的PTMC患者应选择手术切除癌灶并清扫患侧中央区淋巴结的术式,以降低术后复发风险。超声评分法对临床制定个性化的治疗方案,避免过度治疗具有重要的指导意义。
