大孔树脂分离纯化苦苣菜黄酮的工艺研究
2012-12-27贾昌喜
安 卓 贾昌喜
(北京农学院食品科学学院,北京 102206)
大孔树脂分离纯化苦苣菜黄酮的工艺研究
安 卓 贾昌喜
(北京农学院食品科学学院,北京 102206)
研究大孔树脂纯化苦苣菜黄酮的条件。利用静态吸附方法筛选纯化苦苣菜黄酮的最适大孔树脂,利用动态吸附方法研究最适大孔树脂纯化苦苣菜黄酮的条件。结果表明,大孔树脂AB-8对吸附苦苣菜黄酮的效果最好,最佳纯化条件:上样液浓度为3.73%,上样液速率为3.6mL/min,上样液pH 5.18;用78.20%的乙醇溶液、以120mL 2.88mL/min的速率洗脱。利用大孔吸附树脂AB-8在上述最佳条件下,吸附率可达84.32%;解吸率91.73%。
大孔树脂;静态吸附;动态吸附;苦苣菜;黄酮
菊科苦苣属中,苦苣(sonchus oleraceus L.)属于1年至2年生的草本植物,或称做苦荬菜、苣荬菜[1]。苦苣菜中具有芹菜素、木犀草素、苷类等黄酮类物质[2],具有优良的药用价值以及食用价值,而且分布广泛[3]。苦苣菜黄酮类物质能显著改善试验性肝损伤,从其提取的酸性物质能显著对抗肿瘤[4,5]。大孔树脂(macroporous resin)是一种不溶于酸、碱及各种有机溶剂的有机高分子聚合物,具有吸附容量大、吸附速度快、解吸条件温和、易于再生、使用寿命长等优点[6],是近十几年发展起来的一类有机高分子聚合物吸附剂,已广泛应用于各种植物和中草药黄酮类化合物的分离纯化过程[7-9],树脂本身的性质不同程度地影响着分离纯化效果[10-12]。本试验旨在寻找一种适合苦苣菜黄酮纯化的大孔吸附树脂,并研究出最佳纯化条件,为制备高纯度的苦苣菜黄酮提供理论依据。
1 材料与方法
1.1 仪器与试剂
苦苣菜:2011年8月采于北京庞各庄,于120℃干燥至恒重后,粉碎过40目筛,得苦苣干粉,密封包装后置于干燥皿中避光保存;
芦丁标准试剂:分析纯,上海试剂二厂;
无水乙醇、硝酸铝、亚硝酸钠、氢氧化钠:分析纯,北京化学试剂公司;
大孔 树 脂:AB-8,D-101,HPD-100,LX-60,LSA-21,NKA,XDA-7,XAD-16,北京九州同业生物科技有限公司。
紫外-可见分光光度计:UV 765CRT,上海精研有限公司;
数控超声波清洗器:KQ-700E型,昆山市超声仪器有限公司;
中草药粉碎机:KS-80,天津泰斯特仪器有限公司;
恒温水浴锅:R-201,上海申生科技有限公司;
电热鼓风干燥箱:DHG-9076A,天津泰斯特仪器有限公司;
精密pH计:PHS-3C型,上海第三分析仪器厂;
电子天平:BT125D,赛多利斯北京公司;
台式低速离心机:L530,湖南赫西仪器装备有限公司;
台式冷冻恒温振荡器:THZ-C-1,太仓市实验设备厂;
恒流泵:HL-Z,上海沪西分析仪器厂有限公司;
自动部分收集器:BSZ-100,上海沪西分析仪器厂有限公司。
1.2 试验方法
1.2.1 黄酮粗提液的制备 称取4.00g苦苣菜干粉,加入40mL乙醇溶液充分溶解,按照乙醇体积分数50%、提取时间3.33h、提取温度84℃、料液比1∶50(m∶V)的条件,采用乙醇回流提取法提取,收集提取液,抽滤,得到苦苣菜黄酮粗提取液。
1.2.2 标准曲线的制作 根据文献[13]制作标准曲线,以浓度C(mg/mL)为横坐标,吸光度A为纵坐标,得回归方程A=1.180 1C+0.009 4,R2=0.999 9。
1.2.3 测定样品中黄酮浓度 精密称取定量提取液,按1.2.2节操作,在波长510nm处测定其吸光度,由回归方程计算样品中黄酮浓度(mg/mL)。
1.2.4 大孔树脂的预处理 首先用去离子水冲洗大孔树脂以除去其杂质,再将树脂用95%乙醇充分浸泡24h,使其充分溶胀,后装入玻璃层析柱,以一定流速使用无水乙醇洗涤大孔树脂,直到完全去除流出液中醇溶杂质,再以浓度为4%的稀盐酸浸泡树脂,以去离子水洗涤树脂使其pH值为中性,最后以浓度为2%的氢氧化钠浸泡树脂,以去离子水洗涤树脂使其pH值为中性。
1.2.5 树脂的静态吸附和解吸率的测定 精确称取已处理好的8种树脂 HPD-100、D101、AB-8、NKA、LX-60、XDA-7、LSA-21、XAD-16各1g(干质量),分别置于8个50mL具塞磨口锥形瓶中,各加入30mL苦苣菜黄酮提取液,密封,在25℃恒温振荡器中震荡吸附24h后,测定吸附前后黄酮浓度的变化,按照式(1)和式(2)计算各树脂的吸附容量和吸附率。测定完毕,用80%乙醇溶液进行洗脱,测定解吸附液中黄酮类物质的浓度,按式(3)计算解吸附率,确定具有良好纯化性能的树脂。

式中:
CA—— 吸附容量,mg/g;
R1—— 吸附率,%;
R2—— 解吸率,%;
C0—— 起始浓度,mg/mL;
C1—— 平衡浓度,mg/mL;
C2—— 解吸液浓度,mg/mL;
V—— 吸附液体积,mL;
m——树脂干质量,g。
1.3 吸附与解吸附条件的优化
用去离子水浸泡树脂AB-8,使其充分溶胀,并抽真空1h。采用湿法装柱,将苦苣菜提取液注入树脂柱中,待样品溶液全部通过树脂柱后,用去离子水冲洗至流出液无色,以一定浓度的乙醇进行洗脱,收集乙醇洗脱液,经真空干燥后,在510nm处测定黄酮浓度。根据本实验室在吸附与解吸附过程中所确定的单因素试验结果,最终,在吸附过程中选取上样液浓度、上样液速率、上样液pH值3个因素(见表1);在解吸附过程中,选取乙醇洗脱浓度、解吸流速及乙醇洗脱体积3个因素(见表2),依据 Design-Expert 7.0软件采用Box-Behnken Design方法确定其最优工艺。
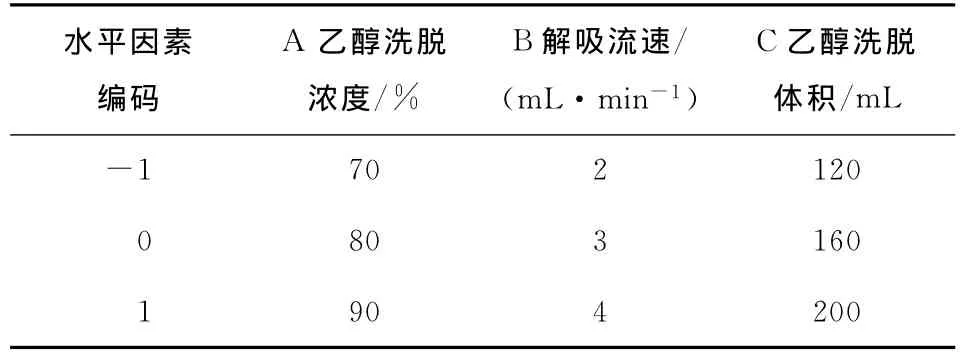
表2 大孔树脂解吸附效果响应曲面因素与水平表Table 2 Factors and levels of RSM
2 结果与分析
2.1 树脂的静态平衡吸附和解吸特性
由表3可知,在8种树脂中,AB-8树脂的单位吸附容量值为最高,达到了23.13mg/g,其吸附率和解吸率也为最高,分别达到了74.85%和82.36%,与其他8种树脂相比,树脂AB-8最适宜分离纯化苦苣菜黄酮,因此选用其来分离苦苣菜黄酮。
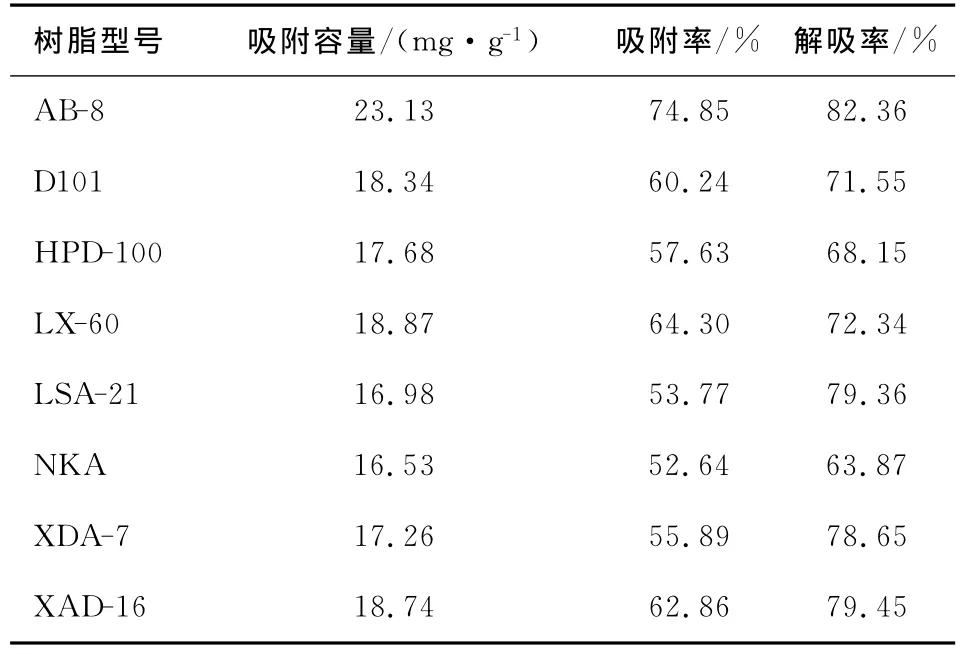
表3 不同树脂对苦苣菜黄酮吸附容量、吸附率及解吸率Table 3 Construction Parameter of Resins,Adsorption and Desorption Properties on Flavonoids
2.2 苦苣菜黄酮分离纯化工艺的优化
在吸附过程中,上样液pH值、上样液浓度、上样液流速等因素都会影响大孔树脂对黄酮的吸附效果。在解吸附过程中,乙醇洗脱浓度,乙醇洗脱体积以及解吸流速对解吸附过程会产生不同的影响。根据Box-Behnken试验设计原理,综合本实验室单因素试验,分别采用3因素3水平的响应面分析方法来优化苦苣菜黄酮的吸附和解吸附过程,结果见表4、表5。
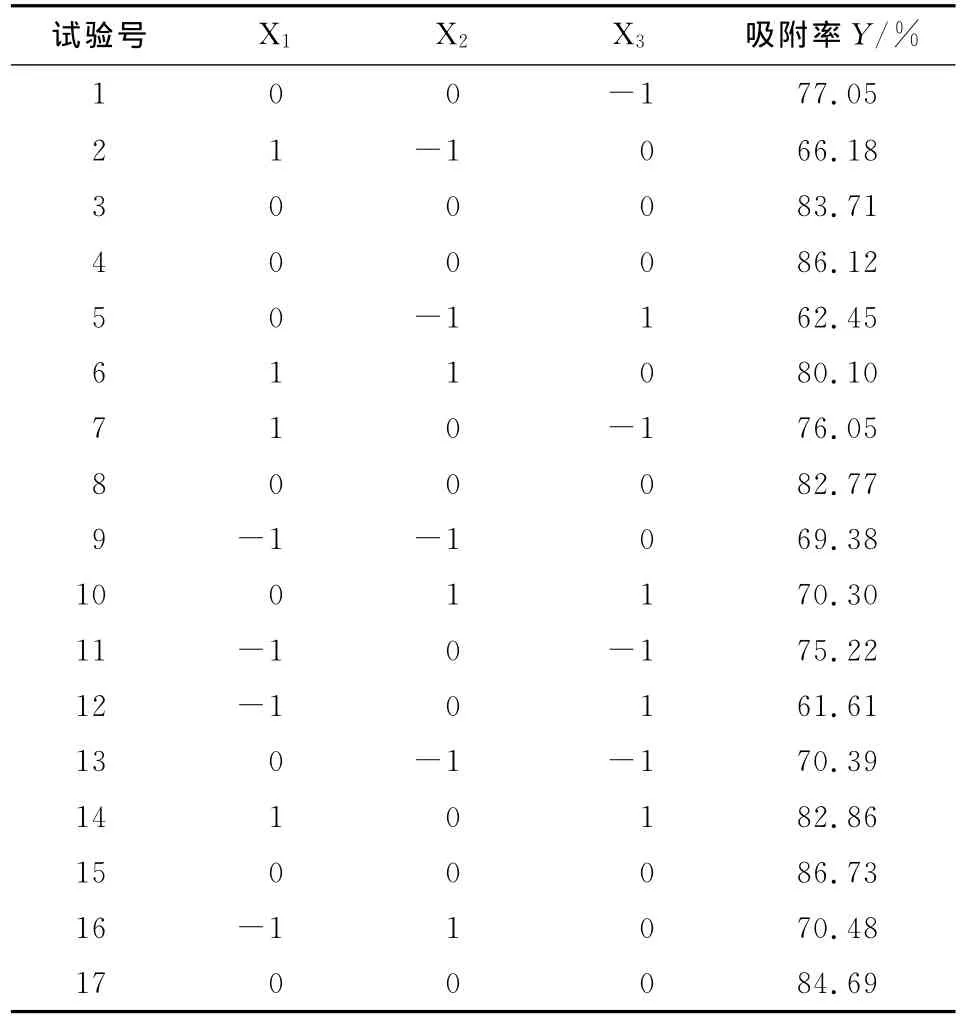
表4 吸附试验结果Table 4 Experiment design and result of response surface method analysis
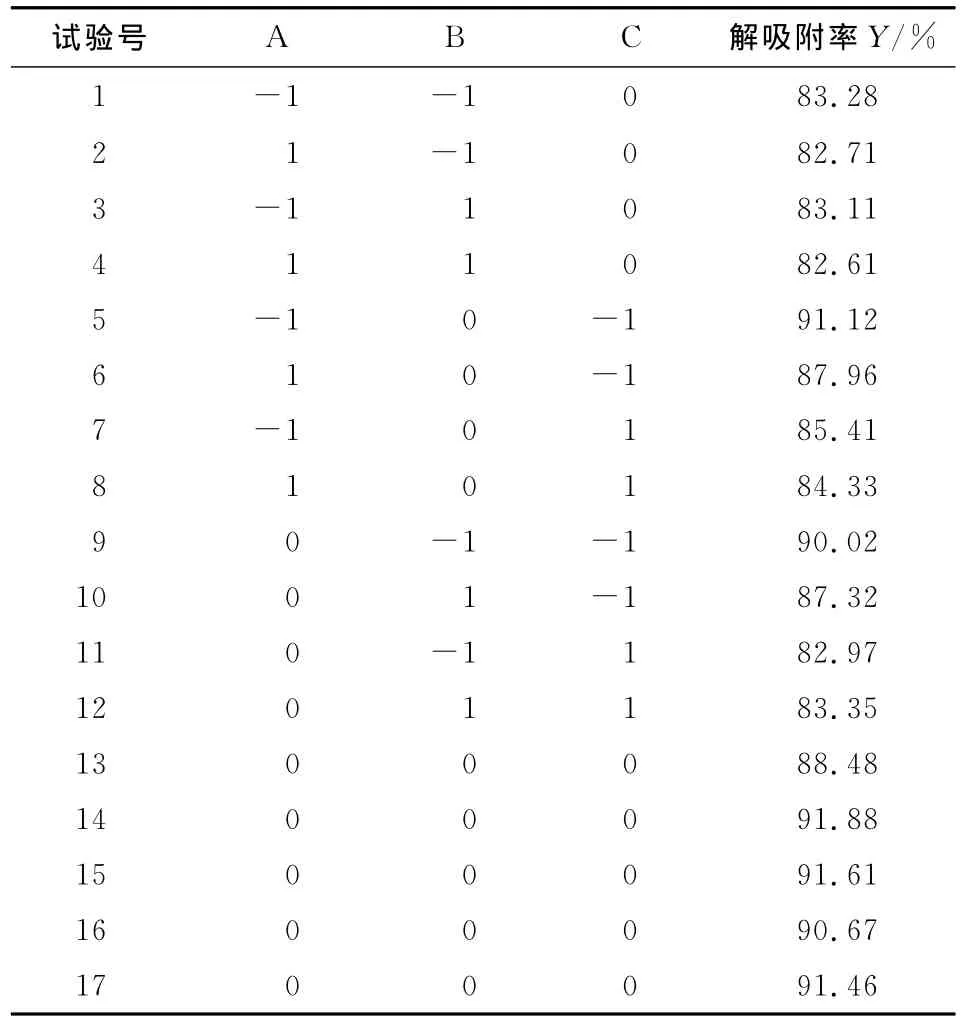
表5 解吸附试验结果Table 5 Experiment design and result of response surface method analysis
在吸附过程中,由二次曲面模型拟合得回归方程:
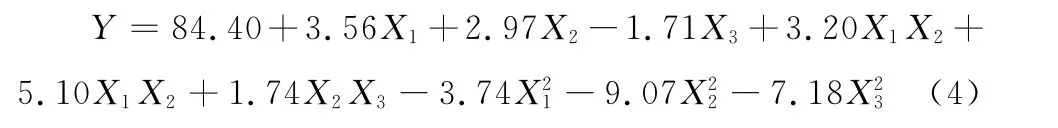
式(4)P值为0.000 8<0.01,可判别响应值与全体自变量变化关系为显著相关,其R2为0.951 5,说明响应值中有95.15%来源于模型中全体自变量,其中,一次项、二次项对响应值有显著性影响,且失拟项不显著(P>0.05),说明该回归模型与实测值能较好地拟合,具有较强可靠性。剔除式(4)中不显著的回归系数,简化后的回归方程:
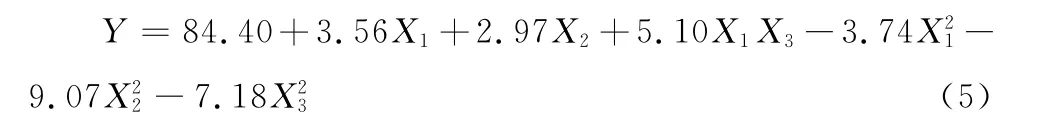
在解吸附过程中,由二次曲面模型拟合得回归方程:
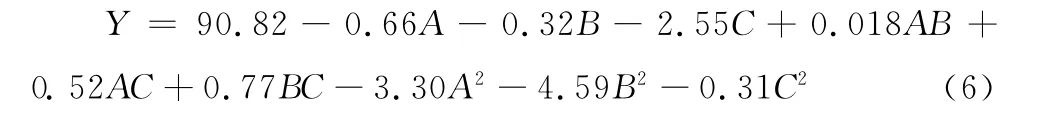
式(6)P值为0.000 7<0.01,其响应值与全体自变量为显著相关,其R2为0.954 2,说明响应值中有95.42%来源于模型全体自变量,其中,一次项、二次项对响应值有显著性影响,且失拟项不显著(P>0.05),说明该回归模型与实测值能较好地拟合,具有较强可靠性。剔除式(6)中不显著的回归系数,简化后的回归方程:
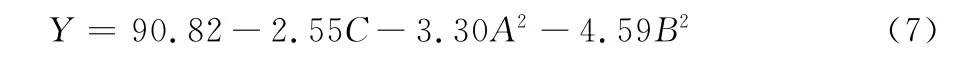
2.2.1 主效应分析 由表6可知,由于式(4)中各因素均经无量纲线性编码处理,且所有回归系数之间都是不相关的,因此,可以由回归系数绝对值的大小来直接比较各因素一次项对苦荞黄酮得率的影响[14]。式(4)中A项和B项,即上样液浓度和上样液速率对吸附率影响最大,各项对响应值的影响大小排序为上样液浓度>上样液速率>上样液pH。
由表7可知,C项和A项,即乙醇洗脱体积和乙醇洗脱浓度对响应值影响最大,各项对响应值影响作用为乙醇洗脱体积>乙醇洗脱浓度>解吸流速。
2.2.2 两因素间的交互效应分析 分别固定原始回归方程(4)、(6)中任意两个因素在零水平,可以得到另外两个因素的双因素模型。由表6可知,其A项(上样液浓度)和C项(上样液pH)的交互效应对模型影响最大,故应重点考察,根据模型作出的响应面图和等高线图见图1。由表7可知,所有交互项的P值均不显著,这说明交互项对于模型的影响较小,可此不做讨论。
由图1可知,上样液pH与上样液浓度之间的相互影响较显著,其最优点非常接近上样液浓度3.00%、上样液pH 5.00,吸附率在其附近达到最大值。
2.2.3 最优提取工艺条件的验证实验 使用Design Expert 7.0软件得到最优提取工艺的吸附率理论最大值为86.20%;工艺条件为上样液浓度3.73%,上样液速率3.6mL/min,pH 5.18。解吸附理论最大值为93.22%;工艺条件为乙醇洗脱浓度78.20%,解吸流速2.88mL/min,乙醇洗脱体积120mL。为检验RSM分析法的可靠性,采用上述最优提取条件进行黄酮的分离纯化试验,实际测得的吸附率为84.32%,洗脱率为91.73%,与理论预测值相比相对误差低于5%。
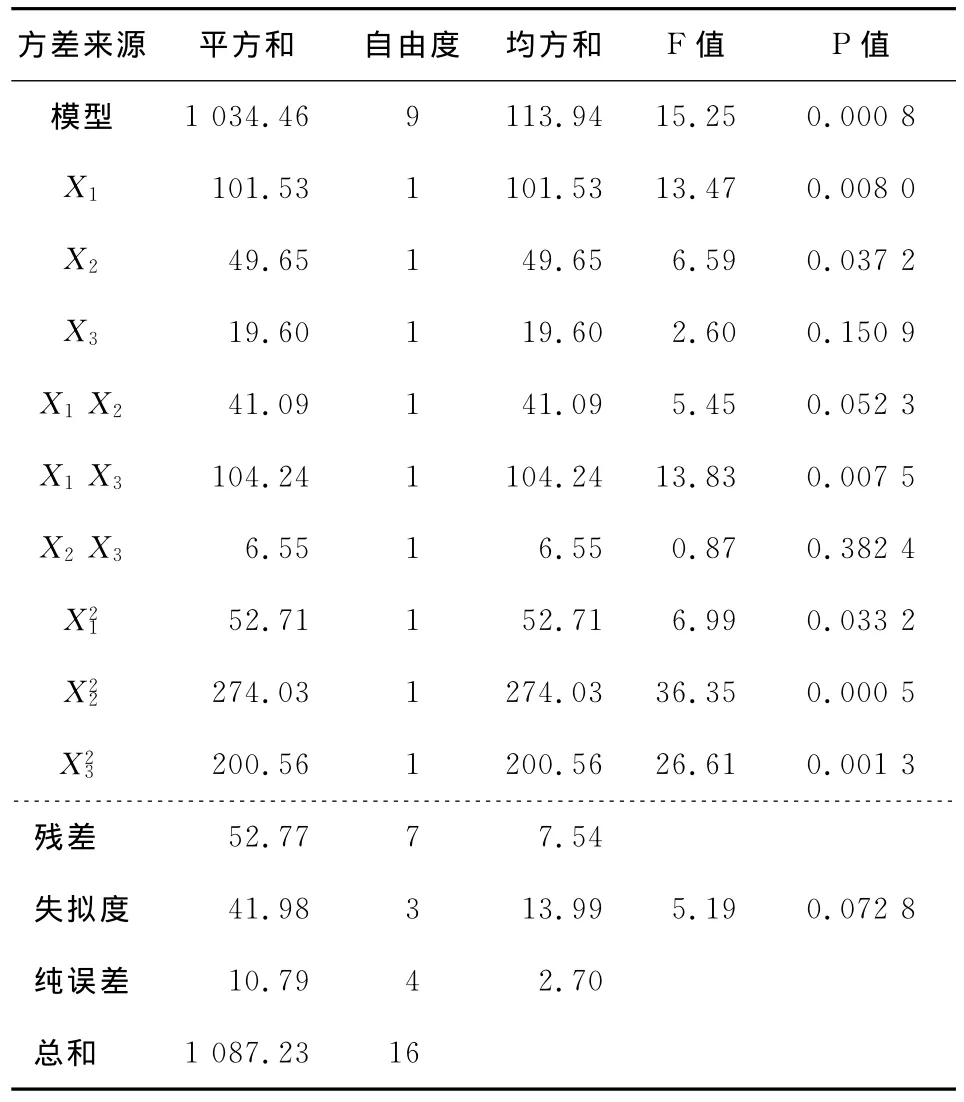
表6 吸附参数数学回归模型分析及各项作用显著性检验 Table 6 Variance analysis of regression equation
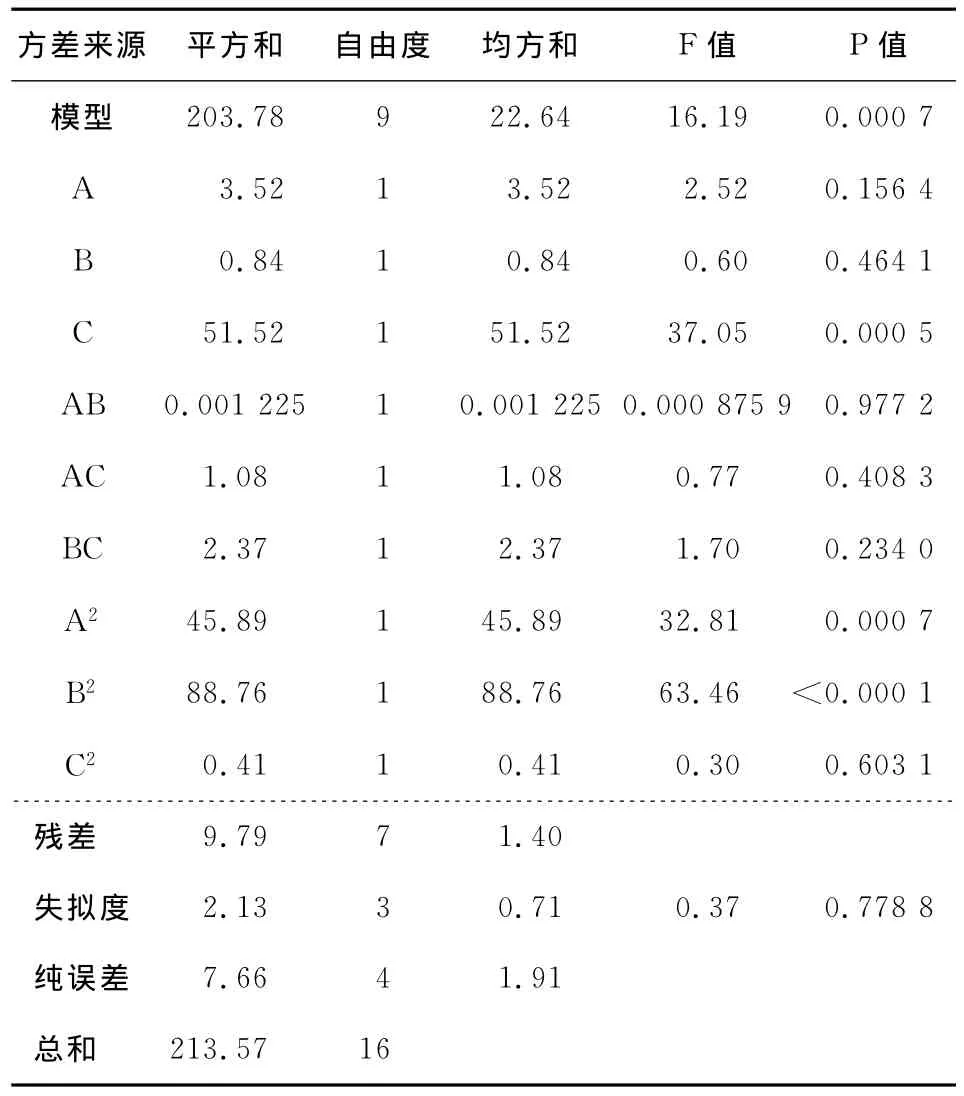
表7 解吸附参数数学回归模型分析及各项作用显著性检验 Table 7 Variance analysis of regression equation
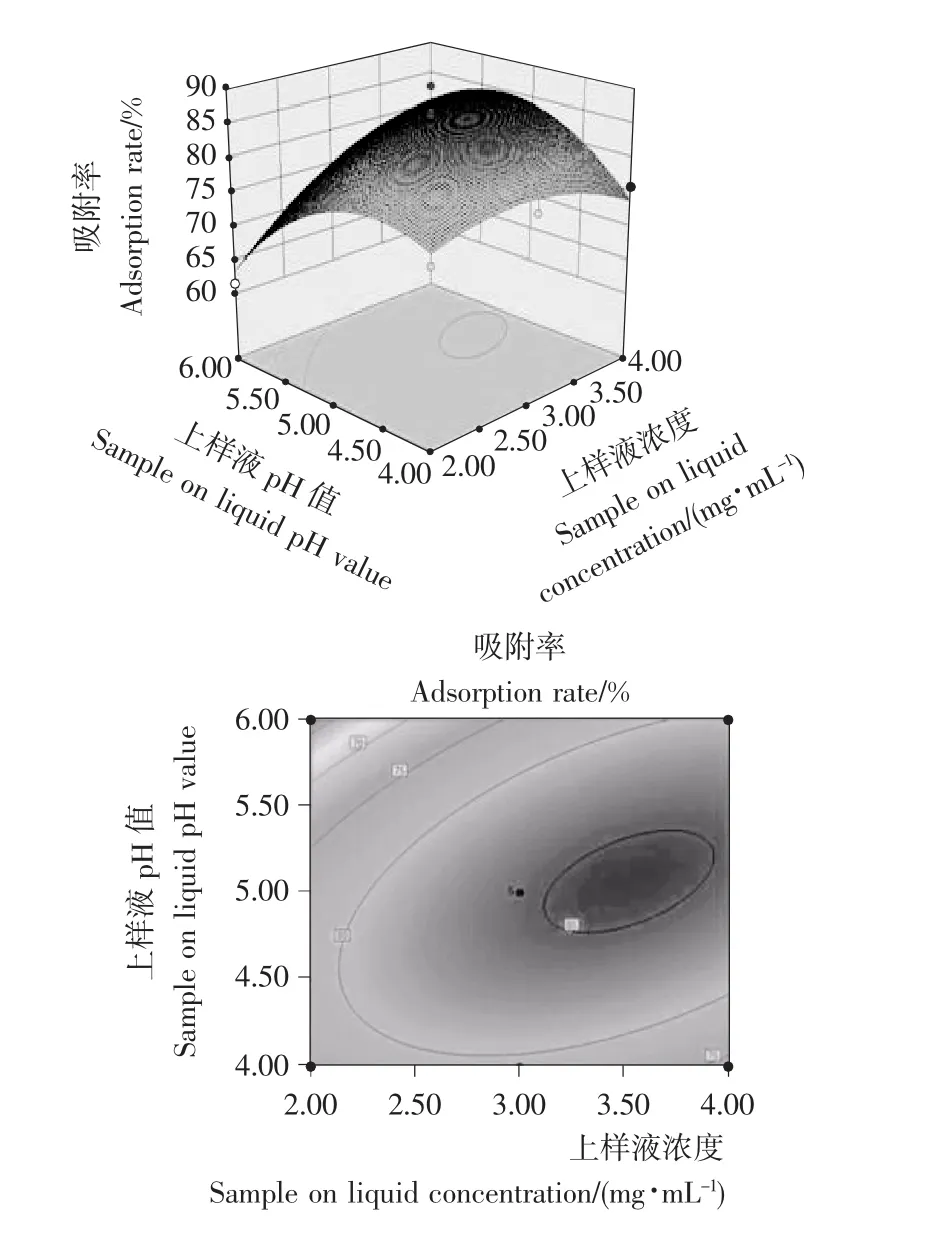
图1 上样液浓度与上样液pH相互作用示意图Figure 1 Interaction of the largest volume and pH value
3 结论
通过比较不同型号大孔吸附树脂对苦苣菜黄酮的吸附解吸特性,可以看出,AB-8大孔吸附树脂是一种性能良好的吸附剂,其对黄酮的单位吸附容量值达到了23.13mg/g,其吸附率和解吸率分别达到了74.85%和82.36%,将响应面分析(RSM)应用于纯化苦苣菜黄酮工艺,采用合理的试验设计对纯化工艺进行研究。依据BBD试验设计原理求得最佳纯化工艺条件,即吸附最佳条件为上样液浓度3.73%,上样液速率3.6mL/min,上样液pH 5.18;解吸附最佳工艺条件为乙醇洗脱浓度78.20%,解吸流速2.88mL/min,乙醇洗脱体积120mL。
1 陈辉,苏娜,张苑.苦菜的开发与利用[J].食品研究与开发,2004,25(2):89.
2 徐燕,梁敬钰.苦苣的化学成分[J].中国药科大学学报,2005,36(5):411~413.
3 覃成,高健,罗希榕.苦苣总黄酮提取工艺及HPLC法测定芦丁的含量[J].贵州农业科学,2010,38(5):199~201.
4 蒋雷,王国荣,姚庆强.苦苣属植物化学成分及药理活性研究进展[J].齐鲁药事,2007,26(11):670~672.
5 王二霞,赵健,琚争艳,等.苦菜及其研究开发现状[J].食品工业科技,2008,29(10):272~274.
6 何伟,李伟.大孔树脂在中药成分分离中的应用[J].南京中医药大学学报,2005,21(2):134~136.
7 陈玉琼,李安琪,孟燕.大孔树脂纯化藤茶黄酮及主要成分结构鉴定[J].食品科学,2009,30(9):51~55.
8 刘延吉,孙素梅,王学密,等.AB-8型大孔树脂分离纯化南果梨黄酮类化合物的研究[J].食品工业科技,2008,29(2):68~70.
9 李淑珍,李进,杨志江,等.大孔树脂分离纯化黑果枸杞总黄酮的研究[J].食品科学,2009,30(1):19~24.
10 潘道东,林璐.DA201-C大孔吸附树脂静态吸附ACE抑制肽的研究[J].食品科学,2009,30(5):20~23.
11 任清,张晓平,赵世锋,等.利用大孔吸附树脂DA201-C对燕麦蛋白水解液脱盐的研究[J].食品科学,2009,30(10):118~122.
12 李俶,倪永年,李莉.大孔吸附树脂分离纯化槲寄生中黄酮的研究[J].食品科学,2008,29(2):68~71.
13 安卓,贾昌喜.响应面优化超高压提取苦苣黄酮工艺的研究[J].中国食品学报,2012,12(2):105~110.
14 袁志发,周静芋.试验设计与分析[M].北京:高等教育出版社,2000:372~387.
Study on separation and purification ofSonchus oleraceus Ltotal flavonoids by AB-8 macroporous resin with response surface analysis
AN ZhuoJIA Chang-xi
(College of Food Scienc,Beijing Agricultural University,Beijing102206,China)
To study the purification conditions with macroporous resin inSonchusculture.Using the static adsorption method for screening optimum macroporous resin to be purification ofSonchus oleraceusflavones,using dynamic adsorption method to study optimum macroporous resin conditions of purification ofSonchus oleraceusflavonoid.Results the macroporous resin adsorption of AB-8onSonchus flavonewas the best,the best purification conditions were:3.73%sample concentration,sample liquid rate of 3.6mL/min,sample liquid pH was 5.18;by 78.20%ethanol solution,with 120mL(column volume)2.88mL/min rate elution.Using macroporous adsorption resin AB-8,under the optimum conditions,the adsorption rate is up to 84.32%;desorption rate 91.73%.
macroporous resin;static adsorption;dynamic adsorption;celery;flavone
10.3969/j.issn.1003-5788.2012.03.034
北京市农产品加工与贮藏工程重点建设学科项目(编号:PXM2009_014207078172)
安卓(1986-),男,硕士。E-mail:anzhuo1986@yahoo.cn
贾昌喜
2012-02-11
