EGFR 突变的非小细胞肺癌患者EML4-ALK 融合基因的检测及其临床特征分析*
2012-12-23林小梅莫娟梅曾爱屏于起涛周韶璋宋向群
林小梅, 莫娟梅, 邹 敏, 曾爱屏, 于起涛, 周韶璋, 宋向群△
(广西医科大学1研究生院,2附属肿瘤医院化疗二科,广西 南宁530021)
肺癌是世界上癌症死亡的常见恶性肿瘤之一,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)约占肺癌的80%~85%[1],其中晚期NSCLC 患者的5 年生存率只有约15%,目前在晚期NSCLC 的治疗上,一线含铂的两药化疗方案只使患者获得了8 ~11 个月的中位生存期,其疗效非常有限。随着对肿瘤发病机制及其生物学行为研究的不断深入,人们越来越多将治疗的焦点集中于特异性高、不良反应轻的分子靶向药物。目前NSCLC 的治疗使用最多的是针对表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的分子靶向药物,即小分子的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKIs),其对存在EGFR 突变的NSCLC 患者显示出了很好的临床疗效[2]。目前已证实其突变的优势人群具有以下的临床特征:女性、不吸烟、亚裔和腺癌[3-4]。但在使用TKIs 过程中导致的原发或继发耐药尚难克服,因而对于不能从EGFR-TKIs 治疗中获益或发生耐药的人群来说,寻找新的治疗靶标将显得尤为重要。
2007 年Soda 等[5]首次在非小细胞肺癌中发现了一个新型的融合基因EML4-ALK,此融合基因由棘皮动物微管相关蛋白样4(echinoderm microtubule-associated protein-like 4,EML4)和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)两者的部分基因相互融合而成。EML4-ALK 在不加选择的NSCLC 患者中的总表达率为3.4%[6];而在某些经过筛选的NSCLC 人群中,EML4-ALK 的表达率可高达13.5%[7]。由于EML4-ALK 融合位点的多样性,目前至少发现11 种不同的突变体类型[8]。且EML4-ALK 无论在体外或体内的研究中均具有致癌活性[5,9],这种活性能被ALK 抑制剂有效阻断[9-10],说明其在肺癌的发生过程中起着关键性的作用。
在中国NSCLC 人群中,有研究示EML4-ALK 的表达率为2.9% ~11.6%[11-14],但相关研究仍然非常有限,且进行EML4-ALK 检测的NSCLC 患者例数仍较少。故为丰富中国肺癌分子缺陷目录数据库,本文对102 例经过选择的中国非小细胞肺癌患者进行EML4-ALK 融合基因检测,同时对检测EML4-ALK 融合基因阳性患者的EGFR 和Kirsten 鼠肉瘤基因(Kirsten rat sarcoma,KRAS)的突变情况,并对EML4-ALK阳性和阴性病人的临床及病理特征进行分析。为今后筛选EML4-ALK 突变的潜在临床优势人群及实现以基因分型为基础的NSCLC 个体化治疗提供理论依据和重要的参考。
材 料 和 方 法
1 标本来源
入选实验的102 例非小细胞肺癌患者均为中国人,且必须满足以下至少一个条件(女性、不吸烟/少吸烟和腺癌),病人的组织标本均来自中国广西壮族自治区肿瘤医院的标本库,为2006 年1 月~2011 年8 月期间在广西壮族自治区肿瘤医院胸外科接受手术切除的肿瘤组织标本。肿瘤组织经手术切除后马上浸泡于液氮中,随后保存于-80 ℃冰箱中。
2 病人的临床及病理信息的收集
入选实验的102 例患者,均收集其以下信息:年龄、性别、吸烟史、组织病理分型及临床分期,见表1。病人的组织病理分型参考2004 版世界卫生组织(WHO)的肺癌组织学分类[15],临床分期参考第6 版国际肺癌研究协会(IASLC)的肺癌TNM 分期。

表1 引物序列Table 1. Sequences of the primers
3 主要试剂
RNA 提取试剂盒(RNeasy Mini Kit)为Qiagen 产品;逆转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)为Fermentas 产品;DNA 聚合酶(KOD plus DNA polymerase )为Toyobo 产品;DNA 提取试剂盒(SK1261)和TaqDNA 聚合酶均购自生工生物工程(上海)有限公司;所用引物由宝生物工程(大连)有限公司根据要求合成。
4 主要方法
4.1 EML4-ALK 的检测 首先使用RNA 提取试剂盒提取102 例非小细胞肺癌组织标本的总RNA,具体提取步骤按试剂盒说明书进行。所有提取的总RNA 均经超微量分光光度计(Thermo Scientific NanoDrop 2000)检测其浓度及纯度,其中所有标本的总RNA 的A260/A280均为2.0 ~2.1 之间,且经琼脂糖凝胶电泳验证RNA 的完整性。提取的总RNA 经逆转录试剂盒逆转录成单链cDNA,逆转录步骤按试剂盒说明书进行。单链cDNA 经单管多重反转录-聚合酶链锁反应(multiplex RT-PCR)进行扩增。因为目前已知EML4-ALK 有11种不同的突变体类型(8)[7],为了用cDNA 扩增出所有已知的突变亚型,本实验中单管PCR 反应同时使用了3 对不同的引物[11],见表1。PCR 总反应体积25 μL,其中10 × buffer 2.5 μL,2 mmol/L dNTPs 2.5μL,25mmol/L MgSO4 1μL,上游引物(10 μmol/L)各加入1μL,下游引物(10 μmol/L)3μL,Template cDNA 1μL,PCR grade water 12.3 μL,KOD-Plus 0.7 μL。扩增条件为:94 ℃预变性5 min,94 ℃30 s,58 ℃30 s,68 ℃1 min ,共35 个循环,68 ℃10 min。同时PCR 反应设置内参照为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),其PCR 反应引物见表1。内参照扩增条件为:94 ℃预变性3 min,94 ℃30 s,58 ℃30 s,72℃45 s ,共35 个循环,72 ℃3 min。取RT-PCR 产物8.0 μL,加上样缓冲液2.0 μL,在2%琼脂糖凝胶上电泳,90 V 40 min,凝胶图像分析系统(GelPro Analyzer 3.0)分析目的基因与内参照GAPDH 条带显示,对于显现目的基因条带的PCR产物送上海生工生物工程公司直接测序。
4.2 EGFR 和KRAS 的检测 本文对8 例EML4-ALK 融合基因阳性的患者肿瘤组织标本分别检测其EGFR(18 ~21 外显子)和KRAS(1、2 外显子)的突变情况。首先使用DNA 提取试剂盒提取8 例阳性标本的DNA,后使用各个外显子的相应引物对DNA 进行PCR 扩增,产物直接送上海生工生物工程公司直接测序。
5 统计学处理
用连续校正χ2检验(continuity correction χ2Test)和Fisher 精确概率法(Fisher’s exact test)来分析EML4-ALK 阳性和阴性病人与年龄、性别、吸烟史、病理类型及临床分期之间的联系。所有P 值均基于双向假设检验,以P <0.05 为差异有统计学意义。采用SPSS 13.0 进行数据分析。
结 果
1 EML4-ALK 的突变率及其与临床病理特征之间的联系
在102 例经过选择的非小细胞肺癌患者中检测出8 例EML4-ALK 阳性,其突变率为7.8%(8/102)。将8 例阳性患者肿瘤组织标本的PCR 产物直接测序,其中7 例为EML4-ALK 突变亚型1(variant 1,V1),1 例为EML4-ALK 突变亚型2(variant 2,V2)。经统计分析得出EML4-ALK 阳性和阴性患者在年龄(P >0.05)、性别(P >0.05)、吸烟史(P >0.05)、病理类型(P >0.05)及临床分期(P >0.05)差别均无统计学意义,见图1、2、表2。
2 EML4-ALK 阳性患者在临床病理特征中的构成比
102 例患者的总体平均年龄为(59 ±10)岁(30 ~80 岁),8 例EML4-ALK 阳性患者平均年龄(59 ±5)岁(41 ~80 岁)。在8 例阳性患者中,有5 例患者的年龄小于总体患者的平均年龄,占62.5%(5/8),3 例患者的年龄大于总体患者的平均年龄,占37.5%(3/8)。女性6 例,占75.0%(6/8);男性2例,占25.0%(2/8)。在吸烟史中,7 例患者不吸烟,占87.5%(7/8);1 例患者吸烟,占12.5%(1/8)。在病理类型中,5例为腺癌,占62.5%(5/8);1 例为鳞癌,占12.5%(1/8);2例为腺鳞癌,占25.0%(2/8)。在临床分期中,4 例患者为Ⅰ期,占50.0%(4/8);3 例患者为Ⅲ期,占37.5%(3/8);1 例为Ⅳ期,占12.5%(1/8),见表2。
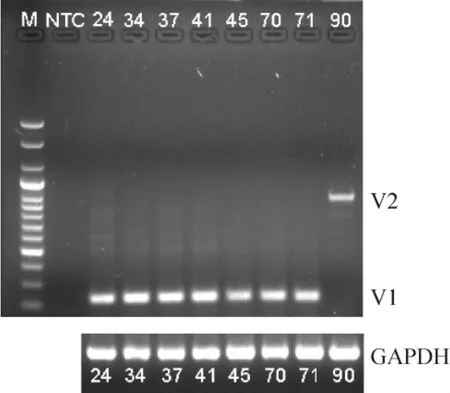
Figure 1. The RT-PCR results of 8 EML4-ALK positive cases.M:maker(100 bp,ladder);NTC:non-template control;24,34,…,90:the number of the positive sample.V1:EML4-ALK variant 1(237 bp);V2:EML4-ALK variant 2(960 bp);GAPDH:glyceraldehyde-3-phosphate dehydrogenase.图1 8 例阳性标本的RT-PCR 产物

Figure 2. Base sequencing figures of positive samples. A:EML4-ALK variant 1;B:EML4-ALK variant 2.图2 阳性标本的碱基测序图

表2 病人临床病理特征及EML4-ALK 阳性与阴性病人的临床病理特征的对比Table 2. A summary of all patients with clinicopathological features and the comparison of clinicopathological features between the EML4-ALK-positive and-negative patients
3 EML4-ALK 阳性病人的EGFR 和KRAS 突变情况
经过检测发现,8 例EML4-ALK 融合基因阳性的患者均无EGFR(18 ~21 外显子)及KRAS(1、2 外显子)的突变。
讨 论
自从2007 年Soda 等[5]首次在NSCLC 患者身上发现了一个新的EML4-ALK 融合基因后,陆续有许多学者对其进行了研究。对于EML4-ALK 在非小细胞肺癌中的突变率,不同文献的报道稍有差异。杨衿记等[6]综合全球17 个研究的数据得出,EML4-ALK 在不加选择的NSCLC 患者中的总表达率为3.4%,其中东方人NSCLC 患者为4.1%,而高加索人NSCLC 患者为2.5%。这些大规模非选择NSCLC 患者的系列研究提示东西方人种EML4-ALK 融合基因总发生率似乎相似。但某些研究中进行EML4-ALK 检测的NSCLC 患者是经过筛选的,如Shaw 等[7]研究中入组的患者必须满足以下至少2 个条件(女性、亚裔、不吸烟/少吸烟和腺癌),故在富含上述因子的NSCLC 人群中得出了EML4-ALK 的突变率为13.5%(19/141)。而Sun 等[11]通过筛选东亚不吸烟的肺腺癌患者作为研究对象后,得出EML4-ALK 的突变率5.8%(3/52)。似乎经过筛选的NSCLC 患者其EML4-ALK 突变率较不加选择的NSCLC 患者的突变率稍高(13.5%或5.8% vs 3.4%)。在本研究中同样限定实验对象必须满足以下至少一个条件(女性、不吸烟/少吸烟、腺癌),同时研究中所有患者均为亚裔,经检测后我们得出EML4-ALK 的突变率7.8%(8/102),我们的结果同样比不加选择的NSCLC 患者的总突变率稍高(7.8% vs 3. 4%),但低于Shaw 等的研究结果(7.8% vs 13.5%)。这可能与我们筛选实验对象的条件与Shaw 等的研究并非完全一致有关,亦可能不同种族(亚裔vs高加索人)之间EML4-ALK 的突变率存在差异。故EML4-ALK 融合基因突变率在不同地域和种族中是否存在差异?仍需要更多的研究来证实。
在Sasaki 等[8]的综述中显示,在各种突变类型中,最常见的类型为突变体1 型(E13-A20,V1),检出率高达33%。而在本文8 例EML4-ALK 阳性患者中,7 例为V1,1 例为V2,V1 亚型占所有阳性标本的87.5%(7/8),这与文献报道的结果相似。
之前有文献报道,EML4-ALK 阳性多见于年轻[7,12,16],不吸烟/少吸烟[7,10,12,16],腺癌[10,17-19]的非小细胞肺癌患者。我们通过比较EML4-ALK 阳性和阴性病人的临床及病理特征得出,阳性和阴性病人在年龄、性别)、吸烟史、病理类型及临床分期方面的差别均无统计学意义。分析原因可能是由于我们实验入组的研究对象是经过筛选的人群(其中女性、不吸烟/少吸烟、腺癌这3 个条件必须满足至少1 个),如表1 所示,使得入组的患者接近一半为女性(47.1%),且大多数偏向于不吸烟(71.6%)、腺癌(71.6%)的患者,这就造成我们入组人群的选择偏倚。故最后再分析阳性和阴性病人在性别、吸烟史及病理类型方面的差别时,就得到了差别无统计学意义。
但本研究8 例EML4-ALK 阳性患者的临床特征构成比显示(表1):8 例阳性患者中,有5 例患者的年龄低于总体患者的平均年龄(62.5%),3 例患者的年龄高于总体患者的平均年龄(37.5%),说明EML4-ALK 阳性更多见于年轻患者。虽然女性是我们选择入组的条件之一,但是从基线上看男女比例分别为52.9%和47.1%,基本平衡。但我们的结果提示在8 例阳性患者中,6 例为女性,2 例为男性(75% vs 25%),女性为男性的3 倍。故在男女入组比例基本平衡的情况下,EML4-ALK 阳性更多见于女性患者。由于亚裔女性的吸烟率较低,在本研究中女性患者的吸烟率仅为6.3%(3/48),且本研究中75%的EML4-ALK 阳性患者为女性,这一点也能解析为什么EML4-ALK 阳性更多见于不吸烟的人群。另外,我们发现8 例EML4-ALK 阳性患者中,5 例为腺癌,占62.5%(5/8),这与之前绝大多数研究结果显示EML4-ALK 阳性多见于腺癌患者相似[10,17-19]。另外2 例为腺鳞癌,亦含有腺癌的成分,说明EML4-ALK 阳性更多见于腺癌患者。
本文中8 例EML4-ALK 融合基因阳性患者的EGFR 和KRAS 突变状态均为野生型。这与之前的绝大多数报道相符[5,7,12,16,19],似乎说明了EML4-ALK、EGFR 和KRAS 这三者之间是相互排斥的。但是也存在特殊的病例,在Koivunen等[10]的报道中,在一个日本的腺癌病人身上同时发现了EML4-ALK 和EGFR 的突变;在中国NSCLC 人群中,Zhang等[13]也报道了在一个女性腺癌病人身上存在着EGFR 19 号外显子和EML4-ALK 的双重突变;Martelli 等[17]也在一个54岁的男性肺腺癌患者身上发现了EML4-ALK 和KRAS 的同时突变;目前认为以上共同突变属于罕见事件。故EGFR 和KRAS 野生型与EML4-ALK 突变是同一分子事件的必然结果,还是纯属不同分子事件的巧合呢?以上问题还需在更广泛的人群(包括不同种族、年龄、性别、病理类型和疾病的不同阶段)中检测除EML4-ALK 以外的更多分子指标,以发现和揭示这些不同分子事件的本质和彼此间的关联。同时有研究[20]发现肿瘤细胞内EGFR 的表达程度对肺癌细胞的生长、分化和转移均存在密切的影响,那么EML4-ALK 在肿瘤细胞中的表达程度是否对NSCLC 的发生、发展、转移存在影响?这也仍需进一步的研究证实。
EML4-ALK 融合基因已经代表了非小细胞肺癌的一种新的亚型,针对其的靶向药物的临床研究正在进行,所以我们应该坚信,在倡导肿瘤个体化治疗的今天,针对EML4-ALK 这一靶点的深入研究,将有助于对其优势人群的正确筛选并开创ALK 抑制剂的非小细胞肺癌靶向治疗新领域,同时将促使肺癌个体化治疗更加精准有效和逐步走向成熟。
[1] Molina JR,Yang P,Cassivi SD,et al. Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J]. Mayo Clin Proc,2008,83(5):584-594.
[2] Lynch TJ,Bell DW,Sordella R,et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med,2004,350(21):2129-2139.
[3] Paez JG,Janne PA,Lee JC,et al. EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J]. Science,2004,304(5676):1497-1500.
[4] Shigematsu H,Lin L,Takahashi T,et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J]. J Natl Cancer Inst,2005,97(5):339-346.
[5] Soda M,Choi YL,Enomoto M,et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J]. Nature,2007,448(7153):561-566.
[6] 杨衿记,张绪超,江本元,等. EML4-ALK 融合基因为靶点的晚期NSCLC 个体化治疗研究进展[J]. 癌症进展,2010,8(6):538-545.
[7] Shaw AT,Yeap BY,Mino-Kenudson M,et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK[J]. J Clin Oncol,2009,27(26):4247-4253.
[8] Sasaki T,Rodig SJ,Chirieac LR,et al. The biology and treatment of EML4-ALK non-small cell lung cancer[J].Eur J Cancer,2010,46(10):1773-1780.
[9] Soda M,Takada S,Takeuchi K,et al. A mouse model for EML4-ALK-positive lung cancer[J]. Proc Natl Acad Sci U S A,2008,105(50):19893-19897.
[10] Koivunen JP,Mermel C,Zejnullahu K,et al. EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer[J]. Clin Cancer Res,2008,14(13):4275-4283.
[11] Sun Y,Ren Y,Fang Z,et al. Lung adenocarcinoma from East Asian never-smokers is a disease largely defined by targetable oncogenic mutant kinases[J]. J Clin Oncol,2010,28(30):4616-4620.
[12] Wong DW,Leung EL,So KK,et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS[J]. Cancer,2009,115(8):1723-1733.
[13] Zhang X,Zhang S,Yang X,et al. Fusion of EML4 and ALK is associated with development of lung adenocarcinomas lacking EGFR and KRAS mutations and is correlated with ALK expression[J]. Mol Cancer,2010,9:188.
[14] Rikova K,Guo A,Zeng Q,et al. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer[J]. Cell,2007,131(6):1190-1203.
[15] Beasley MB,Brambilla E,Travis WD. The 2004 World Health Organization classification of lung tumors[J]. Semin Roentgenol,2005,40(2):90-97.
[16] Inamura K,Takeuchi K,Togashi Y,et al. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers[J]. J Thorac Oncol,2008,3(1):13-17.
[17] Martelli MP,Sozzi G,Hernandez L,et al. EML4-ALK rearrangement in non-small cell lung cancer and non-tumor lung tissues[J]. Am J Pathol,2009,174(2):661-670.
[18] Takeuchi K,Choi YL,Soda M,et al. Multiplex reverse transcription-PCR screening for EML4-ALK fusion transcripts[J]. Clin Cancer Res,2008,14(20):6618-6624.
[19] Shinmura K,Kageyama S,Tao H,et al. EML4-ALK fusion transcripts,but no NPM-,TPM3-,CLTC-,ATIC-,or TFG-ALK ffusion transcripts,in non-small cell lung carcinomas[J]. Lung Cancer,2008,61(2):163-169.
[20] 钟雪云,肖柳珍,廖剑辉,等.上皮生长因子受体与非小细胞肺癌肿瘤免疫及转移的相关关系[J]. 中国病理生理杂志,1999,15(6):506-508.
