Rock2 对细胞周期检查点Cdc25A 的调节作用*
2012-12-23刘天德袁荣发王庆诺杨志强邵江华
刘天德, 余 新, 袁荣发, 王庆诺, 杨志强, 邵江华,2△
(1南昌大学第二附属医院肝胆外科,2江西省分子医学重点实验室,江西 南昌330006)
Rho 相关含卷曲螺旋蛋白激酶(Rho-associated coiled-coil-containing protein kinase,Rock)是新近发现的Rho/Rock 信号转导通路的关键信号分子,包括Rock1 和Rock2 亚单位[1],其具有调节细胞的多种行为和功能,并与肿瘤恶性程度、肿瘤发生、转移以及细胞的黏附、收缩、迁移和胞浆的分裂有关[2-3]。研究表明,Rock2 在肝癌等恶性肿瘤中表达水平异常增高[4]。我们的前期研究表明,降低肝癌细胞中Rock2 蛋白表达可以抑制肝癌细胞的增殖,并使细胞周期阻滞在G1/S 期。细胞分裂周期蛋白25A(cell division cycle 25A,Cdc25A)是控制G1/S期调节途径的重要检查点蛋白,在转导级联激活作用中是一个重要的效应分子[5]。也有研究表明,Cdc25A 在肝癌组织中呈现高表达[6]。但Rock2 与Cdc25A 蛋白之间是否存在关联,目前尚不清楚,本研究拟探讨Rock2 对Cdc25A 蛋白的调节作用。
材 料 和 方 法
1 材料
DMEM 培养基(Gibco),胎牛血清(HyClone),脂质体LipofectamineTM2000(Invitrogen),羊抗多克隆Rock2Ⅰ抗(Santa Cruz),兔抗多克隆Cdc25A Ⅰ抗(Santa Cruz),兔抗多克隆检查点激酶(checkpoint kinase,Chk)1Ⅰ抗(Santa Cruz),兔抗多克隆Chk2Ⅰ抗(Santa Cruz),Protein A/G PLUS-Agarose(Santa Cruz)。DNA 切胶回收试剂盒、质粒大量提取及小量提取试剂盒(北京天根公司)。设计的Rock2 干扰序列及相关引物由上海生工合成。pcDNA5-FRT-6×his-Rock2 质粒及pCMV-N-HA-Cdc25A 质粒已于前期构建,人肝细胞性肝癌细胞株Huh-7 和HepG2 由本实验室保存。
2 标本
收集南昌大学第二附属医院肝胆外科2009 年1月~2010 年7 月肝癌及癌旁组织标本,共计51 例,收集后立即液氮保存。经病理切片证实均为原发性肝癌标本。
3 细胞株的培养及转染
Huh-7 和HepG2 细胞株接种于含10%胎牛血清的DMEM 培养基,37 ℃、5%CO2条件下培养。按脂质体LipofectamineTM2000 转染试剂说明进行转染,于转染6 h 后更换为含10%胎牛血清的DMEM 培养基。
4 MTT 法检测肝癌细胞的增殖
在离心管内将各组细胞悬液充分打匀,按8 ×103cells/well 接种于96 孔培养板,每孔加液量200 μL,24 h 后换液,每组设6 个复孔。于转染后1 ~4 d每孔加入5 g/L MTT 试剂20 μL,于37 ℃、5%CO2条件下继续孵育4 h。吸取各孔上清,加入DMSO 150 μL/well,室温下置水平摇床摇10 min 以充分溶解MTT 结晶。在酶联免疫测定仪上选择波长490 nm,空白孔调零,测定各孔吸光度(A)值。每组重复3 次。细胞增长率(%)=(实验组平均A490/对照组平均A490)×100%。
5 shRock2 干扰质粒的构建及筛选
根据NCBI 上查到的人Rock2 mRNA 序列(NM_004850.3),设计4 对寡聚单链DNA,连接到pcDNATM6.2-GW/EmGFPmiR 载体中,测序验证,见表1。将4 个shRock2 质粒分别转染入肝癌细胞Huh-7 中,48 h 后提取总蛋白,Western blotting 分析Rock2 蛋白的表达,筛选出干扰效果最佳的shRock2质粒。

表1 miRNA 寡聚单链DNA 序列Table 1. Oligomeric single-stranded DNA sequences
6 筛选Rock2 稳定低表达的肝癌细胞株
将上述筛选出的最佳shRock2 干扰质粒利用脂质体LipofectamineTM2000 转染到肝癌细胞Huh-7和HepG2 中,转染48 h 后加入杀稻瘟素(blasticidin)筛选,浓度为10 mg/L。48 h 后加入5 mg/L 杀稻瘟素继续培养3 周,Western blotting 检测Rock2 蛋白的变化,筛选出Rock2 稳定低表达的肝癌细胞株。
7 检测Rock2 稳定低表达肝癌细胞中Cdc25A、Chk1 和Chk2 蛋白的变化
提取各组肝癌细胞的总蛋白,BCA 法测定蛋白浓度,取等量50 μg 蛋白质样品煮沸5 min 后行10%SDS-PAGE 电泳,湿转,然后分别结合对应Cdc25A、Chk1、Chk2Ⅰ抗及辣根过氧化物酶标记的Ⅱ抗,应用ECL 发光试剂显示蛋白质条带,暗室曝光。每组实验共平行进行3 次。
8 Rock2 突变质粒的构建及转染
为消除RNA 干扰技术中的脱靶效应,我们针对Rock2 干扰序列进行了碱基定点突变,见表2。以pcDNA5-FRT-6 × his-Rock2 质粒为模板,构建Rock2 突变质粒(经测序验证)以此“恢复”Rock2 蛋白的表达,Western blotting 检测Rock2 和Cdc25A 蛋白的变化及MTT 法观察肝癌细胞增殖的变化。

表2 Rock2 定点突变引物Table 2. Site-directed mutagenesis primers of Rock2
9 免疫共沉淀
去除细胞培养液,用冷PBS 洗1 次。加RIPA 裂解液,溶解后,转移到EP 管中用振荡混匀,离心,上清转移到新的EP 管。往上清分别加入6 ×his 抗体和HA 抗体,4 ℃旋转混匀过夜,加入Protein A/G PLUS-Agarose,再混匀1 h 后使琼脂糖(agarose)沉淀,去上清。往琼脂糖加RIPA,振荡混匀、离心、去上清。重复4 次洗净。加3% SDS 缓冲液20 μL,-20 ℃保存备用。Western blotting 检测Rock2 与Cdc25A 相互作用情况。
10 荧光共定位
细胞培养后进行爬片,4%多聚甲醛固定,0.5%triton 穿孔,10% 正常驴血清封闭非特异性结合位点,分别以羊抗Rock2 抗体、兔抗Cdc25A 抗体和羊抗Rock2 抗体+兔抗Cdc25A 抗体孵育过夜,PBS 冲洗,以上各组分别用FITC 标记的驴抗羊IgG 、TRITC标记的驴抗兔IgG 孵育1 h,PBS 冲洗,DAPI (0.1 mg/L)避光孵育30 min,PBS 冲洗后共聚焦显微镜观察并照相。
11 统计学处理
结 果
1 Rock2 与Cdc25A 蛋白在肝癌组织中高表达且两者呈正相关
通过检测51 对肝癌及癌旁组织中Rock2 与Cdc25A 的蛋白表达,发现Rock2 与Cdc25A 在肝癌组织较癌旁组织呈现高表达,而且两者呈正相关。其中,37 例肝癌组织中两者呈现过表达(72.5%),4例肝癌组织中两者未见表达(7.8%),单纯Rock2 或Cdc25A 蛋白表达过高的有10 例(19.6%),见图1。
2 最佳shRock2 干扰质粒的筛选
将已构建的4 个shRock2 干扰质粒分别转染到肝癌细胞Huh-7 中,Western blotting 检测发现,Rock2 表达较对照组均降低,但shRock2-1 质粒效果更明显,后续实验将用该干扰质粒进行,见图2。
3 Rock2 稳定低表达细胞中Cdc25A 蛋白表达降低
Western blotting 检测发现,Rock2 表达降低后Cdc25A 蛋白的表达也随之减少(P <0.05),表明降低Rock2 的表达后对Cdc25A 可能起调节作用,见图3。
4 转染Rock2 突变质粒的特异性验证
将已构建的针对Rock2 干扰序列的Rock2 突变质粒转染到Rock2 稳定低表达的肝癌细胞株中,Western blotting 检测发现,Rock2 与Cdc25A 的蛋白表达均“恢复”,而且肝癌细胞的增殖也明显增加,见图4。

Figure 1. The expression of Rock2 and Cdc25A in human hepatocellular carcinoma tissues (tumor,T)and adjacent liver tissues (nontumor,NT). A:representative Western blotting graphs;B,C:statistical analysis of Rock2 and Cdc25A expression,respectively;D:the relationship between Rock2 and Cdc25A expression. ±s.n=51. * P <0.05 vs T.图1 Rock2 与Cdc25A 在肝癌组织及癌旁组织中的表达
5 降低Rock2 表达后Chk1 和Chk2 蛋白表达无明显变化
Chk1 和Chk2 是Cdc25A 上游最主要的调节因子[7]。在Rock2 稳定低表达的肝癌细胞中,Western blotting 检测表明Chk1 和Chk2 蛋白的表达无明显变化,这表明Rock2 对Cdc25A 的调节并不依赖于Chk1/Chk2,见图5。
6 Rock2 与Cdc25A 直接相互作用
Rock2 和Cdc25A 发生了免疫共沉淀作用,表明Rock2 直接作用于Cdc25A,见图6。
7 Rock2 与Cdc25A 存在共定位
两个蛋白之间的共定位通常发生在当荧光标记分子位置非常接近或者存在空间一致性时。激光共聚焦显微镜观察结果表明,Rock2 与Cdc25A 之间存在共定位,见图7。
讨 论
原发性肝细胞癌(hepatocellular carcinoma,HCC)是我国乃至世界上常见、且极具危害性的恶性肿瘤之一[8]。尽管近年来对其诊断、治疗技术不断进步,但肝癌的预后仍然较差。肝癌确切的发病机制尚未完全明了,肝癌的发生发展是癌基因的激活和抑癌基因的失活共同作用的结果[9]。因此,了解肝细胞癌变过程、原癌基因和肿瘤抑制基因具有重要意义。Rock2 是Rho/Rock 信号转导通路的关键信号分子,近年研究发现,Rock2 在肝癌,膀胱癌,乳腺癌,睾丸癌等多种恶性肿瘤中呈现过高表达,而且在恶性肿瘤中其下游作用通路仍不十分清楚。遗传信息的准确传导对于细胞生存和癌症预防是至关重要的。

Figure 2. The expression of Rock2 protein was decreased after transfection of shRock2 plasmids and the best shRock2 plasmid was selected. ±s.n=6. * P <0.05,**P <0.01 vs mock.图2 转染shRock2 干扰质粒后其蛋白变化明显降低并筛选出shRock2 最佳干扰片段shRock2-1

Figure 3. The expression of Cdc25A protein was decreased in stable Rock2-knockdown Huh-7 and HepG2 cells. ±s.n=6. **P <0.01 vs mock.图3 在Rock2 稳定低表达的肝癌细胞Huh-7 和HepG2 中Cdc25A 蛋白表达明显降低

Figure 4. The specificity verification after transfection of Rock2-mutant plasmid.A:the wild-type and mutant Rock2 plasmids(bold letters indicate the silent mutations in the Rock2-mutant plasmid);B:the expression of Rock2 and Cdc25A after transfection with the Rock2-mutant plasmid(Rock2m)into shRock2-treated cells;C:the cell growth after transfection with Rock2m into shRock2-treated cells. ±s.n=3. * P <0.05,**P <0.01 vs shRock2.图4 转染Rock2 突变质粒的特异性验证

Figure 5. The expression of Chk1 and Chk2 proteins was not changed in stable Rock2-knockdown Huh-7 and HepG2 cells.图5 在Rock2 稳定低表达的肝癌细胞Huh-7 和HepG2 中Chk1 和Chk2 的蛋白表达无明显变化

Figure 6. Rock2 directly bound to Cdc25A. A:co-immunoprecipitation between 6 ×His-Rock2 and HA-Cdc25A in Huh-7 cells. HA-Cdc25A was detected in the immunoprecipitate when the anti-6 ×his antibody was used as the bait;6 ×his-Rock2 was detected in the immunoprecipitate when the anti-HA antibody was used as the bait. B:the endogenous Rock2 and Cdc25A directly bound to each other.图6 Rock2 与Cdc25A 之间存在直接结合
G1/S 期检查点能够通过抑制DNA 复制的开始而阻止细胞进入S 期。细胞能否开始进行增殖,主要调控点在G1期,它决定了细胞能否通过G1期而进入S 期。Cdc25A 是控制G1/S 期调节途径的重要检查点蛋白,在转导级联激活作用中是一个重要的效应分子[4]。在人细胞中,Cdc25A 过表达会引起Cdk2/cyclin E 依赖激酶的早期激活,导致细胞过早进入S 期,细胞生长的失控,及可能引起恶性转化[5]。相反,Cdc25A 表达的降低可以抑制Cdk2/cyclin E 的活性并阻止Cdc45 直接作用DNA 复制的起始[10-11]。Cdc25A 与一个复杂的调节系统相互作用,通过泛素蛋白酶体途径的降解对于分裂细胞和应对DNA 损伤方面都是一个主要的控制途径[12]。DNA 损伤时Cdc25A 的降解对于细胞周期阻滞是非常关键的。当细胞中不能降低Cdc25A 表达时会表现出检查点阻滞功能的障碍,包括抗辐射的DNA 合成及Cdk2活性的升高。研究发现,Cdc25A在肝癌等多种恶性肿瘤中呈现高表达,而且Cdc25A 过高表达与侵袭及预后不良是密切相关的[5]。我们的前期研究发现,降低肝癌细胞中Rock2基因的表达,可以抑制肝癌细胞的增殖并使细胞周期阻滞于G1/S 期。Rock2 作为一个中介因子,了解其是否对Cdc25A 具有调节作用,对于全面分析Rock2 在S 期检查点机制中的调节通路十分重要。
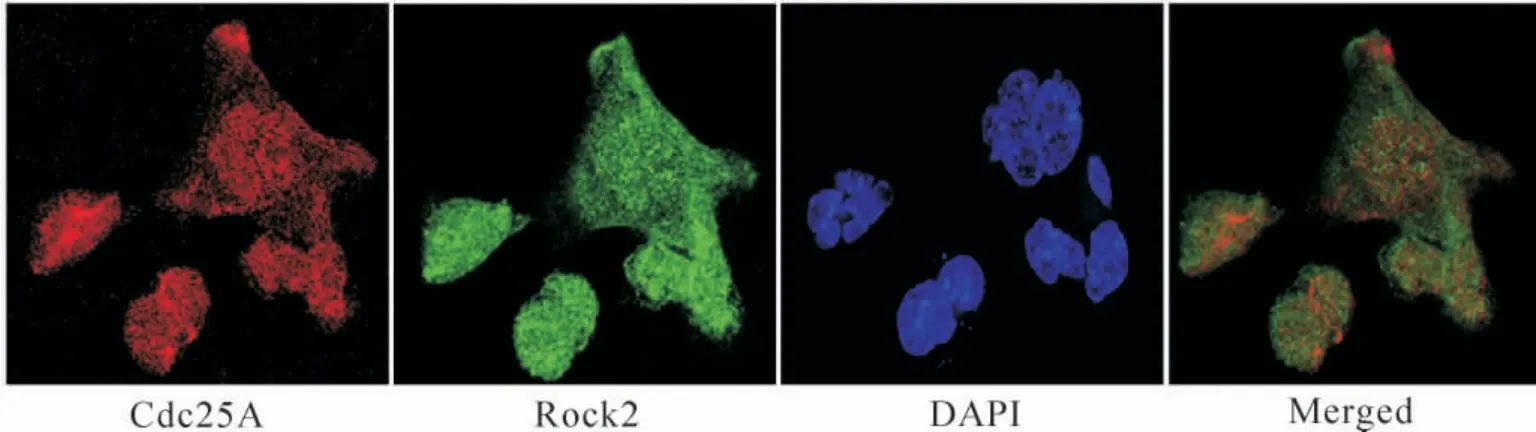
Figure 7. The co-localization of Rock2 and Cdc25A observed by confocal microscopy.图7 共聚焦显微镜显示Rock2 与Cdc25A 之间存在共定位
鉴于Rock2 与Cdc25A 蛋白在肝癌组织中呈现高表达,本研究通过收集51 例肝癌及癌旁组织标本,检测发现Rock2 与Cdc25A 在肝癌组织中高表达而且两者呈正相关。这表明Rock2 与Cdc25A 在肝癌的发生发展中可能存在密切联系。鉴于Cdc25A是细胞周期G1/S 期的重要调节点,我们推测Rock2可能对Cdc25A 起调控作用。我们通过构建Rock2稳定低表达的肝癌细胞株Huh-7 和HepG2,检测发现Cdc25A 蛋白的表达也随之下降。进而,通过定点突变技术构建了Rock2 突变质粒“恢复”其表达,发现Cdc25A 蛋白明显增加,肝癌细胞的增殖显著增强。这表明利用RNA 干扰技术,Rock2 对Cdc25A调控作用存在特异性,消除了RNA 干扰的“脱靶效应”,证实Rock2 是通过调节Cdc25A 而发挥其下游的信号转导作用。这可能为肝癌的发病机制提供一定的理论基础。Chk1 和Chk2 在调控细胞周期与肿瘤的发生中起重要作用[13],而且两者是Cdc25A 上游最重要的直接调控检查点蛋白[7]。鉴于它们的重要性,起初我们认为Rock2 通过影响Chk1 和Chk2蛋白的变化而对Cdc25A 起调节作用,但在Rock2 稳定低表达的细胞中并没有发现Chk1 和Chk2 蛋白表达的变化。这些结果表明,Rock2 调节Cdc25A 不依赖于Chk1/Chk2,这可能是一条新的调节通路。既然Rock2 调节Cdc25A 不依赖于Chk1/Chk2,我们设想Rock2 与Cdc25A 之间是否存在直接的相互作用。免疫共沉淀实验表明,Rock2 与Cdc25A 蛋白之间具有相互作用。这表明,Rock2 通过直接调节Cdc25A而发挥作用。通过共聚焦显微镜,更加直观的免疫荧光实验表明,Rock2 与Cdc25A 蛋白在位置上存在重叠及共定位。
Rock2 通过不依赖于Chk1/Chk2 的方式直接调节Cdc25A,这为Rock2 在肝癌中的调节机制研究提供重要线索,将为我们更加深入了解Rock2 在人肝细胞癌的发病机制及预后方面提供了广阔的思路。
[1] Matsui T,Amano M,Yamamoto T,et al. Rho-associated kinase,a novel serine/threonine kinase,as a putative target for small GTP binding protein Rho[J]. EMBO J,1996,15(9):2208-2216.
[2] Riento K,Ridley AJ. Rocks:multifunctional kinases in cell behaviour[J]. Nat Rev Mol Cell Biol,2003,4(6):446-456.
[3] Shi J,Wei L. Rho kinase in the regulation of cell death and survival[J]. Arch Immunol Ther Exp (Warsz),2007,55(2):61-75.
[4] Wong CC,Wong CM,Tung EK,et al. Rho-kinase 2 is frequently overexpressed in hepatocellular carcinoma and involved in tumor invasion [J]. Hepatology,2009,49(5):1583-1594.
[5] Mailand N,Falck J,Lukas C,et al. Rapid destruction of human Cdc25A in response to DNA damage[J]. Science,2000,288(5470):1425-1429.
[6] Xu X,Yamamoto H,Sakon M,et al. Overexpression of CDC25A phosphatase is associated with hypergrowth activity and poor prognosis of human hepatocellular carcinomas[J]. Clin Cancer Res,2003,9(5):1764-1772.
[7] Palou G,Palou R,Guerra-Moreno A,et al. Cyclin regulation by the S phase checkpoint[J]. J Biol Chem,2010,285(34):26431-26440.
[8] Llovet JM,Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008[J]. J Hepatol,2008,48(Suppl 1):S20-S37.
[9] 张继红,梁力建,黄洁夫.Quercetin 调节肝癌HepG2 细胞Fas 表达诱导细胞凋亡[J]. 中国病理生理杂志,2008,24(5):997-1001.
[10] Neganova I,Vilella F,Atkinson SP,et al. An Important role for CDK2 in G1to S checkpoint activation and DNA damage response in human embryonic stem cells[J].Stem Cells,2011,29(4):651-659.
[11] Broderick R,Nasheuer HP. Regulation of Cdc45 in the cell cycle and after DNA damage[J]. Biochem Soc Trans,2009,37(4):926-930.
[12] Pereg Y,Liu BY,O'Rourke KM,et al. Ubiquitin hydrolase Dub3 promotes oncogenic transformation by stabilizing Cdc25A[J]. Nat Cell Biol,2010,12(4):400-406.
[13] 张 敏,王海艳,游 泳,等. CHK1 shRNA 抑制HeLa细胞增殖并诱导其凋亡[J]. 中国病理生理杂志,2008,24(10):1891-1894.
