Trx-ASK1 在多柔比星诱导的乳鼠心肌细胞凋亡中的作用
2012-12-23黄海高李悦山
黄海高, 李悦山
(广州医学院药理教研室,广东 广州510182)
硫氧还蛋白(thioredoxin,Trx)是广泛存在于生物体内的一种多功能小分子蛋白,因其具有重要的抗氧化和抗凋亡作用[1]而备受研究者重视。研究发现Trx 的抗凋亡作用主要通过抑制凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1),进而抑制了ASK1 所介导的凋亡下游信号通路[2]。
多柔比星(doxorubicin,DOX)是一种蒽环类抗生素,临床上广泛应用于各种肿瘤的治疗[3],但是其应用过程中会出现很强的心脏毒性[4],进而导致各种心肌病与心力衰竭的发生[5-6]。研究表明DOX 的心脏毒性与心肌细胞的凋亡密切相关,但是目前有关凋亡的具体机制仍然不是十分明确。DOX 体外诱导心肌细胞凋亡过程中Trx-ASK1 是否会发生分离以及ASK1 是否会被活化进而启动凋亡下游信号通路,目前未见相关报道。
材 料 和 方 法
1 材料
1.1 主要试剂 DOX、ebselen 和细胞级二甲基亚砜(dimethyl sulfoxide,DMSO)购于Sigma。高糖DMEM培养基、胎牛血清和胰蛋白酶购自Gibco。MTT、细胞增殖及细胞毒性检测试剂盒、caspase-3 分光光度法检测试剂盒和细胞凋亡荧光Hoechst 33258 试剂盒购于南京凯基生物。荧光探针荧光素2',7'-二氯二氢荧光素二乙酯(2',7'-dichlorodihydrofluorescin diacetate,H2DCFDA)购于Molecular Probes。免疫沉淀试剂盒、BCA 蛋白测定试剂盒和发光液购自Pierce。兔Trx 多克隆抗体购于Millipore;山羊ASK1多克隆抗体购于Santa Cruz;聚ADP 核糖聚合酶1[poly(ADP-ribose)polymerase 1,PARP 1]、磷酸化ASK1(p-ASK1)、p38 有丝分裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38)和磷酸化p38(p-p38)抗体购于Cell Signaling Technology。1.2 动物 SPF 级Sprague-Dawley 新生大鼠(1 ~3 d),雌雄不限,由广州中医药大学动物中心提供。
2 方法
2.1 心肌细胞培养 乳鼠心肌细胞原代培养参照Simpson 等[7]的方法改进而得。取新生24 ~72 h 的SD 乳鼠消毒后,在超净台无菌操作下快速打开乳鼠胸腔暴露心脏,取左室心肌组织立即浸入冰冷的D-Hanks 液中,重复,直到剪完所有乳鼠,用D-Hanks 液冲洗,剪成(0.5 ~1)mm ×1 mm ×1 mm 大小的组织块,再冲洗数次;将心肌组织碎块转移至无菌锥形瓶,加消化液(0.125%胰蛋白酶液)6 ~8 mL,37 ℃恒温磁力搅拌50 r/min。用0.125%胰蛋白酶消化8 次左右,每次6 ~8 min,吸管轻轻吸取上清,移入冷的离心管中,收集除前2 次以外的消化液,(每次消化后,用吸管吹打30 s,静置约2 min)用适量含血清的冰培养基终止消化,1 000 r/min 离心10 min,弃上清,收集所有沉淀加入含15% FBS 的DMEM 培养基重悬细胞,将细胞悬液培养于培养皿中,置37℃、5% CO2水套式培养箱中培养2 h。因内皮细胞和成纤维细胞较心肌细胞容易贴壁生长,2 h 后培养液中悬浮的细胞95%是心肌细胞。小心吸出细胞悬浮液计数,根据需要稀释到一定密度(5 ×105~1 ×106),接种于培养皿或孔板中。24 h 后换液,换为无血清加胰岛素(10 mg/L)、转铁蛋白(10 mg/L)、维生 素B12(1.5 μmol/L)和BrdU (0.1 mmol/L)的DMEM 培养基。第3 d 换液,换用不含BrdU 的上述无血清培养基。如果可见细胞搏动率大于95%,即可进行以下实验。
2.2 心肌细胞活力测定 参照南京凯基生物的MTT 细胞增殖及细胞毒性检测试剂盒说明书,通过酶标仪检测吸光度值,考察心肌细胞的活力。
2.3 细胞浆caspase-3 活性的测定 参照凯基生物的caspase-3 分光光度法检测试剂盒说明书,通过酶标仪检测吸光度值,考察caspase-3 的活化程度。
2.4 心肌细胞凋亡荧光显微镜观察 参照南京凯基生物的细胞凋亡荧光Hoechst 33258 试剂盒说明书,正常细胞显淡蓝色,凋亡细胞细胞核浓缩,显亮蓝色。
2.5 DOX 诱导心肌细胞内活性氧簇(reactive oxygen species,ROS)的产生 预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,用ROS 敏感的荧光探针H2DCFDA 标记细胞,荧光显微镜下检测细胞内H2DCFDA 荧光强度变化,以荧光强度反映细胞内ROS 含量的变化。
2.6 免疫沉淀试剂盒检测Trx-ASK1 的分离 用多克隆ASK1 抗体和免疫沉淀(immunoprecipitation,IP)方法获取细胞中的总ASK1。具体方法参照Pierce 公司的IP 试剂盒说明书。Trx-ASK1 的分离使用抗Trx 多克隆抗体检测。
2.7 Western blotting 检测cleaved PARP1、p-ASK1(Ser967)、p38 和p-p38 蛋白水平 提取细胞总蛋白后,BCA 法测定蛋白浓度。电泳,转膜,脱脂奶粉封闭,孵育Ⅰ抗(1 ∶1 000)4 ℃过夜,或β-actin(1∶1 000)室温孵育2 h,Ⅱ抗(1∶1 000)室温孵育2 h,曝光。结果用图像分析系统进行分析。
3 统计学处理
用SPSS 16.0 统计软件进行分析。数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD 法)。以P <0.05 为差异有统计学意义。
结 果
1 不同浓度DOX 作用后细胞活力检测
待心肌细胞搏动率大于95%,换用不含Brdu 的上述无血清培养基,分别给予0、0.1、0.5、1 和5 μmol/L DOX。24 h 后,检测细胞活力。1 μmol/L 与5 μmol/L DOX 组MTT 值下降,与对照组MTT 值比较均有显著差异(P <0.01),见图1A。

Figure 1. Effects of doxorubicin (DOX)on vability (A,n =6)and apoptosis[caspase-3 activation (B,n =4)and PARP1 cleavage (C,n=3)]of cardiomyocytes. ±s. △△P <0.01 vs 0 μmol/L.图1 不同浓度DOX 对心肌细胞活力和凋亡的影响
2 不同浓度DOX 作用后细胞浆caspase-3 活性的测定
心肌细胞分别给予0、0.1、0.5、1 和5 μmol/L DOX,24 h 后检测胞浆caspase-3 活性。与对照组相比,1 μmol/L DOX 组caspase-3 活 化度为(151.23 ±10.41)% (P <0.01),5 μmol/L DOX 组caspase-3 活 化 度 为(161.03 ± 12.21)% (P <0.01),见图1B。
3 不同浓度DOX 作用后细胞cleaved PARP1 的检测
心肌细胞分别给予0、0.1、0.5、1 和5 μmol/L DOX,24 h 后检测cleaved PARP1 的表达。与对照组相比,1 μmol/L 和5 μmol/L DOX 组cleaved PARP1表达明显增加(P <0.01),见图1C。
4 预孵育ebselen 后细胞活力检测
待心肌细胞搏动率大于95%,换用不含BrdU 的上述无血清培养基,预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,检测细胞活力。1 μmol/L DOX 组MTT 值下降,与对照组MTT 值比较有显著差异(P <0.01);ebselen 可以显著抑制DOX对细胞的损伤,与DOX 组MTT 值比较有显著差异(P <0.05),见图2A。
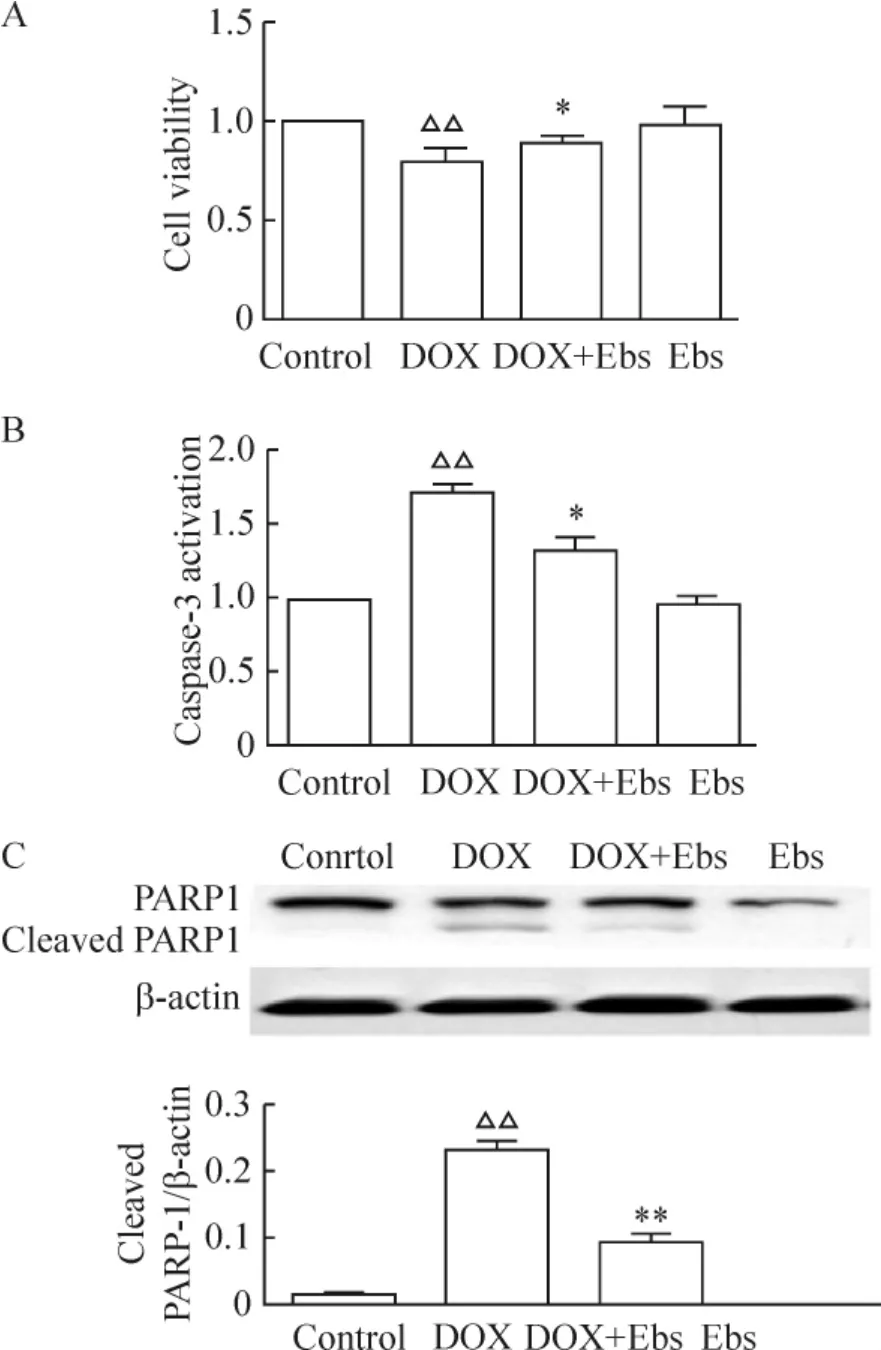
Figure 2. Ebselen (Ebs)reduced DOX-induced cardiomyocyte apoptosis. ±s. A:n =6;B:n =4;C:n =3. △△P <0.01 vs control;* P <0.05,**P <0.01 vs DOX.图2 Ebselen 抑制多柔比星诱导的心肌细胞凋亡
5 预孵育ebselen 后细胞浆caspase-3 活性的测定
预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,检测胞浆caspase-3 活性。与对照组相比,1 μmol/L DOX 组caspase-3 活化度为(171.04 ±10.41)% (P <0.01);与DOX 组相比,ebselen 可以显著抑制caspase-3 的活化[(125.04 ±6.41)%](P <0.05),见图2B。
6 预孵育ebselen 后细胞cleaved PARP1 的检测
预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,检测cleaved PARP1 的表达。与对照组相比,1 μmol/L DOX 组cleaved PARP1 表达明显增加(P <0.01);与DOX 组相比,ebselen 组cleaved PARP-1 表达明显减少(P <0.01),见图2C。
7 DOX 和(或)ebselen 对心肌细胞内ROS 产生的影响
预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,加入荧光探针H2DCFDA 孵育30 min清洗后观察,DOX 组比对照组细胞内单位面积荧光强度显著增强,证实有ROS 的产生,给予ebselen 后,ROS 量减少,见图3。

Figure 3. Ebselen (50 μmol/L for 24 h)inhibited DOX(1 μmol/L)- induced ROS production in cardiomyocytes. A:control;B:DOX;C:DOX+ebselen;D:ebselen..图3 Ebselen 抑制DOX 诱导的心肌细胞内ROS 的产生
8 细胞凋亡荧光显微镜观察
预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,Hoechst 33258 荧光染色。对照组细胞呈淡蓝色,1 μmol/L DOX 组细胞呈亮蓝色,有明显的核固缩,具有凋亡的显著特征,与DOX 组相比,ebselen 组凋亡有所改善,见图4。
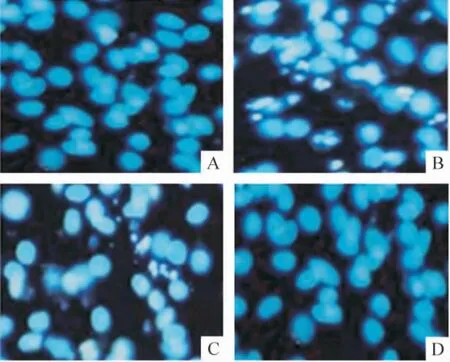
Figure 4. Ebselen (50 μmol/L for 24 h)inhibited DOX(1 μmol/L)-induced apoptosis of cardiomyocytes (Hoechst 33258 staining,×400). A:control;B:DOX;C:DOX+ebselen;D:ebselen.图4 Ebselen 抑制DOX 诱导的心肌细胞凋亡的形态学观察
9 免疫沉淀检测Trx-ASK1 的分离
预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,检测Trx-ASK1 的分离,与对照组相比,1 μmol/L DOX 组Trx-ASK1 的分离显著增加(P<0.01),与DOX 组相比,ebselen 组Trx-ASK1 分离减少(P <0.01),充分说明DOX 作用心肌细胞后,Trx-ASK1 发生了分离(P <0.01),给予ebselen 后,分离有所减少(P <0.01),见图5。

Figure 5. Effect of ebselen (50 μmol/L for 24 h)on DOX(1 μmol/L)-induced Trx-ASK1 dissociation in cardiomyocytes measured by immunoprecipitation. ± s. n=3. ##P <0.01 vs control;△△P <0.01 vs DOX.图5 免疫沉淀法检测ebselen 对DOX 诱导的心肌细胞Trx-ASK1 分离的影响
10 p-ASK1(Ser967)、p38 和p-p38 蛋白表达检测
预孵育50 μmol/L ebselen 2 h,给予1 μmol/L DOX。24 h 后,检测p-ASK1(Ser967)的表达,与对照组相比,1 μmol/L DOX 组p-ASK1(Ser967)表达显著减少(P <0.01),与DOX 组相比,ebselen 组p-ASK1(Ser967)表达显著增加(P <0.01),见图6;同样预孵育50 μmol/L ebselen 2 h,DOX 处理后15 min检测p38 和p-p38 的表达,与对照组相比,1 μmol/L DOX 组p-p38 显著增加(P <0.01),与DOX 组相比,ebselen 组p-p38 显著增加(P <0.01);各组之间p38 的表达无显著差异,见图7。说明DOX 作用心肌细胞后,ASK1 和p38 均被激活。
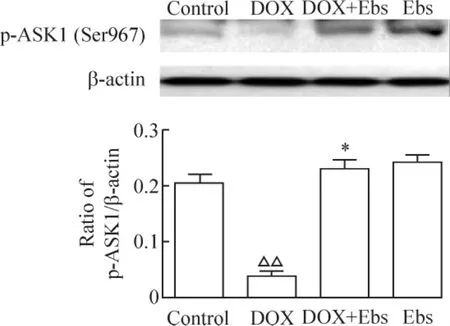
Figure 6. Effect of ebselen (50 μmol/L for 24 h)on DOX(1 μmol/L)-induced expression of p-ASK1 in cardiomyocytes. ±s. n=3. △△P <0.01 vs control;* P <0.05 vs DOX.图6 Ebselen 对DOX 作用的乳鼠心肌细胞p-ASK1 表达的影响

Figure 7. Effect of ebselen (50 μmol/L for 24 h)on DOX(1 μmol/L)-induced expression of p38 and p-p38 in cardiomyocytes. ± s. n =3. ##P <0.01 vs control;△△P <0.01 vs DOX.图7 Ebselen 对DOX 作用的乳鼠心肌细胞p38 和p-p38表达的影响
讨 论
本实验应用DOX 体外诱导乳鼠心肌细胞凋亡,首次证明了在此凋亡过程中Trx 和ASK1 发生了一定程度的分离,进而启动了ASK1 介导的凋亡信号通路,这可能成为DOX 诱导心肌细胞凋亡的机制之一。
DOX 是一种临床上广泛应用于抗肿瘤的药物,但由于具有很强的心脏毒性,应用受到了很大的限制。研究发现,心肌细胞的凋亡是DOX 心脏毒性最为直接的表现形式之一[8]。关于DOX 导致的心肌细胞凋亡的具体机制目前研究并不是十分充分。
众多研究表明,DOX 作用心肌细胞后,细胞内会产生较多的ROS,进而认为ROS 在细胞凋亡过程中起到了重要的作用[9-10]。文献报道DOX 诱导心肌细胞凋亡时1 μmol/L 的浓度被认为是与临床应用最为相关的浓度。因此本实验选取了DOX 0.1、0.5、1 和5 μmol/L 浓度观察DOX 对心肌细胞存活率的影响(MTT 检测),及对caspase-3 和PARP1 活化的影响。基于大量实验研究报道DOX 诱导细胞凋亡过程中细胞内ROS 含量会增加,我们选取了抗氧化剂ebselen 作为保护剂。实验证实DOX 作用于心肌细胞可以发生明显的凋亡,并且细胞内的ROS量显著增加,caspase-3 活化,PARP1 蛋白发生活化,给予抗氧化剂ebselen 后得到了显著改善。
硫氧还蛋白(thioredoxin,Trx)是几乎存在于所有原核和真核生物内的一种多功能小分子蛋白,同时也是细胞内重要的二硫键还原酶,对维持细胞内蛋白质的还原状态并正常发挥功能起着非常重要的作用。生物体内的Trx 系统包括Trx、Trx 还原酶(TrxR)、还原型辅酶II(NADPH)和Trx 过氧化物酶(TrxP)。这是一个控制细胞还原/氧化状态和细胞增殖/生存的广泛表达的氧化还原酶系统。Trx-1除了具有抗氧化作用外,还具有抗凋亡作用[1-2]。其抗凋亡作用与细胞内的ASK1 密切相关。ASK1 是一种有丝分裂原激活蛋白激酶激酶激酶家族(MAPKKK)中的一员,在凋亡信号中发挥着重要作用。ASK1 活化可以激活有丝分裂原活化蛋白激酶激酶(MAPKK)家族中的MAPKK4、MAPKK7 和MAPKK3、MAPKK6,进而活化有丝分裂原活化蛋白激酶(MAPK)家族中c-Jun 氨基端激酶(JNK)和p38(p38 MAPK)这两个促凋亡蛋白激酶。促凋亡蛋白激酶p38 与JNK 的活化会通过caspase 依赖途径激活caspase-3,进而激活PARP1 蛋白,PARP1 活化则失去重要的DNA 修复功能,最终导致细胞凋亡。还原型Trx-1 主要是通过Cys-32、35 的巯基与ASK1的N 端连接,从而抑制了ASK1 介导的细胞凋亡[2]。前面实验我们已经证实给予1 μmol/L DOX 后细胞内ROS 含量显著增加,由此我们推测在这一过程中Trx 发生了氧化,与ASK1 发生了分离。为了证实我们的假设,我们采用免疫沉淀法分别检测了正常组、DOX 组、ebselen + DOX 组和单纯ebselen 组细胞内Trx-ASK1 是否发生分离,结果发现与正常组细胞比较,DOX 组细胞内Trx-ASK1 发生了显著的分离(P <0.01),较DOX 组,ebselen +DOX 组细胞内Trx-ASK1 分离减少(P <0.01)。免疫沉淀证实了给予DOX 后细胞内Trx-ASK1 发生了分离,接着我们检测了ASK1 是否发生活化。我们选用p-ASK1(Ser967)抗体进行Western blotting 检测。p-ASK1(Ser83)、p-ASK1(Ser967)发生去磷酸化或者p-ASK1(Thr845)发生磷酸化均可代表ASK1 的活化。本实验发现,与正常组细胞比较,DOX 组细胞内p-ASK1(Ser967)表达显著减少(P <0.01),较DOX组,ebselen+DOX 组细胞内p-ASK1(Ser967)表达显著增加(P <0.01)。这可以说明给予DOX 后,ASK1 发生了活化,给予ebselen 后活化减少。我们发现与正常组细胞比较,DOX 组细胞内p-p38 表达显著增加(P <0.01),较DOX 组,ebselen +DOX组细胞内p-p38 表达显著减少(P <0.01)。这说明,给予DOX 后,细胞内p38 发生了活化,给予ebselen 后,活化减少。由此说明,DOX 体外诱导的心肌细胞凋亡过程中Trx-ASK1 发生了一定程度的分离,ASK1、p38、caspase-3 和PARP1 均参与了这一凋亡过程。
DOX 作用心肌细胞后细胞内硝基酪氨酸量显著增加,过多亚硝酸盐的产生可以使一些凋亡相关蛋白发生硝基化进而导致凋亡的发生[11]。DOX 作用心肌细胞可以抑制一些特定基因的表达[12-13]。本文主要是探讨在氧化应激的情况下Trx-ASK1 这一复合体的变化,以及下游相关蛋白的变化。对于在这一过程中凋亡信号通路中其它蛋白的变化情况以及是否还存在其它凋亡机制,我们将在后续工作中进一步探讨。
综上所述,本实验初步证实DOX 诱导心肌细胞凋亡过程中,Trx-ASK1 发挥了一定的作用,这将有助于进一步了解DOX 心脏毒性的机制。
[1] Eklund H,Gleason FK,Holmgren A,et al. Structural and functional relations among thioredoxins of different species[J]. Proteins,1991,11(1):13-28.
[2] Bishopric NH,Webster KA. Preventing apoptosis with thioredoxin:ASK me how[J]. Circ Res,2002,90(12):1237-1239.
[3] Singal PK,Khaper N,Palace V,et al. The role of oxidative stress in the genesis of heart disease[J]. Cardiovasc Res,1998,40(3):426-432.
[4] Ewer MS,Ewer SM. Cardiotoxicity of anticancer treatments:what the cardiologist needs to know[J]. Nat Rev Cardiol,2010,7(10):564-575.
[5] Aiken MJ,Suhag V,Garcia CA,et al. Doxorubicin-induced cardiac toxicity and cardiac rest gated blood pool imaging[J]. Clin Nucl Med,2009,34(11):762-767.
[6] Olson RD,Mushlin PS. Doxorubicin cardiotoxicity:analysis of prevailing hypotheses [J]. FASEB J,1990,4(13):3076-3086.
[7] Simpson P,McGrath A,Savion S. Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells. Cross-striations,ultrastructure,and chronotropic response to isoproterenol[J]. Circ Res,1982,50(1):101-116.
[8] Kalay N,Basar E,Ozdogru I,et al. Protective effects of carvedilol against anthracycline-induced cardiomyopathy[J]. J Am Coll Cardiol,2006,48(11):2258-2262.
[9] Neilan TG,Blake SL,Ichinose F,et al. Disruption of nitric oxide synthase 3 protects against the cardiac injury,dysfunction,and mortality induced by doxorubicin[J].Circulation,2007,116(5):506-514.
[10] 吴伟康,杨 辉,赵明奇. 阿霉素性心力衰竭模型的氧化应激和凋亡机制[J]. 中国病理生理杂志,2004,20(8):1437-1439.
[11] Pacher P,Liaudet L,Bai P,et al. Potent metalloporphyrin peroxynitrite decomposition catalyst protects against the development of doxorubicin-induced cardiac dysfunction[J]. Circulation,2003,107(6):896-904.
[12] Jeyaseelan R,Poizat C,Wu HY,et al. Molecular mechanisms of doxorubicin-induced cardiomyopathy. Selective suppression of Reiske iron-sulfur protein,ADP/ATP translocase,and phosphofructokinase genes is associated with ATP depletion in rat cardiomyocytes[J]. J Biol Chem,1997,272(9):5828-5832.
[13] An J,Li P,Li J,et al. ARC is a critical cardiomyocyte survival switch in doxorubicin cardiotoxicity[J]. J Mol Med,2009,87 (4):401-410.
