长期培养的人脐带间充质干细胞PCNA、IL-6、IL-11 和galectin-3 的表达*
2012-12-23毛文哲李扬秋陈少华廖继东
毛文哲, 许 超, 李扬秋, 陈少华, 柳 菁, 刘 俊, 廖继东△
(暨南大学医学院1田家炳医学实验中心,2血液病研究所,3生物化学教研室,广东 广州510632)
间充质干细胞(mesenchymal stem cells,MSCs)是一群中胚层来源的具有自我更新和多向分化潜能的多能成体干细胞,在细胞治疗、组织修复、基因治疗等方面显示出巨大的应用潜力。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)具有含量丰富、取材方便的特征,其采集过程对母胎均无不良影响,是理想的MSCs 来源[1]。
hUC-MSCs 较骨髓等其它组织来源MSCs 具有更强的分化增殖能力、更低的免疫原性,在体外连续培养达80 个细胞倍增时间可仍保持其多向分化潜能和增殖能力[2-3]。有学者采用基因芯片扫描不同培养条件下50 d 传代培养的人骨髓MSCs,显示其基因表达谱随培养时间的增加而波动幅度增大[4]。我们曾报道在常规体外培养环境下,随着传代次数的递增,hUC-MSCs 的增殖及粘附能力下降,细胞凋亡率增加,生物学活性呈逐渐下降趋势[5]。已知MSCs发挥其造血支持、免疫调节功能与细胞因子密切相关[6-7]。本研究进一步分析hUC-MSCs 在长期培养传代过程中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、白细胞介素-6 (interleukin-6,IL-6)、IL-11 和半乳糖凝集素-3(galectin-3)mRNA 及蛋白表达趋势,为hUC-MSCs 的实验研究和临床应用提供实验资料和理论依据。
材 料 和 方 法
1 材料和试剂
无菌条件下采集足月剖宫产胎儿脐带6 份,均征得产妇及家属的同意,由暨南大学第一附属医院妇产科提供;DMEM/F12 培养基和胎牛血清购自Gibco;人脐带间充质干细胞成骨、成脂诱导分化培养基购自Cyagen;RNAsimple Total RNA Kit、TIANScript RT Kit、2 ×Taq Platinum PCR MasterMix 和RealMasterMix(SYBR GreenⅠ)购自北京天根生化科技有限公司;人IL-6 和人IL-11 定量检测试剂盒购自上海西唐生物科技有限公司;RIPA 裂解液购自上海碧云天生物科技研究所;galectin-3 和β-actin 抗体购自北京博奥森生物技术有限公司;所有引物由英维捷基贸易有限公司合成。
2 hUC-MSCs 的分离、传代和生物学特征鉴定
取8 cm 无菌脐带组织,PBS 洗除余血,剪成约1 mm×1 mm×1 mm,经0.2%胶原酶Ⅱ37 ℃振荡消化2 h,过滤收集细胞,用含10%FBS 的DMEM/F12溶液按2.4 ×104cells/cm2密度接种于康宁25 cm2塑料培养瓶,置37 ℃、5%CO2、饱和湿度培养箱中培养。当培养细胞达90%融合时,用0. 25% 胰酶消化,并按同一细胞密度传代。收集第3、28 代细胞,用流式细胞仪检测细胞表型。同时另取适量细胞于内含胶原蛋白处理无菌盖玻片的6 孔板内,如前继续培养。成骨诱导组24 h 后将培养基更换为成骨诱导分化培养基(含DMEM/F12、10%胎牛血清、青霉素-链霉素双抗、L-谷氨酰胺、抗坏血酸盐、β-甘油磷酸及地塞米松),每3 d 换1 次液,2 ~3 周后,茜素红染色鉴定;成脂诱导组待细胞达到过融合状态时,将培养基更换为成脂诱导分化培养基A 液(含DMEM/F12、10%胎牛血清、青霉素-链霉素双抗、L-谷氨酰胺、胰岛素、IBMX、吲哚美辛及地塞米松),3 d 后更换为B 液(含DMEM/F12、10%胎牛血清、青霉素-链霉素双抗、L-谷氨酰胺和胰岛素),24 h 后再次更换A 液,如此循环3 ~5 次后,以B 液培养7 d,油红O 染色鉴定。
3 qRT-PCR 检测PCNA、IL-6、IL-11 和galectin-3 mRNA 表达
分别收集第3、8、18、28、33 代达90%融合状态的hUC-MSCs,按天根RNAsimple Total RNA Kit 提取RNA,TIANScript RT Kit 合成cDNA,用前按101,102,103,104稀释。根据GenBank 数据库,由Primer premier 5.0 软件设计、公司合成人PCNA、IL-6、IL-11、galectin-3 和β2-微球蛋白(β2-microglobulin,β2M)引物。引物序列和预计扩增片段长度见表1。根据Real Master Mix(含SYBR GreenⅠ)配置PCR反应体系,95 ℃3 min 30 s,95 ℃15 s,Tm 30 s,70 ℃1 min 15 s,读板,共44 个循环。结果以扩增循环数(Ct 值)为纵坐标,各稀释度的对数值为横坐标绘制标准曲线。观察扩增动力学曲线和溶解曲线,用公式2-ΔΔCt方法进行相对定量,计算得出目的基因相对于管家基因β2M 的量。
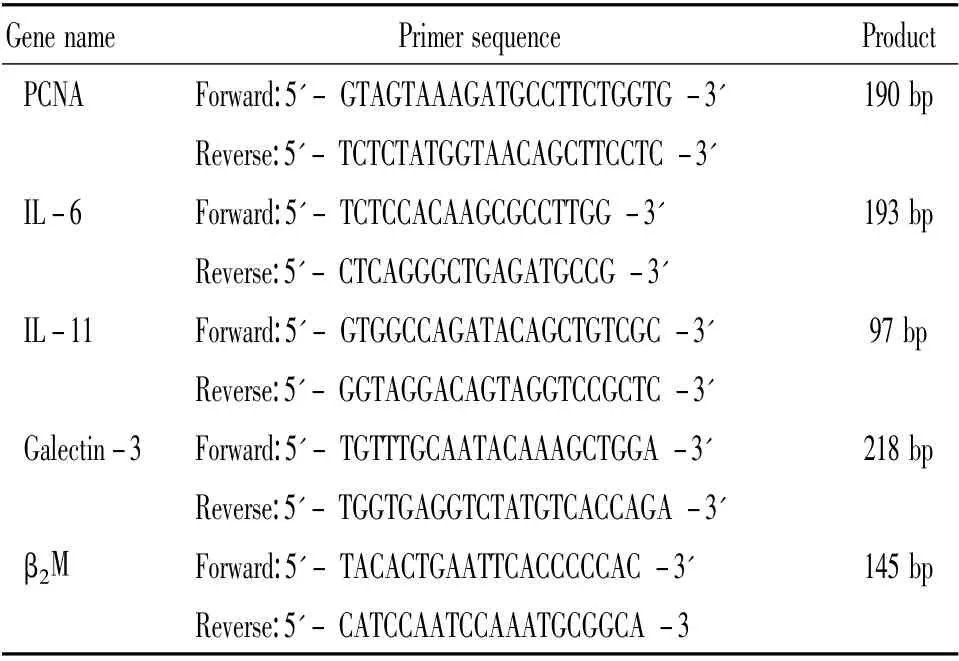
表1 引物序列Table 1. Sequences of the primers
4 ELISA 检测细胞培养上清IL-6 和IL-11 含量
按1 ×108cells/L 浓度接种hUC-MSCs 于6 孔板中,当细胞达90%融合时,收集上清,按人IL-6和IL-11 定量检测试剂盒操作分别检测第3、8、18、28、33 代细胞的IL-6 和IL-11 分泌量。
5 Western bloting 检测galectin-3 蛋白表达
采用RIPA 裂解液分别抽提第3、8、18、28、33 代hUC-MSCs 总蛋白。用10%分离胶SDS-PAGE 电泳,转膜,5%脱脂奶粉室温封闭4 h,加Ⅰ抗孵育,标记结合Ⅱ抗,ECL 荧光显色定影。
6 统计学处理
用SPSS 16.0 统计软件进行分析。数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著差异法(LSD 法)。以P <0.05 为差异有统计学意义。
结 果
1 hUC-MSCs 的形态及生长特性
经胶原酶消化分离的人脐带细胞接种24 h 后贴壁,3 d 后细胞形态呈多边形或长梭形,同时含有部分杂细胞,见图1A。传至第3 代时细胞呈长梭形、大小均一平行排列为螺旋状或旋涡状的成纤维母细胞样,见图1B。继续培养至第23 代,细胞形态无明显变化,见图1C。当培养至第28 代时,细胞生长速度减缓,细胞变大,形态杂乱,见图1D。

Figure 1. Morphology of human umbilical cord mesenchymal stem cells at different passages (×100). A:primary cells;B:passage 3;C:passage 23;D:passage 28.图1 不同代人脐带间充质干细胞的形态
2 hUC-MSCs 的分化能力
第3 代和第28 代hUC-MSCs 经成骨诱导分化培养后,茜素红染色细胞间可见大量的红色钙化基质沉积,见图2A、B;经成脂诱导分化培养后,油红O染色,细胞内可见红色脂滴,见图2C、D,表明它们均具有向成骨细胞和脂肪细胞分化的潜能。

Figure 2. Osteogenic (A,B;alizarin red staining,×100)and lipogenic (C,D;oil red O staining,×200)differentiation of human umbilical cord mesenchymal stem cells at the 3rd (A,C)and 28th (B,D)passages.图2 第3、28 代人脐带间充质干细胞的成骨和成脂分化
3 hUC-MSCs 的表型
流式细胞术检测显示体外培养第3 代和第28代hUC-MSCs 的细胞表型均为:CD29+/CD44+/CD105+/CD31-/CD34-/CD40-/CD45-/CD106-/HLA-DR-,见图3A、B。
4 不同代hUC-MSCs PCNA mRNA 的表达
不同代hUC-MSCs 的qRT-PCR 检测结果见表2,随着传代次数的增加,PCNA mRNA 的表达量逐渐降低,第28、33 代细胞与第3、8、18 代相比差异有统计学意义(P <0.05 或P <0.01),第33 代较第3 代降低了33%(P <0.01)。
5 不同代hUC-MSCs IL-6 的mRNA 表达和蛋白分泌
不同代hUC-MSCs 的qRT-PCR 检测结果见表2,随着传代次数的增加,IL-6 mRNA 逐渐降低,第28、33 代与第3、8、18 代相比差异显著(P <0.05 or P <0.01),第33 代较第3 代IL-6 mRNA 的表达量降低了56%(P <0.01)。ELISA 检测结果见表3,随着传代次数的增加,IL-6 蛋白分泌量也逐渐降低,第28、33 代与第3、8、18 代相比差异显著(P <0.01),第33 代较第3 代降低了50.3%(P <0.01)。
6 不同代hUC-MSCs IL-11 的mRNA 表达和蛋白分泌

Figure 3. The surface markers of human umbilical cord mesenchymal stem cells at the 3rd and 28th passages detected by flow cytometry. A:passage 3;B:passage 28.图3 流式细胞术检测第3 代和第28 代人脐带间充质干细胞表型
表2 不同代人脐带间充质干细胞的PCNA 、IL-6、IL-11 和galectin-3 mRNA 表达量Table 2. Expression of PCNA,IL-6,IL-11 and galectin-3 mRNA in different passages of human umbilical cord mesenchymal stem cells (±s.n=6)

表2 不同代人脐带间充质干细胞的PCNA 、IL-6、IL-11 和galectin-3 mRNA 表达量Table 2. Expression of PCNA,IL-6,IL-11 and galectin-3 mRNA in different passages of human umbilical cord mesenchymal stem cells (±s.n=6)
* P <0.05,**P <0.01 vs passage 3;#P <0.05,##P <0.01 vs passage 28;△P <0.05,△△P <0.01 vs passage 33.
Group PCNA IL-6 IL-11 Galectin-3 Passage 3 1##△△ 1##△△ 1##△△1 Passage 8 0.99 ±0.18#△△ 0.99 ±0.24##△△ 1.24 ±0.37##△△ 1.07 ±0.17 Passage 18 0.98 ±0.15##△△ 0.63 ±0.17**#△ 0.88 ±0.15* ##△△ 1.02 ±0.19 Passage 28 0.76 ±0.18** 0.42 ±0.22** 0.69 ±0.11** 1.01 ±0.25 Passage 33 0.67 ±0.15** 0.44 ±0.14** 0.63 ±0.14**0.97 ±0.16
表3 不同代人脐带间充质干细胞的IL-6 和IL-11 分泌量Table 3. Secretion of IL-6 and IL-11 in different passages of human umbilical cord mesenchymal stem cells (ng/L.±s.n=6)

表3 不同代人脐带间充质干细胞的IL-6 和IL-11 分泌量Table 3. Secretion of IL-6 and IL-11 in different passages of human umbilical cord mesenchymal stem cells (ng/L.±s.n=6)
* P <0.05,**P <0.01 vs passage 3;#P <0.05,##P <0.01 vs passage 28;△P <0.05,△△P <0.01 vs passage 33.
Group IL-6 IL-11 Passage 3 211.44±30.20##△△ 147.23±12.20##△△Passage 8 206.59±28.50##△△ 157.87±13.60##△△Passage 18 144.94±17.10**#△△ 118.85±10.20**##△△Passage 28 118.14±15.80** 50.10±6.10**△Passage 33 105.01±12.20** 60.39±5.90**
不同代hUC-MSCs的qRT-PCR 检测 结果见表2,随着传代次数的增加,IL-11 mRNA 逐渐降低,第18、28、33 代与第3、8 代相比差异显著(P <0.05 or P <0.01),第33 代较第3 代表达量降低了37%(P <0.01)。ELISA 检测结果见表3,随着传代次数的增加,IL-11 蛋白分泌量也会逐渐降低,第28、33代与第3、8、18 代相比差异显著(P <0.01),第33 代较第3 代降低了58.9%(P <0.01)。
7 不同代hUC-MSCs galectin-3 mRNA 和蛋白的表达
不同代hUC-MSCs 的qRT-PCR 检测结果见表2,显示各代细胞之间galectin-3 mRNA 表达量无显著差异(P >0.05)。Western bloting 结果见图4,显示各代间galectin-3 蛋白条带亮度无明显差异。

Figure 4. Expression of galectin-3 protein in different passages of human umbilical cord mesenchymal stem cells. 1:passage 3;2:passage 8;3:passage 18;4:passage 28;5:passage 33.图4 不同代人脐带间充质干细胞galectin-3 蛋白的表达
讨 论
MSCs 源自发育早期的中胚层,存在于多种机体组织内,具有来源广泛、取材容易、分离纯化程序简单,便于体外长期传代培养扩增和保存等优点,已成为替代治疗和基因治疗领域中极具实用价值的干细胞。MSCs 能释放大量细胞因子,在机体内相互促进或相互抑制,形成十分复杂的细胞因子调节网络[8],对于MSCs 发挥造血支持、免疫调节、组织修复等功能具有重要意义。本文分析常规条件下长期传代培养hUC-MSCs 的功能相关细胞因子PCNA、IL-6、IL-11 和galectin-3 mRNA 和蛋白表达变化情况,探讨hUC-MSCs 相关功能在长期培养过程中的变化趋势,为获取具有最佳性能的hUC-MSCs 或选择适当的细胞因子作干细胞治疗辅助手段提供实验资料和理论依据。
从正常剖宫产胎儿脐带华氏胶组织中提取细胞,经塑料培养瓶贴壁、传代培养3 代后细胞呈均一的梭形成纤维母细胞样聚集分布,传代至第23 代时细胞形态无明显变化,而传代至第28 代时细胞有老化现象,继续传代至第33 代时老化现象尤其突出,细胞形体较大,碎片较多,生物学活性明显降低,细胞生长不能维持到诱导分化所需的时间。为鉴定培养传代起始和后期细胞的生物学特性,取第3 代和第28 代细胞进行细胞表型和诱导分化能力的鉴定。第3 代和第28 代细胞表型均为CD29+/CD44+/CD105+/CD31-/CD34-/CD40-/CD45-/CD106-/HLA-DR-,且均可向成骨和脂肪细胞分化,证实我们从脐带中分离培养的细胞符合首届胎盘来源干细胞国际研讨会及国际细胞治疗协会关于MSCs 的标准[9],且可传代培养至第33 代,第28 代仍保持MSCs 表型和分化能力。
PCNA 是真核细胞DNA 聚合酶δ 的辅助蛋白,参与细胞增殖过程DNA 的合成,是反映细胞增殖活性的良好标志物[10],实验结果显示PCNA mRNA 表达随着培养时间的增加而减少,第33 代较第3 代PCNA mRNA 表达量降低了33%,差异显著(P <0.01),证实长期传代培养的hUC-MSCs 增殖能力随着培养时间的增加而下降,与我们报道的长期传代培养的hUC-MSCs 生物学活性呈逐渐下降趋势的结果一致[5]。
MSCs 作为造血微环境主要细胞成分的来源,通过与造血细胞直接接触、分泌细胞外基质及多种细胞因子维持造血微环境结构和功能的完整性,进而实现对造血的精细调控[11]。MSCs 与造血干细胞联合移植可促进造血重建[12]。Majumdar 等[13]研究发现骨髓MSCs 稳定的表达多种造血相关因子,支持长期造血活动。Friedman 等[14]进一步证实hUC-MSCs 分泌的造血相关细胞因子(粒细胞集落刺激因子、粒细胞巨噬细胞刺激因子、肝细胞生长因子、白细胞抑制因子、IL-1a、IL-6、IL-8、IL-11)较骨髓MSCs 多。本实验发现体外长期培养hUC-MSCs IL-6 及IL-11 的mRNA 和蛋白表达会随细胞代数发生改变。第33 代较第3 代IL-6 和IL-11 mRNA及蛋白表达量均明显降低(均P <0.01),提示hUC-MSCs 的造血支持能力可能随着体外长期培养传代而降低,因此在临床应用时需考虑此因素。
MSCs 除了具有支持造血的功能外,还具有独特的免疫学特性,在体外不仅能诱导免疫应答,而且还具有抑制免疫反应的作用。MSCs 免疫调节的机制主要涉及两个方面,一方面是细胞的接触机制,另一方面是非细胞接触机制,即细胞因子的分泌和细胞蛋白的表达。Sioud 等[15]研究发现,galectin-3 是MSCs 发挥免疫抑制功能的重要调节分子,MSCs 表达的galectin-3 可以抑制同种异体T 细胞增殖。本实验显示,在体外长期传代培养过程中hUC-MSCs galectin-3 mRNA 的表达无明显变化,且各代细胞间galectin-3 蛋白的表达亦无明显差异,这是否意味着体外长期传代培养对hUC-MSCs 的免疫调节功能没有影响,这有待进一步探讨。
[1] Seshareddy K,Troyer D,Weiss ML. Method to isolate mesenchymal-like cells from Wharton’s Jelly of umbilical cord[J]. Methods Cell Biol,2008,86:101-119.
[2] Secco M,Zucconi E,Vieira NM. Mesenchymal stem cells from umbilical cord:do not discard the cord[J]. Neuromuscular Disord,2008,18(1):17-18.
[3] Wulf GG,Chapuy B,Trumper L. Mesenchymal stem cells from bone marrow. Phenotype,aspects of biology,and clinical perspectives [J]. Medizinische Klinik,2006,101(5):408-413.
[4] Sawada R,Yamada T,Tsuchiya T,et al. A microarray analysis of the effects of serum-free medium on gene expression changes in human mesenchymal stem cell during the in vitro culture [J]. Yakugaku Zasshi,2010,130(10):1387-1393.
[5] 许 超,廖继东,柳 菁,等.长期培养人脐带间充质干细胞的生物活性及其限制性[J].中国组织工程研究与临床康复,2011,15(10):1750-1754.
[6] Kim DH,Yoo KH,Choi KS,et al. Gene expression profile of cytokine and growth factor during differentiation of bone marrow derived mesenchymal stem cell[J]. Cytokine,2005,31(2):119-126.
[7] 朱雅姝,赵春华. 间充质干细胞的免疫调节能力——临床治疗的希望[J]. 中国科学:C 辑,2009,39(8):727-735.
[8] Schinkothe T,Bloch W,Schmidt A. In vitro secreting profile of human mesenchymal stem cells[J]. Stem Cells Dev,2008,17(1):199-206.
[9] Dominici M,Le Blanc K,Mueller I,et al. Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J]. Cytotherapy,2006,8 (4):315-317.
[10] Kelman Z. PCNA:structure,functions and interactions[J]. Oncogene,1997,14(6):629-640.
[11] 霍思维,张 毅. 间充质干细胞在造血调控中的作用[J]. 中国实验血液学杂志,2006,14(1):187-190.
[12] Battiwalla M,Hematti P.Mesenchymal stem cells in hematopoietic stem cell transplantation [J]. Cytotherapy,2009,11(5):503-515.
[13] Majumdar M,Thiede M,Haynesworth S,et al. Human marrow-derived mesenchymal stem cells (MSCs)express hematopoietic cytokines and support long-term hematopoiesis when differentiated toward stromal and osteogenic lineages[J].J Hematother Stem Cell Res,2000,9(6):841-848.
[14] Friedman R,Betancur M,Boissel L,et al. Umbilical cord mesenchymal stem cells:adjuvants for human cell transplantation [J]. Biol Blood Marrow Transplant,2007,13(12):1477-1486.
[15] Sioud M,Mobergslien A,Boudabous A,et al. Evidence for the involvement of galectin-3 in mesenchymal stem cell suppression of allogeneic T-cell proliferation[J].Scand J Immunol,2010,71(4):267-274.
