ox-LDL 对巨噬细胞内皮脂肪酶表达的影响*
2012-12-23吴晓倩何丽姗
吴晓倩,宜 全,何丽姗
(广州医学院药理教研室,广东 广州510182)
心脑血管疾病位居人类疾病谱首位,动脉粥样硬化(atherosclerosis,AS)是其主要病理基础。血浆高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平与冠心病的发病率呈显著负相关,提高血浆HDL-C 已被证实是防治动脉粥样硬化类疾病的重要策略[1]。内皮脂肪酶(endothelial lipase,EL)是HDL 代谢的关键酶[2],由内皮细胞合成,以旁分泌的方式在血管局部发挥作用。Ishida等[3]在Apo-E 基因敲除小鼠中研究发现,EL 介导单核细胞向发生粥样硬化区域游走并黏附,下调HDL 水平,EL 与Apo-E 基因双敲除小鼠发生动脉粥样硬化的敏感性上升,提示EL 可能通过调节HDL代谢参与动脉粥样硬化的发生发展。EL 在动脉粥样硬化患者冠状动脉内皮细胞、中膜血管平滑肌细胞、吞噬细胞及粥样斑块新生血管中都有表达[4]。然而EL 在动脉粥样硬化中的表达调控并不十分明确。氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是促动脉粥样硬化形成和发展的关键因素,参与内皮功能损伤、泡沫细胞形成和炎症的发生等。ox-LDL 是否影响EL 的表达,尚未见国内、外文献报道。本实验采用鼠源RAW264.7 巨噬细胞研究ox-LDL 对EL 表达的影响及其可能机制。
材 料 和 方 法
1 材料与试剂
鼠源RAW264.7 巨噬细胞由中国科学院上海生物化学与细胞生物学研究所细胞库提供。DMEM 高糖培养基、胎牛血清和胰蛋白酶购自Gibco。BCA 蛋白定量试剂盒和增强化学发光(enhanced chemiluminescence,ECL)试剂盒购自Pierce。蛋白电泳分子量(7 ~175 kD)标记和EL 抗体、α-tubulin 抗体、NF-κB p65 抗体和IκBα 抗体购自Cell Signaling。核蛋白抽提试剂盒(cell nuclear extraction kit)和PDTC购自Sigma。Histone H1 抗体、抗兔Ⅱ抗和抗小鼠Ⅱ抗购自Santa Cruz。其余试剂均为分析纯产品。
2 ox-LDL 的制备和鉴定[5]
采用序列超速离心法分离健康人新鲜血浆低密度脂蛋白,经琼脂糖电泳、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳均显示为单一蛋白条带。提纯的LDL用不含EDTA 的PBS 液透析48 h,随后在含10 μmol/L CuSO4的PBS 液(pH 7.2)中37 ℃温育透析12 h,最后在含100 μmol/L EDTA 的PBS 中4 ℃透析24 h。过滤除菌、定量,用PBS 调蛋白浓度至1 g/L,4 ℃保存备用。取氧化前后的LDL,琼脂糖凝胶电泳鉴定。
3 细胞培养与实验分组
正常生长的RAW264.7 巨噬细胞用高糖DMEM培养基(含10% 胎牛血清)调节细胞密度至1.25 ×108/L,37 ℃、5% CO2培养箱中培养。细胞同步化24 h。随机分组,分别用(0 ~100 mg/L)ox-LDL 孵育细胞24 h;PDTC 预孵育细胞30 min 后再加50 mg/L ox-LDL 孵育24 h。
4 EL 表达检测
细胞处理后,用细胞刮刮下细胞,PBS 洗涤,RIPA 裂解细胞,10 000 ×g、4 ℃离心30 min,取上清,定量。Western blotting 主要步骤如下:经SDS-聚丙烯酰胺凝胶电泳分离,电转。5%脱脂牛奶于室温振荡封闭60 min,Ⅰ抗4 ℃孵育过夜,TBS 缓冲液冲洗,Ⅱ抗室温孵育2 h,TBS 缓冲液冲洗,曝光,采用Image-Pro Plus 软件分析条带A 值,α-tubulin 为内参照。实验重复3 次。
5 核蛋白提取与NF-κB、IκBα 检测
参照Sigma 公司试剂盒说明书进行核蛋白提取,主要步骤如下:收集细胞,加lysis buffer 冰上孵育15 min,加Igepal CA-630 剧烈涡旋10 s,10 000 ×g、4℃离心30 s,取上清得胞浆蛋白,用于检测IκBα 表达;沉淀为细胞核,加extract buffer 重悬细胞核,冰上孵育30 min,并不断剧烈涡旋。20 000×g、4 ℃离心5 min,取上清用于检测NF-κB p65 亚基表达。Western blotting 同上述方法。Histone H1 为核蛋白内参照,α-tubulin 为胞浆蛋白内参照。实验重复3 次。
6 统计学处理
结 果
1 ox-LDL 对RAW264.7 细胞EL 表达的影响
不同浓度(0 ~100 mg/L)的ox-LDL 孵育RAW264.7 细胞使EL 蛋白表达增加。50 mg/L ox-LDL 达到高峰,为空白对照组的(1.92 ±0.34)倍(P<0.05),见图1。

Figure 1. Effect of ox-LDL on EL protein expression in RAW264.7 cells. ±s. n =3. *P <0.05 vs control(0 mg/L).图1 ox-LDL 对RAW264.7 细胞EL 表达的影响
2 ox-LDL 刺激RAW264.7 细胞NF-κB 活化
50 mg/L ox-LDL 作用于RAW264.7 细胞15 min IκBα 开始降解,30 min 几乎降解到最低。同时NF-κB p65 表达开始增加,15 ~30 min 增加到最高,见图2。
3 PDTC 抑制ox-LDL 诱导的RAW264.7 细胞EL 表达增加
NF-κB 阻断剂PDTC 预孵育细胞30 min,再用50 mg/L ox-LDL 孵育细胞24 h 后发现,PDTC+ox-LDL 组EL 蛋白表达水平比ox-LDL 组明显下降(P <0.05),见图3。
讨 论
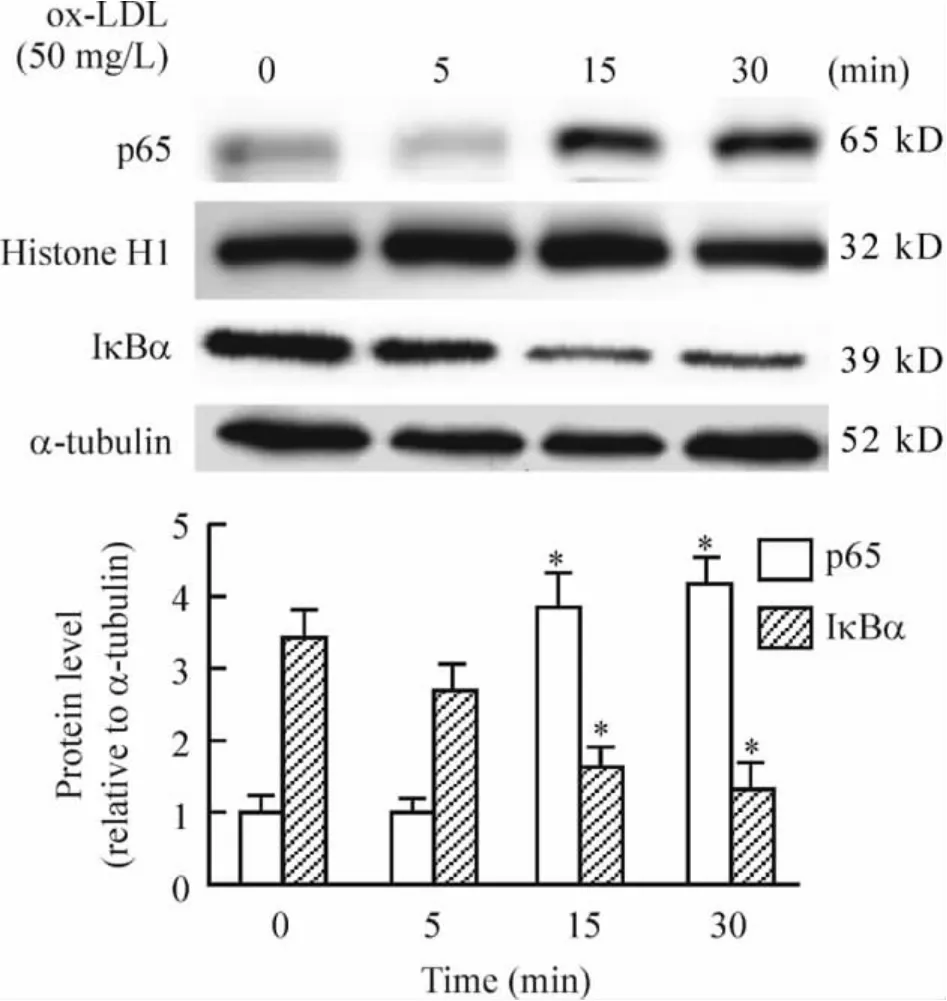
Figure 2. ox-LDL induced activation of NF-κB in RAW264.7 cells. ±s. n=3. *P <0.05 vs control (0 min).图2 ox-LDL 刺激RAW264.7 细胞NF-κB 活化

Figure 3. The increased EL expression induced by ox-LDL was inhibited by PDTC. The RAW264.7 cells were treated with 50 mg/L ox-LDL for 24 h with or without pretreatment with 100 μmol/L of PDTC for 30 min. ±s. n =6. **P <0. 01 vs control;#P <0. 05 vs ox-LDL.图3 PDTC 抑制ox-LDL 诱导的RAW264.7 细胞EL 表达增加
EL 是1999 年被发现的甘油三酯脂肪酶家族的新成员。与肝脂肪酶和脂蛋白脂肪酶不同,EL 具有较强的磷脂酶活性。HDL 被证明是EL 的特异性底物[6]。EL 升高会导致血浆HDL-C、apoA-I 水平明显下降[7],而EL 基因突变则会引起血浆HDL 增高[8-9]。而且,EL 对HDL 的水解作用存在明显的剂量依赖性:给小鼠注射不同剂量含EL cDNA 的重组腺病毒后出现剂量依赖性的血浆磷脂酶活性上升和磷脂、HDL、apoA-I 水平下降[10]。这些研究表明,EL 与体内HDL 水平密切相关。HDL-C 负责体内胆固醇逆向转运,提高血浆HDL-C 被证实是防治动脉粥样硬化类疾病的重要策略。因此,明确EL 表达的调控、改善HDL-C 水平可能为治疗动脉粥样硬化提供新的思路。
ox-LDL 被认为是动脉粥样硬化的关键致病因素,介导巨噬细胞泡沫化、炎症细胞浸润、内皮细胞损伤、血管平滑肌细胞迁移等,贯穿动脉粥样硬化发展的整个过程。然而ox-LDL 是否影响EL 表达尚未见报道,本研究发现ox-LDL 剂量依赖性地增加EL 的表达。也有文献报道,AS 相关炎症因子TNFα、IL-1β 是通过NF-κB 通路上调EL mRNA 和蛋白水平及其酶活性[11]。这些研究与我们的实验结果提示EL 可能受到ox-LDL、炎症因子的调控参与动脉粥样硬化过程。
NF-κB 是一个氧化-还原敏感性核转录因子,主要由p50 和p65 2 个亚基组成。静息状态下,NF-κB 由于被其天然抑制剂IκBs (IκBα、β、ε、ζ)蛋白包裹在胞浆中处于失活状态;当细胞受到某些刺激(如氧化应激、炎症等),IKKα/β 蛋白激酶催化IκBs丝氨酸残基磷酸化(Ser32 和Ser36)继而被26S 蛋白酶体降解,使得NF-κB p65 亚单位释放并从细胞质移位到细胞核,与靶基因上启动子的特定序列结合,启动多种靶基因转录和蛋白质表达,参与动脉粥样硬化过程[12]。本实验结果表明,ox-LDL 刺激RAW264.7 细胞15 min 胞浆中IκBα 降解增多,而核NF-κB p65 亚单位磷酸化增加,提示NF-κB 被激活。为研究NF-κB 是否参与ox-LDL 刺激引起的EL 表达增加,我们采用NF-κB 抑制剂PDTC 预处理细胞1 h 后发现,ox-LDL 引起的EL 表达增加被抑制。这提示ox-LDL 可能通过NF-κB 途径上调EL 的表达。
综上所述,本研究发现ox-LDL 能够剂量依赖性地增加EL 表达,该作用可能由NF-κB 介导。然而EL 在动脉粥样硬化中的作用以及以EL 为靶点、以HDL 为底物的药物筛选体系建立的可能性还有待进一步研究,以期为开发以调节HDL 水平治疗动脉粥样硬化的药物提供新的思路。
[1] Linsel-Nitschke P,Tall AR. HDL as a target in the treatment of atherosclerotic cardiovascular disease [J].Nat Rev Drug Discov,2005,4(3):193-205.
[2] Jaye M,Lynch KJ,Krawiec J,et al. A novel endothelial-derived lipase that modulates HDL metabolism[J].Nat Genet,1999,21(4):424-428.
[3] Ishida T,Choi SY,Kundu RK,et al. Endothelial lipase modulates susceptibility to atherosclerosis in apolipoprotein-E-deficient mice[J]. J Biol Chem,2004,279(43):45085-45092.
[4] Yasuda T,Ishida T,Rader DJ. Update on the role of endothelial lipase in high-density lipoprotein metabolism,reverse cholesterol transport,and atherosclerosis[J].Circ J,2010,74(11):2263-2270.
[5] 卜梓斌,姜志胜,马珍妮,等. 氧化高密度脂蛋白通过MAPKs 信号转导途径诱导ECV304 细胞表达组织因子[J]. 中国病理生理杂志,2009,25(4):636-641
[6] Griffon N,Budreck EC,Long CJ,et al. Substrate specificity of lipoprotein lipase and endothelial lipase:studies of lid chimeras[J]. J Lipid Res,2006,47(8):1803-1811.
[7] Tanaka H,Ishida T,Johnston TP,et al. Role of endothelial lipase in plasma HDL levels in a murine model of hypertriglyceridemia[J]. J Atheroscler Thromb,2009,16(4):327-338.
[8] Edmondson AC,Brown RJ,Kathiresan S,et al. Loss-of-function variants in endothelial lipase are a cause of elevated HDL cholesterol in humans[J]. J Clin Invest,2009,119(4):1042-1050.
[9] Hara T,Ishida T,Kojima Y,et al. Targeted deletion of endothelial lipase increases HDL particles with anti-inflammatory properties both in vitro and in vivo[J].J Lipid Res,2011,52(1):57-67.
[10] Maugeais C,Tietge UJ,Broedl UC,et al. Dose-dependent acceleration of high-density lipoprotein catabolism by endothelial lipase[J]. Circulation,2003,108(17):2121-2126.
[11] Jin W,Sun GS,Marchadier D,et al. Endothelial cells secrete triglyceride lipase and phospholipase activities in response to cytokines as a result of endothelial lipase[J].Circ Res,2003,92(6):644-650.
[12] Gareus R,Kotsaki E,Xanthoulea S,et al. Endothelial cell-specific NF-kappa B inhibition protects mice from atherosclerosis[J]. Cell Metab,2008,8(5):372-383.
