Maspin 在前列腺癌PC-3 细胞生物学行为中的作用
2012-12-23刘美琴
刘美琴, 周 珺, 马 亮, 国 风
(苏州大学附属第一医院中心实验室,江苏 苏州215006)
乳腺丝氨酸蛋白酶抑制剂(mammary serine protease inhibitor,maspin)是丝氨酸蛋白酶抑制剂(serpin)超家族中的一个独特成员[1]。maspin 表达的临床意义受制于遗传背景、组织类型和基础表达水平等因素[2]。在包括前列腺癌在内的多种实体瘤中,maspin 被认为是一个抑癌基因。本研究中,我们通过RNA 干扰技术并建立稳定转染细胞系来探讨maspin 如何影响前列腺癌细胞生物学行为的变化。
材 料 和 方 法
1 主要试剂、抗体和仪器
RPMI-1640 购自Gibco-BRL;胎牛血清购自杭州四季青公司;限制性内切酶Hpa I 和Xho l 购自NEB;质粒小抽和大抽试剂盒购自Omega;SyberGreen Mix 购自美季公司;M-MLV 购自Invitrogen;转染试剂Fugene HD 和蛋白酶抑制剂购自Roche;maspin 抗体(554292)购自BD Bioscience;RelA(sc-8008)和RelB(sc-226)抗体购自Santa Cruz Biotechnology;β-actin 抗体(AA128)购自碧云天公司;荧光Ⅱ抗购自Li-cor;MG-132 购自Sigma;流式细胞仪FACSCalibur 购自BD Bioscience;荧光倒置显微镜购自Olympus;NanoDrop 购自Thermo;LightCycler® 480 实时荧光定量PCR 仪和xCELLigence 系统购自Roche;Odyssey 红外荧光扫描成像系统购自LI-COR。
2 细胞培养
雄激素非依赖型前列腺癌细胞株DU145 和PC-3 细胞为我实验室长期保存,培养于含10%胎牛血清、1×105U/L 青霉素和100 mg/L 链霉素的RPMI-1640完全培养体系中,在37℃、5%CO2和饱和湿度的培养箱中培养。包装细胞Phoenix A(由中科院动物所赵勇教授赠送)培养于含10%胎牛血清、1×105U/L 青霉素和100 mg/L 链霉素的DMEM 完全培养体系中。应用倒置显微镜观察细胞生长情况,2 ~3 d 传代1 次,选用对数生长期的细胞进行后续实验。
3 Maspin-shRNA 的设计和表达载体的构建
按shRNA 靶序列的设计原则,针对maspin 基因的靶位点设计RNA 干扰片段,具体为1 171-1 189位(5’- GCACAAGGATGAATTGAAT-3’)并在Invitrogen 公司合成。将慢病毒载体pLL3.7(中科院动物所赵勇教授赠送)用Hpa I 和Xho l 酶切并去磷酸化,然后将合成的shRNA 正链和负链退火并连接至pLL3.7 载体,连接产物转化到DH5α 大肠杆菌中,质粒小量抽提鉴定后进一步测序鉴定(华大基因公司),鉴定好的载体质粒采用试剂盒大量制备。
4 建立稳定转染maspin-shRNA 细胞系
接种0.5 ×106Phoenix A 细胞至35 mm 细胞培养皿,待细胞生长至70%~80%融合度时进行细胞转染。细胞转染试剂为Fugene FD,具体操作如说明书。包装载体为pCMV-VSV-G 和pCMV-dR8.9,与制备好的pLL3.7-shRNA 质粒(pLL3.7-siMaspin 或pLL3.7-control)共转染。pLL3.7-control 为实验阴性对照(non-silencing siRNA)。转染18 h 后荧光显微镜下观察GFP 信号并更换新鲜的DMEM 完全培养基。48 h 后,1 500 r/min 离心获得含有病毒颗粒的上清,用0.45 μm 的滤器过滤除去细胞碎片等杂质。将病毒上清和目的细胞(PC-3)混匀,培养48 h 后,用极限稀释细胞克隆形成法得到单克隆转染细胞。
5 实时荧光定量RT-PCR(qRT-PCR)
Trizol 一步法抽提细胞总RNA 并用NanoDrop 定量。取2 μg RNA 参照M-MLV 逆转录酶操作说明书逆转录合成cDNA。qRT-PCR 反应在LightCycler®480 实时荧光定量PCR 仪上完成。每个反应均设3 复孔,反应共40 次循环。以β-actin 作为内参照,检测每个反应管内荧光强度达到设定域值时所经历的循环数(即Ct 值),mRNA 的相对表达水平用2-ΔΔCt方法进行计算。引物设计使用Primer-BLAST 软件(NCBI)。
6 全蛋白提取
将5 ×106细胞用预冷的PBS 洗1 次,快速加入3 ~5 倍体积的缓冲液,再加入同体积的2 ×十二烷基硫酸钠凝胶上样缓冲液。95 ℃加热10 min 后立即置于冰上,用1 mL 注射器反复抽吸约20 次,室温,10 000 r/min 离心10 min,转移上清置-80 ℃冰箱保存。
7 Western blotting 法检测蛋白的表达
细胞裂解液,经12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,转移至硝酸纤维素膜上。5%脱脂奶粉封闭2 h 后,加入I 抗于4 ℃孵育过夜。荧光标记的II 抗(1∶2 000 稀释)2 h 室温孵育,PBST(含1%Tween 的PBS)洗膜,用Odyssey 红外荧光扫描成像系统检测待测蛋白。
8 实时细胞分析
使用xCELLigence 系统 与RTCA 1.2 软件进行细胞指数(cell index,CI)测定,并于E-Plate 16 中进行持续监测。“细胞指数”是由测得的电阻抗(electrical impedance)频谱推得的一种无量纲参数,其数值反映细胞数目(活细胞或贴附细胞数目)。无细胞状态下,加样孔(E-Plate 16)底部排列的微电极阵列的阻抗分布近似均匀;加入细胞后,细胞与电极表面接触,影响电极和溶液间离子环境,导致电阻抗升高。细胞越多电阻抗增加越多,即细胞指数值越高。用100 μL 含10% FCS 的RPMI-1640 进行细胞培养的背景电阻抗检测。每孔体积调为100 μL,密度为3 000 个细胞。接种后,电阻抗以固定时间间隔被测定,对细胞持续监测5 d。
9 流式细胞仪检测细胞死亡
收集0.5 ×106个细胞,用流式缓冲液洗1 次,加入碘化丙啶(propidium iodide,PI)染色液50 μL,室温下避光孵育5 min,用流式缓冲液洗涤后,将细胞重悬于300 μL 的流式缓冲液中,在流式细胞仪上进行t 检验或细胞死亡检测。
10 统计学处理
结 果
1 雄激素非依赖型前列腺癌细胞株中maspin 的表达
以β- actin 为对照,通过Western blotting 法检测了雄激素非依赖型前列腺癌细胞株DU145 和PC-3 细胞中maspin 的表达情况。DU145 细胞中maspin 的蛋白表达较低,而PC-3 细胞中maspin 的蛋白表达显著高于前者,见图1,故选用PC-3 细胞进行靶向沉默maspin 的实验。

Figure 1. The expression of maspin in DU145 and PC-3 prostatic cancer cells. ±s.n=4. * P <0.05 vs DU145.图1 前列腺癌DU145 和PC-3 细胞中maspin 的表达
2 稳定转染maspin-shRNA 细胞系的建立与鉴定
采用极限稀释细胞克隆形成法分别得到单克隆转染细胞PC-3-siMaspin1 和PC-3-siMaspin2,荧光实时定量qRT-PCR 法检测结果显示PC-3-siMaspin1 和PC-3-siMaspin2 细胞的maspin mRNA表达水平相比较PC-3-control 细胞有明显变化,约呈4 倍下降,见图2A。
Western blotting 法检测结果显示,PC-3-si-Maspin1 和PC-3-siMaspin2 细胞系的maspin 蛋白表达水平显著低于PC-3-control 细胞组,分别降低4 倍和6.4 倍,见图2B,故选用PC-3-siMaspin2 细胞进行后续实验。

Figure 2. The expression of maspin in PC-3 cells after transfection with maspin-shRNA. A:qRT-PCR analysis of maspin mRNA expression in prostate cancer cells;B:Western blotting analysis of maspin protein expression in whole-cell extracts of prostate cancer cells. ±s.n=3. ** P <0.01 vs PC-3-control.图2 maspin-shRNA 转染PC-3 细胞对maspin mRNA 和蛋白表达水平的影响
通过普通倒置显微镜和荧光倒置显微镜观察PC-3-siMaspin2 细胞,可见绿色荧光蛋白在细胞内广泛表达,见图3A。进一步采用流式细胞术检测到绿色荧光蛋白在PC-3-siMaspin 2 细胞中的表达率可达到95.99%,见图3B。

Figure 3. Detection of flurorescence signal and GFP expression in PC-3-siMaspin2 cells. A:PC-3-siMaspin2 cells were detected using fluorescence microscope. a:phase-contrast microscope;b:fluorescence microscope. B:flow cytometric analysis of GFP expression in PC-3-siMaspin2 cells and PC-3-control cells.图3 Maspin-shRNA 稳定转染细胞系中荧光信号的观察
3 Maspin 沉默对PC-3 细胞生长的影响
细胞计数显示PC-3-control 与PC-3-si-Maspin2 细胞在接种后的第1 d 生长相似,而在第3 d PC-3-siMaspin2 细胞生长明显快于PC-3-control 细胞,见图4A。通过xCELLigence 系统对5 d 生长过程的细胞指数进行动态检测,结果显示,第1 d两组细胞的生长速度相似(P >0.05),第2 d 起PC-3-siMaspin2 细胞生长明显快于PC-3-control细胞(P <0.05 或P <0.01),见图4B。PC-3-si-Maspin2 细胞的倍增时间为26.83 h,而PC-3-control 细胞的倍增时间为37.95 h。
4 Maspin 沉默对细胞凋亡相关基因表达的影响
qRT-PCR 结果显示,抗凋亡基因(bcl-2 和A20)在PC-3-siMaspin2 细胞mRNA 表达水平较PC-3-control 细胞有不同程度升高;而促凋亡基因(bax 和bim)在PC-3-siMaspin2 细胞mRNA 表达水平较PC-3-control 细胞有不同程度降低,见图5。
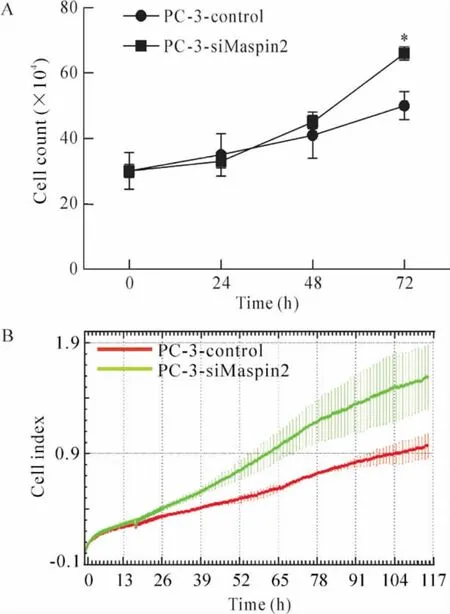
Figure 4. The effect of maspin silencing on cell growth and proliferation of PC-3 cells. A:growth curves of PC-3-control and PC-3-siMaspin2 cells. ±s. n =4. * P<0.05 vs PC-3-control. B:the proliferation of PC-3-control and PC-3-siMaspin2 cells dynamically detected using xCELLigence system. ±s.n=3.图4 Maspin 沉默对PC-3 细胞的生长和增殖的影响

Figure 5. The expresison of bcl-2,A20,bax,and bim mRNA in PC-3-control and PC-3-siMaspin2 cells analyzed by qRT-PCR. ±s. n =3. * P <0.05,**P <0.01 vs PC-3-control.图5 PC-3-control 和PC-3-siMaspin2 细胞bcl-2、A20、bax 和bim mRNA 的表达
5 蛋白酶体抑制剂对PC-3-siMaspin2 细胞的作用
应用蛋白酶体抑制剂MG-132(1 μmol/L)处理PC-3-control 和PC-3-siMaspin2 细胞,采用PI染色法检测细胞死亡率,未处理时细胞死亡率分别为9.2%±5.6%和3.8%±1.2%,MG-132 作用8 h细胞死亡率分别为27.1%±5.6%和7.5%±2.3%;作用24 h 细胞死亡率为24.2%±3.7%和8.2% ±2.5%,作用36 h 细胞死亡率为28. 7%±3. 7% 和7.6%±2.5%,见图6A。故PC-3-siMaspin 2 细胞其自发性死亡率比PC-3-control 细胞低,在MG-132 作用后PC-3-control 细胞的死亡率呈时间依赖性上升,PC-3-siMaspin2 细胞的死亡率比PC-3-control 细胞显著降低。xCELLigence 系统连续观察细胞生长5 d,结果显示PC-3-control 细胞数随时间增长而减少,而PC-3-siMaspin2 细胞数无明显变化,见图6B。
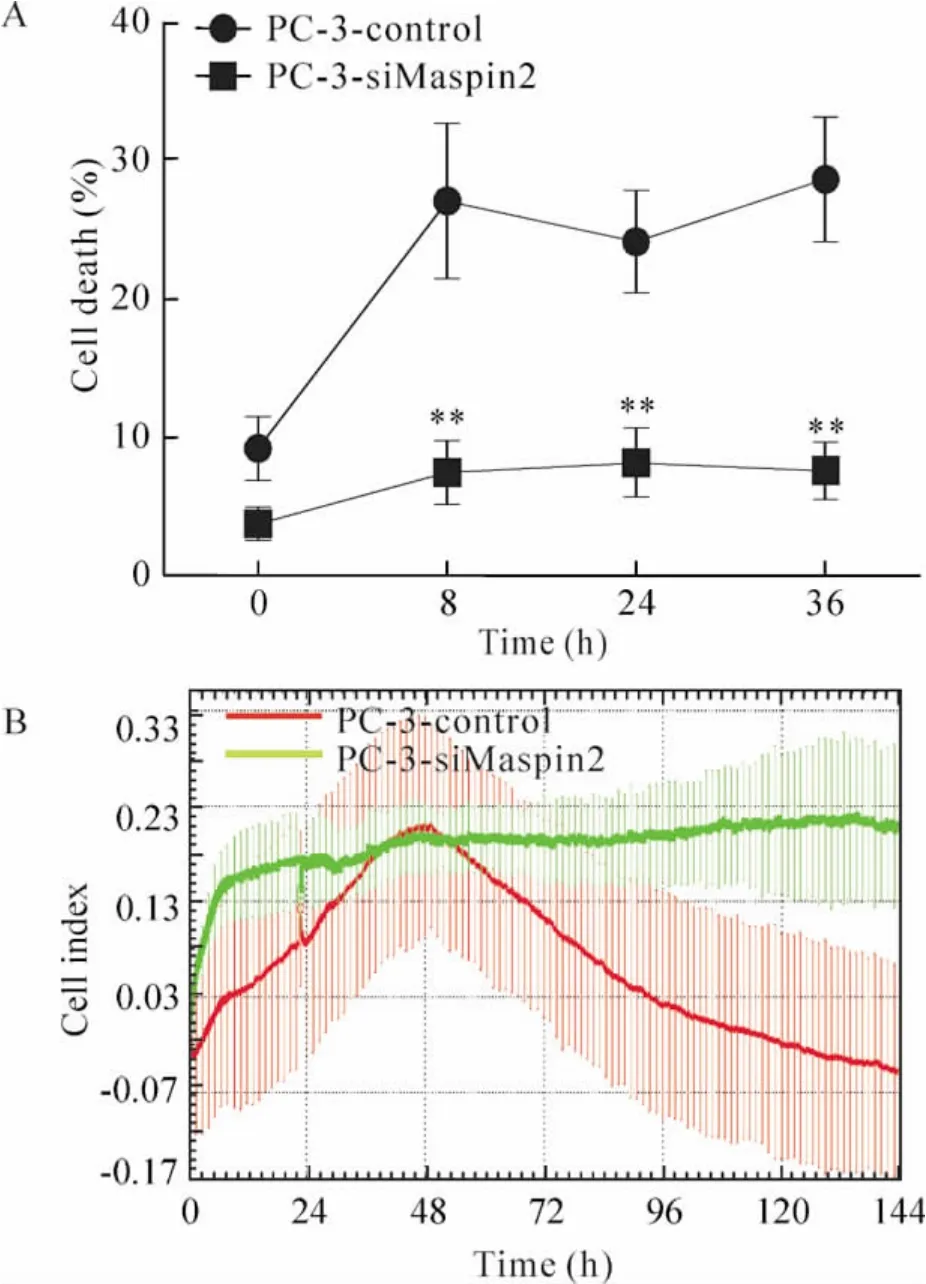
Figure 6. The effects of MG-132 treatment on the survival of PC-3-control and PC-3-siMaspin2 cells. A:PI-positive cells detected by flow cytometric analysis;B:the prolifertion of PC-3-control and PC-3-si-Maspin2 cells dynamically detected using xCELLigence system. ±s.n=3. **P <0.01 vs PC-3-control.图6 MG-132 对PC-3-control 和PC-3-siMaspin2 细胞的毒性作用
6 Maspin 基因沉默对蛋白酶体抑制剂诱导的NFκB 蛋白表达的影响
Western blotting 法检测结果显示,PC-3-control 细胞在MG-132(1 μmol/L)作用下RelA 的表达逐渐下调,而PC-3-siMaspin2 细胞中RelA 的表达无明显变化。PC-3-control 和PC-3-siMaspin2细胞中RelB 的表达均无显著变化,见图7。

Figure 7. The effects of MG-132 treatment on the expression of RelA and RelB in PC-3-control and PC-3-si-Maspin2 cells. ±s.n=3. **P <0.01 vs 0 h.图7 MG-132 对PC-3-control 和PC-3-siMaspin2 细胞RelA 和RelB 蛋白表达的影响
讨 论
Maspin 是1994 年用消减杂交(subtractive hybridization)技术对正常乳腺组织和乳腺癌组织进行比较时发现的一个肿瘤抑制基因。Maspin 基因编码产物为serpin 超家族中的一个独特成员,定位和或分泌于细胞浆及细胞核内[3]。最初的研究表明maspin 是一抑癌基因,可以通过促凋亡蛋白Bax 的介导而促进细胞凋亡从而抑制肿瘤细胞的生长[4]。Maspin 在不同肿瘤类型中表达意义不一,例如在乳腺癌、肝癌和肺鳞癌中maspin 的过表达预示预后良好[5]。原发性前列腺癌中maspin 的表达显著下降,并与病理分级、临床分期和淋巴结转移等临床表现相关,为预后较差的一个独立因素[6]。本研究中我们利用慢病毒包装系统建立了靶向沉默maspin 的PC-3 细胞系。利用xCELLigence 系统进行实时细胞观测,发现靶向沉默maspin 的PC-3 细胞相比对照细胞生长速度明显加快,倍增时间明显缩短。另外,maspin 表达的降低导致自发性凋亡率减少,与促凋亡基因(bax 和bim)mRNA 表达水平下调的同时抗凋亡基因(bcl-2 和A20)mRNA 表达水平上调具有相关性。以上结果均表明maspin 表达沉默赋予了雄激素非依赖型前列腺癌细胞株PC-3 更强的肿瘤性,即maspin 在PC-3 细胞中起到抑制细胞增殖和促进细胞凋亡的作用。
核因子κB(NF-κB)家族成员包括RelA/p65、p50、RelB、p52 和c-Rel,在炎症发生、细胞增殖与凋亡和肿瘤形成等多种生物学过程中发挥作用[7]。以RelA-p50 二聚体为代表的经典性NF-κB 的持续活化在前列腺癌发生发展中起重要作用并被认为是前列腺癌的共同特点[8]。代表着非经典通路活性的RelB 蛋白逐渐被证实与实体瘤的发生发展相关,包括乳腺癌、前列腺癌和胰腺癌等[9]。RelB 作用于前列腺的癌变过程并赋予了前列腺癌细胞的辐照耐受,严重影响前列腺癌的疗效[10-12]。最新研究认为RelB 在maspin 的表达调控中起重要作用,但RelA并不影响maspin 蛋白的表达[13-14]。蛋白酶体抑制剂通过抑制NF-κB 依赖性的基因转录,已经广泛应用于多发性骨髓瘤、套细胞淋巴瘤以及急性髓细胞白血病患者的治疗。PC-3 细胞中NF-κB 呈持续性活化。当PC-3 细胞受到蛋白酶体抑制剂MG-132 作用时,采用xCELLigence 系统实时监测并结合PI 染色法观察到细胞出现时间依赖性死亡并伴随RelA 蛋白表达的下调;而在maspin 沉默的PC-3细胞中并未出现明显的细胞死亡,但细胞生长受到抑制,同时RelA 蛋白表达未发生明显变化。RelB 蛋白的表达在对照和maspin 沉默的PC-3 细胞变化不显著。以上结果均说明maspin 表达沉默赋予了PC-3 细胞对蛋白酶体抑制剂的耐药性,并与RelA 的表达的变化直接相关。
[1] 崔小健,徐 勇,张淑敏. 前列腺癌中maspin 基因的表达与临床意义[J]. 国外医学:泌尿系统分册,2005,25(6):819-821.
[2] Goulet B,Kennette W,Ablack A,et al. Nuclear localization of maspin is essential for its inhibition of tumor growth and metastasis[J]. Lab Invest,2011,91(8):1181-1187.
[3] Zou Z,Anisowicz A,Hendrix MJ,et al. Maspin,a serpin with tumor-suppressing activity in human mammary epithelial cells[J]. Science,1994,263(5146):526-529.
[4] Liu J,Yin S,Reddy N,et al. Bax mediates the apoptosis-sensitizing effect of maspin[J]. Cancer Res,2004,64(5):1703-1711.
[5] Khalkhali-Ellis Z. Maspin:the new frontier[J]. Clin Cancer Res,2006,12(24):7279-7283.
[6] Zou Z,Zhang W,Young D,et al. Maspin expression profile in human prostate cancer (CaP)and in vitro induction of Maspin expression by androgen ablation[J]. Clin Cancer Res,2002,8(5):1172-1177.
[7] Vallabhapurapu S,Karin M. Regulation and function of NF-κB transcription factors in the immune system[J].Annu Rev Immunol,2009,27:693-733.
[8] Suh J,Rabson AB. NF-κB activation in human prostate cancer:important mediator or epiphenomenon[J]. J Cell Biochem,2004,91(1):100-117.
[9] Lessard L,Bégin LR,Gleave ME,et al. Nuclear localisation of nuclear factor-κB transcription factors in prostate cancer:an immunohistochemical study[J]. Br J Cancer ,2005,93(9):1019-1023.
[10] Xu Y,Josson S,Fang F,et al. RelB enhances prostate cancer growth:implications for the role of the nuclear factor-κB alternative pathway in tumorigenicity[J]. Cancer Res,2009,69(8):3267-3271.
[11] Holley AK,Xu Y,St Clair DK,et al. RelB regulates manganese superoxide dismutase gene and resistance to ionizing radiation of prostate cancer cells[J]. Ann N Y Acad Sci,2010,1201(1):129-136.
[12] Xu Y,Feng F,Sun Y,et al. RelB-dependent differential radiosensitization effect of STI571 on prostate cancer cells[J]. Mol Cancer Ther,2010,9(4):803-812.
[13] Guo F,Kang S,Zhou P,et al. Maspin expression is regulated by the non-canonical NF-κB subunit in androgen-insensitive prostate cancer cell lines[J]. Mol Immunol,2011,49(1-2):8-17.
[14] 国 风,郭凌川,沈雅颖,等. RelB 在蛋白酶体抑制剂诱导的maspin 表达中的作用研究[J]. 中国病理生理杂志,2011,27(7):1279-1285.
