siRNA-survivin 与GRIM-19 共表达质粒的构建及其对前列腺癌DU145 细胞生长的抑制作用*
2012-12-23沈维高赵丽晶盖晓东芦丽莉陈立松刘艳波赵雪俭
沈维高, 赵丽晶, 盖晓东, 芦丽莉, 葛 贺, 陈立松, 刘艳波△, 赵雪俭△
(1北华大学基础医学院病理生理学教研室,吉林 吉林132013;2吉林大学前列腺疾病防治研究中心,吉林 长春130021)
存活蛋白(survivin)属于凋亡抑制蛋白,其表达强弱与前列腺癌的发生、发展、转移及预后密切相关,可作为前列腺癌预后的分子标志物[1-2]。利用RNA 干扰技术抑制细胞内survivin 的过度表达可抑制肿瘤的生长,从而起到抗肿瘤作用[3]。GRIMs(genes associated with retinoid-interferon-induced mortality)属于维甲酸(retinoic acid,RA)- 干扰素(interferon,IFN)诱导 死亡 的相 关 基 因 家 族[4]。GRIM-19 是GRIMs 家族重要成员,在正常细胞内高表达,而在癌细胞内表达降低或缺失,而其高表达能抑制肿瘤细胞的增殖,并促进其凋亡[5-6]。RNA干扰并不能100%抑制目的基因的表达,于是我们尝试沉默survivin 同时高表达GRIM-19,而有关其对肿瘤的生长抑制作用国内外未见报导。本研究拟构建siRNA-survivin 和GRIM-19 共表达质粒,在降低细胞癌基因同时增强死亡调节因子的表达,从而增强抗肿瘤效应,为前列腺癌的基因治疗提供新的策略。
材 料 和 方 法
1 细胞培养
人前列腺癌DU145 细胞株由吉林大学前列腺防治研究中心馈赠。细胞用含有10% 胎牛血清的DMEM 培养液37 ℃、5% CO2的孵箱内培养,以0.25%的胰酶消化传代。
2 主要试剂
T4 DNA 连接酶购自Promega;Bgl Ⅱ、Nru Ⅰ、BamH Ⅰ、Hind Ⅲ和DNA 凝胶回收试剂盒购自大连宝生物工程公司;DNA purification system 为Promega产品;DNA DL2000 marker 和DL15000 marker 均为TaKaRa 产品。引物合成及测序由上海生工生物工程技术服务公司完成。溴化乙啶、琼脂糖、MTT 和DMSO 购自Sigma;DEPC 购自Merk;高保真Taq DNA聚合酶、dNTP、MMV 逆转录酶及质粒提取和纯化试剂盒购自Promega;RNA 酶及蛋白酶K 购于Ambion;Lipofectamine 2000 及Trizol 为Invitrogen 产品;胰酶、DMEM 培养基和胎牛血清为Hyclone 产品;其它常规化学试剂均为国产分析纯产品。
3 主要方法
3.1 真核表达质粒siRNA-survivin 和GRIM-19的构建 在本课题组前期工作的基础上,扩增已构建成功的pGCsilencer-U6-siRNA-survivin 质粒(简称pGCsi-sur)的U6 启动子及siRNA-survivin[7],在其上、下游分别引入BglⅡ和NruⅠ双酶切位点,与线性化的TA 载体连接,然后进行扩增,其上游引物为5'-GC (AGATCT)TGCTTCGCGATGTACGGGCC- 3';下游引物为5'-CG(TCGCGA)GGGCTATGAACTAATGACCC-3';PCR 扩增条件:94℃5 min,94 ℃30 s,55 ℃45 s,72 ℃45 s,72 ℃45 s,35 个循环;扩增片段长度为585 bp。PCR 产物电泳、回收、连接后测序。用限制性内切酶BglⅡ和NruⅠ双酶切pcDNA3.1-GRIM-19 质粒(由美国胡嘉娣老师馈赠),使其线性化,回收,将U6-siRNA-survivin 与线性化的pcDNA3.1-GRIM-19(简称pGRIM-19)连接,插入pcDNA3.1-GRIM-19 多克隆酶切位点内,共表达基因质粒构建成功,命名为pcDNA3.1-GRIM-19/siRNA-survivin (简 称pGRIM-19-si-survivin),将重组质粒转化到大肠杆菌,挑取单克隆后扩增,提取质粒并测序鉴定。共表达质粒的构建过程如图1 所示。
3.2 细胞转染 应用脂质体Lipofectamine 2000 将重组质粒psi-scramble、psi-survivin、pGRIM-19 和pGRIM-19-si-survivin 分别转染人前列腺癌细胞DU145 中,48 h 后提取RNA,检测survivin 和GRIM-19 mRNA 表达水平。

Figure 1. The construction process of pGRIM-19-si-survivin co-expression plasmid图1 表达质粒pGRIM-19-si-survivin 的构建
3.3 Survivin 和GRIM-19 mRNA 表达的检测 应用Trizol 试剂提取转染后各组细胞的总RNA,然后逆转录生成cDNA,应用人β-actin 引物进行扩增,鉴定模板质量。β-actin 的引物序列为:sense:5'-CTGGGACGACATGGAAAA-3',antisense:5'-AAGGAAGGCTGGAAGAGTGC-3',扩增片段长度为600 bp;survivin 引物序列:sense:5'-GAATTCATGGGTGCCCCGACGTTGCC-3',antisense:5'-AGATCTTTCTTCTTATTGTTGGTTTCC-3',扩增片段长度为415 bp;GRIM-19 引物序列:sense:5'-CTGGGACGACATGGAGA-AA-3',antisense:5'-AAGGAAGGCTGGAAGAGTGC-3',扩增片段长度为485 bp。所有引物均由上海生工生物技术有限公司合成。PCR 产物琼脂糖凝胶电泳后拍照,并进行定量分析。
3.4 细胞增殖活性检测 将实验分为5 组,即mock、psi-scramble、psi-survivin、pGRIM-19 和pGRIM-19-si-survivin,每组设5 个复孔。取对数生长期细胞进行转染,在培养细胞44 h 和68 h 后,各孔加入浓度为5 g/L MTT,常规方法检测各孔的吸光度(absorbance,A),按公式:抑制率(%)= (对照组A 值-实验组A 值)/对照组A 值×100%,计算各组抑制率。
4 统计学处理
采用SPSS 12.0 统计学软件进行分析,数据以均数±标准差(± s)表示,组间比较采用One-way ANOVA,以P <0.05 为差异有统计学意义。
结 果
1 pGRIM-19-si-survivin 共表达质粒的鉴定
根据前期的研究结果,以pGCsi-sur 为模板扩增U6-siRNA-survivin 片段,见图2,然后与TA 载体连接,用BglⅡ和NruⅠ双酶切,获得约585 bp 长度的片段,见图3,测序结果与设计完全吻合,U6-siRNA-survivin 测序结果见图4。
用BglⅡ和NruⅠ双酶切pGRIM 和pGRIM-19-si-survivin,其电泳图见图5、6,证明共表达质粒构建成功。

Figure 2. Electrophoretic identification of specific U6-siRNAsurvivin PCR product. M:DL2000 DNA marker.图2 U6-siRNA-survivin PCR 产物的电泳鉴定结果

Figure 3. Electrophoretic identification of pMD18-U6-survivin plasmid digested with BglⅡand NruⅠ. M:DL15000 DNA marker;Lane 1,3:pMD18-U6-survivin recombinant plasmid;Lane 2,4:pMD18-U6-survivin recombinant plasmid digested with BglⅡand NruⅠ;M2:DL2000 DNA marker.图3 pMD18-U6-survivin 质粒的双酶切鉴定结果
2 共表达质粒对DU145 细胞survivin 和GRIM-19 mRNA 表达影响
与mock 组比较,psi-scramble、psi-survivin、pGRIM-19 组及pGRIM-19-si-survivin 组survivin mRNA 表达水平分别为1.02 ± 0.09、0.55 ±0.05、0.62 ± 0.08 和0.35 ± 0.05,mock 与psi-scramble 无显著差别(P >0.05),而psi-survivin 和pGRIM-19 组survivin 的表达水平降低,共表达组降低更明显(P <0.05,P <0.01)。psi-survivin、pGRIM-19 和pGRIM-19-si-survivin 组GRIM-19 表达增强,分别为mock 组的1.93 ±0.14、2.57 ±0.20 和4.12 ±0.21(P <0.01),而psi-scramble 的表达水平为0.94 ±0.14,未有明显变化(P >0.05);与pGRIM-19 组比较,pGRIM-19-si-survivin 增强pGRIM-19 表达的作用更明显(P <0.05),显示出协同作用,见图7。

Figure 4. The nucleotide base sequence of U6-siRNA-survivin.图4 U6-siRNA-survivin 的测序结果
3 共表达质粒对DU145 细胞增殖抑制作用
DU145 转染重组质粒后培养48 h 及72 h,应用MTT 比色法观察各组细胞的增殖能力,以mock 组的生存率为100%,转染48 h 后,psi-scramble 组的生存率为94.0% ± 7.3%,两者之间无差异(P >0.05);而psi-survivin、pGRIM-19 和pGRIM-19-si-survivin 3 组细胞生存率分别为58.0% ±7.2%、62.1% ±6.1%和50.2% ±4.8%,与mock 组比较差异显著(P <0.05),pGRIM-19-si-survivin 组与psi-survivin 和pGRIM-19 组比较差异不明显(P >0.05);转染72 h 后psi-scramble 组的增殖率为90.1% ±5.5%,psi-survivin、pGRIM-19 和pGRIM-19-si-survivin 3 组分别为43.4% ± 4.3%、51.3% ±6.7%和26.8% ±7.1%,与两阴性对照组相比,差异明显(P <0.05,P <0.01);与psi-survivin 和pGRIM-19 组比较,pGRIM-19-si-survivin 抑制作用明显增强(P <0.05),显示出协同抑制效应,见图8。

Figure 5. Electrophoretic identification of pGRIM-19 plasmid digested with BglⅡand NruⅠ. M1:DL15000 DNA marker;Lane 1:pGRIM-19 recombinant plasmid;Lane 2:pGRIM-19 recombinant plasmid digested with BglⅡand NruⅠ;M2:DL2000 DNA marker.图5 pGRIM-19 双酶切鉴定结果

Figure 6. Electrophoretic identification of pGRIM-19-si-survivin recombinant plasmid digested with BglⅡand NruⅠ.M1:DL15000 DNA marker;Lane 1:pGRIM-19-si-survivin recombinant plasmid;Lane 2:pGRIM-19-si-survivin recombinant plasmid digested with BglⅡand NruⅠ;M2:DL2000 DNA marker.图6 pGRIM-19-si-survivin 重组质粒双酶切鉴定结果
讨 论
凋亡抑制蛋白survivin 可特异性表达在人和鼠的胚胎发育组织,也可表达于人类多种肿瘤组织,在成人的正常组织中几乎不表达[8]。我们前期研究表明survivin 在前列腺癌组织高表达,其异常激活导致细胞凋亡减少,进而参与了前列腺癌的发生和发展[9]。而且,针对survivin 的小干扰RNA,体内外均可下调前列腺癌survivin 基因表达并具有抑瘤效应[10]。但在哺乳动物细胞中,RNAi 并不能完全阻断基因表达,尤其是异常高表达的基因。RNAi 只能降解与其序列同源的mRNA,对已经表达的蛋白,应用RNAi 方式是无法清除的。为了提高抗肿瘤作用,我们选择联合基因治疗手段,即沉默survivin 同时增加另一种抗肿瘤基因(GRIM-19)的表达。
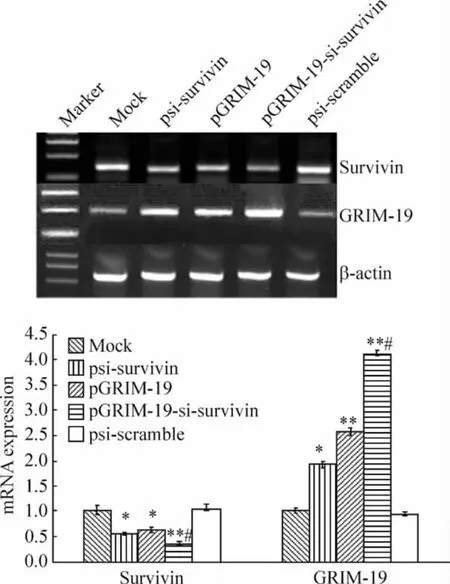
Figure 7. RT-PCR analysis of survivin and GRIM-19 mRNA expression in DU145 cells transfected with recombinant plasmids. ±s. n =3. * P <0.05,**P <0.01 vs mock or psi-scramble;#P <0.05 vs psi-survivin or pGRIM-19.图7 pGRIM-19-si-survivin 重组质粒转染DU145 细胞后survivin 和GRIM-19 基因表达情况

Figure 8. Growth inhibition of DU145 cells transfected with different plasmids. ± s. n = 3. * P <0.05,**P <0.01 vs mock or psi-scramble;#P <0.05 vs psi-survivin or pGRIM-19.图8 pGRIM-19-si-survivin 重组 质粒对前列腺癌DU145 细胞增殖抑制作用
GRIM-19 是由IFN-β 联合RA 诱导表达的死亡调节因子,在大多数正常组织中高表达,但在多数肿瘤组织表达降低或缺失。刘艳波等[10]研究发现:前列腺癌组织及前列腺癌细胞GRIM-19 表达为阴性,这种差异性使得GRIM-19 作为靶基因进行治疗成为可能。GRIM-19 高表达后可明显抑制STAT3 的表达,而抑制STAT3 的信号转导,可影响其对survivin 的表达调控,进而抑制肿瘤细胞的增殖过程[11]。根据前期工作,在增强GRIM-19 表达的同时抑制survivin 表达,有望成为肿瘤基因治疗的新策略。本研究应用基因重组技术成功构建了真核共表达质粒pGRIM-19-si-survivin,应用RT-PCR 技术检测发现:该质粒在下调survivin 表达同时增强了GRIM-19 的表达。应用MTT 法检测了其对细胞增殖作用的影响,发现该质粒可协同性地抑制前列腺癌DU145 细胞的增殖,并呈现时间依赖关系。上述结果为研究该质粒的作用机制奠定了基础,为前列腺癌的基因治疗指明了方向。
[1] Koike H,Sekine Y,Kamiya M,et al. Gene expression of survivin and its spliced isoforms associated with proliferation and aggressive phenotypes of prostate cancer[J]. Urology,2008,72(6):1229-1233.
[2] Zhang M,Ho A,Hammond EH,et al. Prognostic value of survivin in locally advanced prostate cancer:study based on RTOG 8610[J]. Int J Radiat Oncol Biol Phys,2009,73(4):1033-1042.
[3] Becker AL,Orlotti NI,Folini M,et al. Redox-active polymer microcapsules for the delivery of a survivin-specific siRNA in prostate cancer cells[J]. ACS Nano,2011,5(2):1335-1344.
[4] Nallar SC,Kalakonda S,Sun P,et al. Identification of a structural motif in the tumor-suppressive protein GRIM-19 required for its antitumor activity[J]. Am J Pathol,2010,177(2):896-907.
[5] Zhang L,Gao L,Li Y,et al. Effects of plasmid-based Stat3-specific short hairpin RNA and GRIM-19 on PC-3M tumor cell growth[J]. Clin Cancer Res,2008,14(2):559-568.
[6] 刘艳波,葛 贺,盖晓东,等. GRIM-19 基因对前列腺癌DU145 细胞的促凋亡作用[J].北华大学学报:自然科学版,2012,13(1):58-61.
[7] 刘艳波,赵丽娟,赵丽晶,等. Survivin-siRNA 对前列腺癌PC-3M 细胞增殖抑制作用[J].中国病理生理杂志,2008,24(10):1873-1876.
[8] Jeon Y,Jeong SH,Biswas D,et al. Cleavage pattern and survivin expression in porcine embryos by somatic cell nuclear transfer[J]. Theriogenology,2011,76(7):1187-1196.
[9] 刘艳波,沈维高,葛 贺,等. Survivin 和GRIM-19 在前列腺癌组织中的表达[J]. 中华男科学杂志,2011,17(1):21-26.
[10]刘艳波,沈维高,芦丽莉,等. Survivin-siRNA 对前列腺癌DU145 细胞的促凋亡作用[J]. 中国病理生理杂志,2010,26(8):1474-1478.
[11]Okamoto T,Inozume T,Mitsui H,et al. Overexpression of GRIM-19 in cancer cells suppresses STAT3-mediated signal transduction and cancer growth[J]. Mol Cancer Ther,2010,9(8):2333-2343.
