OSAS大鼠模型的实验研究*
2012-12-03宋凯英史艳红
宋凯英,徐 平,史艳红
(1.遵义医学院附属医院神经内科,贵州遵义 563099;2.河南省扶沟县人民医院神经内科,河南 扶沟461300)
阻塞性睡眠呼吸暂停综合征是指在睡眠时由 于上气道的狭窄或阻塞所引起的反复的呼吸暂停或低通气,睡眠呼吸暂停指数大于或等于5次/h,出现慢性间歇性低氧。OSAS是临床常见病,而且具有潜在危险性,可造成全身多系统、多器官功能的损害。Punjabi NM[1]对OSAS成人进行流行病学调查显示OSAS患病率3% ~7%,Young等[2]流行病学研究证实男女发病率之比约为2.4∶1,男女发病率分别高达9% ~15%和4% ~9%,患病率随年龄递增。20世纪80年代以来OSAS受到了广泛的关注,临床和基础研究在全世界范围内取得了迅速发展,但其发生发展及引起相关并发症的具体机制方面至今仍未彻底阐明。本实验拟通过于大鼠双侧舌腭弓、咽腭弓及舌根处注射透明质酸钠凝胶建立上呼吸道阻塞模拟阻塞性睡眠呼吸暂停综合征模型,同时观察脑组织的损伤及脑血管病变情况,为本课题深入进行OSAS与缺血性脑卒中的研究提供一个稳定、可行的动物模型。
1 材料
1.1 实验动物 清洁级Wistar大鼠40只,重200~250g,雌雄分笼饲养,由中国人民解放军第三军医大学大坪医院动物中心提供[许可证号SCXK(渝)2007-0005]。
1.2 实验试剂 医用透明质酸钠凝胶(上海其胜生物制剂公司,批号110552-01);戊巴比妥钠(北京索莱宝科技有限公司,批号CAS#57-33-0)。
1.3 实验仪器 鼻镜(广东新星医疗器械厂);插件式多参数神经监护仪(NTS-3000 B,上海诺诚医疗器械有限公司);电子显微镜(DM 4000B,德国Leica公司);Leica Qwin图像分析系统(德国Leica公司);石蜡切片机(RM-2235,德国Leica公司)。
2 方法
Wistar大鼠随机抽签法分为正常对照组(10只)、OSAS组(30只)。适应性喂养1周开始造模。
2.1 阻塞性睡眠呼吸暂停综合征组模型 以2%的戊巴比妥钠溶液50 mg/kg腹腔内注射麻醉大鼠后,取仰卧位,鼻镜做开口器暴露口咽腔,于双侧舌腭弓、咽腭弓及舌根处注射透明质酸钠凝胶至大鼠出现呼吸暂停,将舌体牵拉于口外,防止其窒息死亡,直至大鼠完全清醒。①出现伴有胸腹反常运动的呼吸暂停,即为阻塞性呼吸暂停②监测脑电、口鼻气流、血氧饱和度:无菌针灸针作针电极,取大鼠双目中上方约0.5 cm、两侧乳突分别作 FP1、FP2、A1、A2 脑电电极的位置(FP1、FP2代表记录电极,A1、A2代表参考电极),口鼻气流热敏传感器贴于大鼠双侧前鼻孔监测口鼻气流,将鼠尾穿过血氧探头监测外周血氧饱和度。分别于注射透明质酸钠前1 wk、注射后4 wk,以2%的戊巴比妥钠溶液25 mg/kg做腹腔内注射造成浅麻醉状态模拟自然睡眠状态(即对强刺激有反应,对浅刺激无反应),监测2 h,大鼠清醒时脑电波为高频率,低幅度;睡眠时脑电波为低频率,高幅度。人工计数2 h内每只大鼠的呼吸暂停次数,计算呼吸暂停指数。
2.2 实验动物取材 13 wk后,以2%的戊巴比妥钠溶液50 mg/kg作腹腔内注射麻醉,断头取脑,取皮质海马置多聚甲醛中固定24 h,常规脱水、石蜡包埋、切片,切片固定于载玻片上,苏木素/伊红染色(hematoxylin and Eosin stain,HE stain),显微镜下观察大鼠皮质及海马区脑组织及脑血管。
2.3 统计学方法 应用SPSS 17.0软件分析,计量资料正态性检验后以x±s表示,采用 t检验,P<0.05为差异有统计学意义。
3 结果
3.1 OSAS模型 OSAS大鼠模型建立后,观察中发现睡眠打鼾、口唇稍发绀、呼吸暂停伴胸腹式反常呼吸运动,呼吸暂停后数秒伴血氧饱和度的减低。清醒期一般情况无异常。睡眠呼吸监测中发现大鼠口鼻气流的呼吸波形消失,同时人工观察见大鼠胸腹式反常呼吸运动,造模前后平均血氧饱和度(mean oxygen saturation,MSaO2)、最低血氧饱和度(lowest oxygen saturation,LSaO2)、呼吸暂停指数(apnea index,AI)比较有统计学意义,可判定为阻塞性呼吸暂停综合征。造模及睡眠呼吸监测见图1A -1D。经t检验,OSAS大鼠 MSaO2、LSaO2较造模前降低,AI较造模前增高,比较有差异(P<0.05)(见表1)。
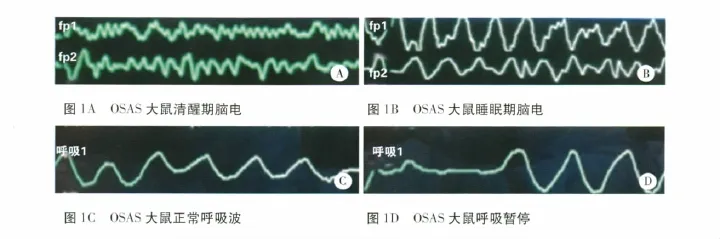
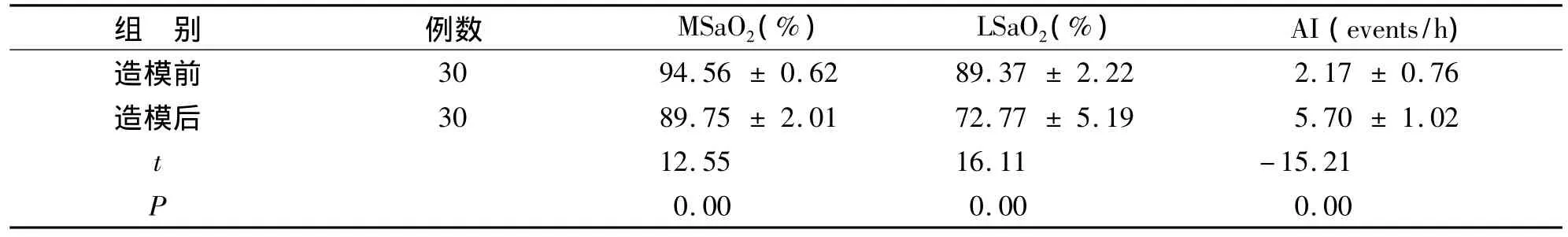
表1 OSAS大鼠造模前后 MSaO2、LSaO2、AI比较
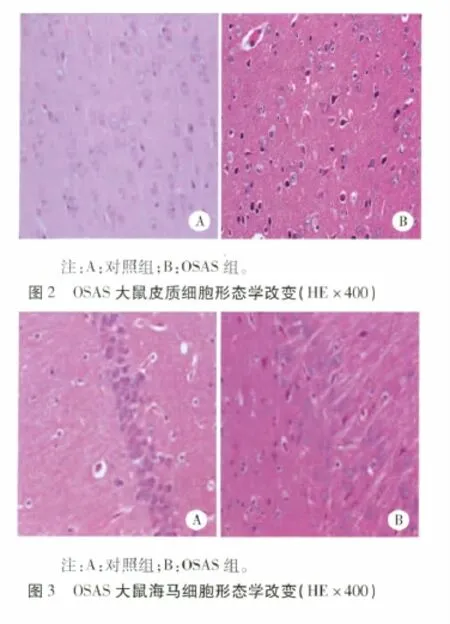
3.2 皮质海马HE染色 对照组:神经元排列整齐紧密,层次分明,细胞数量较多,胞质均质红染,核大而圆,核仁清晰。OSAS组:神经元排列紊乱,细胞减少,部分胞浆空泡样变,胞质嗜酸性增强,核染色质不均匀,核周间隙增大,核固缩深染,呈紫蓝色梭形或三角形,脑小血管数量有所增加。(见图2~图3)。
4 讨论
以往国内外学者有采用低压氧舱或常压低氧舱,造成全身低氧动物模型,虽然接近人类OSAS病理生理特点,但无法模拟呼吸暂停时的咽腔负压情况;也有国外学者采用气管切开造口并设置气管内活瓣,计算机自动开关活瓣,但其阻塞部位在气管而非上气道。上气道狭窄是OSAS发病机制中最重要的因素,软腭后区气道是呼吸暂停的始发部位和主要阻塞部位。故本实验借鉴柳忠禄等[3]的方法通过在Wistar大鼠口咽部和舌根处注射透明质酸钠凝胶人为造成上气道狭窄,导致睡眠时的呼吸暂停,以模拟人类OSAS发病的解剖学机制。
为了减少对动物的损伤,本实验未采用埋置电极的方法,试用针灸针作为针电极,但因为浅麻醉情况下模拟睡眠,针刺时痛刺激使大鼠易觉醒并反抗,导致电极部分脱落,干扰大,并且因接触面积较小导电性能略差,脑电图的图像不很稳定。我们设想如果现在使用的盘状电极可进一步改进缩小,用脱毛液脱去动物毛发,将电极紧贴皮肤后胶布固定,像人类做动态脑电图检查一样描记脑电波形,对大鼠既无手术损伤,又能达到电极与皮肤的充分接触。当然这种改进需监护仪厂家的技术支持。
人类呼吸停止10 s判定为呼吸暂停。Carley等[4]采用大鼠呼吸停止≥2.5 s作为呼吸暂停的判断标准。大鼠的呼吸频率为66~114次/min,2.5秒的呼吸暂停发生了2次以上呼吸周期的缺失。由于实验设备限制,大鼠不能使用胸腹带判断胸腹式呼吸的存在与否,实验中监测到有一定频率及幅度的正弦波为大鼠的正常呼吸波,当正弦波消失,变成一条直线时,即为呼吸停止,同时人工观察见胸腹式反常呼吸运动,判断为阻塞性呼吸暂停。当呼吸恢复,首先出现幅度较大的正弦波,规律的呼吸波、直线波再现,如此反复。注射前动物出现阻塞性呼吸暂停,可能与大鼠口腔深,舌体较大,舌体后坠,加之戊巴比妥钠麻醉后咽腔肌肉松弛,软组织塌陷有关。
实验中观察到OSAS大鼠睡眠打鼾(类似一种喉鸣音)、口唇稍发绀、呼吸暂停伴胸腹式反常呼吸运动,呼吸暂停后数秒伴血氧饱和度的减低。目前国内外实验中关于大鼠的血氧检测不多见,我们通过浅麻醉状态下鼠尾静脉末梢血氧监测发现呼吸暂停确实伴有血氧减低,更进一步阐明了OSAS模型的可行性,造模前后的平均血氧饱和度、最低血氧饱和度及呼吸暂停指数差异性显著。说明通过咽腔注射透明质酸钠凝胶建立的OSAS模型成功。
有学者认为间歇低氧类似于缺血/再灌注,可造成神经元丢失,导致相应的脑功能障碍。杨宇等[5]发现慢性间断性缺氧大鼠学习记忆能力下降,电镜可见海马CA1区神经元超微结构变化,突触小泡减少,膜结构模糊不清,毛细血管内皮肿胀,表明慢性间断性缺氧可引起神经元细胞超微结构损伤。Tsukamoto K等[6]研究发现,呼吸暂停时增加缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的转录活性,引起血管内皮生长因子(Vascular endothelial growth factor,VEGF)表达,导致脑缺血后血管的再生。但VEGF过表达却导致脑血管通透性增加,加重脑缺血缺氧,发生血管源性脑水肿[7]。Lavie等证实慢性低氧诱导脑小动脉VEGF mRNA表达增强,VEGF合成增加,血管结构重构,平滑肌细胞增殖,小动脉壁增厚,管腔狭窄[8]。
鉴于大脑皮质及海马对缺氧比较敏感,是脑内负责记忆、信息处理及信号传递的重要部位,本实验重点观察皮质及海马的结构改变。研究中发现在OSAS大鼠大脑皮质及海马中,存在神经元的减少,排列紊乱,细胞空泡样变,细胞核固缩,细胞坏死,伴小血管不同程度增生等表现,可能是OSAS前期脑功能减退、颅内压增高、脑动脉硬化至脑血管闭塞的一个演变过程,为深入进行OSAS与缺血性脑卒中的研究提供一个可行的动物模型。本文采用HE染色只能对细胞形态作出初步评价,但坏死细胞个数、血管增生程度及数量改变尚不能明确,后续实验可采用更先进的手段,如共聚焦显微镜、PCR技术、免疫组化检测等,对细胞功能状态进行评价,进一步完善对OSAS模型的研究。
[1]Punjabi N M.The epidemiology of adult obstructive sleep apnea[J].Proc Am Thorac Soc,2008,5(2):136 -143.
[2]Young T,Peppard P E,Gottlieb DJ.Epidemiology of obstructive sleep apnea:a population health perspective[J].Am J Respir Crit Care Med,2002,165(9):1217-1239.
[3]柳忠禄,王岩,李延忠.大鼠阻塞性睡眠呼吸暂停综合征动物模型的建立[J].山东大学耳鼻喉眼学报,2009,23(2):31-33.
[4]Carley D W,Trbovic S,Radulovacki M.Sleep apnea in normal and REM sleep-deprived normotensive Wistar-Kyoto and spontaneously hypertensive(SHR)rat[J].Physiol Be hav,1996,59(4):827-831.
[5]杨宇,谭胜玉,张新民,等.慢性间歇性缺氧对认知功能及海马CA1区IGF-1表达的影响[J].中国临床心理学杂志,2007,15(1):85-87.
[6]Tsukamoto K,Kinoshita M,Kojima K,et al.Synergically increased expression of CD36,CLA -1 and CD86,but not of SR-A and LOX-1,with the progression to foam cells from macrophages [J].J Atheroscler Thromb,2002,9(1):57-64.
[7]Josko J,Kenfel K.The role of vascular endothelial growth factor in cerebral oedema formation[J].Folia Neuropathol,2003,41(3):161 -166.
[8]Lavie L.Obstructive sleep apnoea syndrome-an oxidative stress disorder[J].Sleep Med Rev,2003,7(1):35 -51.
