联合检测胸腹水sHLA-G、MMP-3、LDH对良恶性胸腹水的诊断价值
2021-04-06崔爱丽郭改玲于莹莹
崔爱丽,郭改玲,于莹莹
(漯河医学高等专科学校第二附属医院检验科,河南 漯河 462300)
胸腹水是重症感染、肿瘤、器官功能衰竭等疾病常见的临床症状。临床上又根据胸腹水性质分为良性和恶性胸腹水。恶性胸腹水是恶性肿瘤引起的胸腔、腹腔脏壁层胸腹膜因弥漫性病变而致胸腹腔液体异常聚集,约占所有胸腹水的10%~30%,患者预后极差[1]。胸腹水脱落细胞学检查是鉴别良、恶性胸腹水的金标准,但灵敏度低,易导致漏诊。已有研究[2-3]显示,人可溶性白细胞抗原G(soluble human leukocyte antigen-G,sHLA-G),基质金属蛋白酶3(matrix metalloproteinases3,MMP-3)参与恶性肿瘤发生、发展的病理生理过程,可能作为鉴别良、恶性肿瘤的潜在生物学标志物。本研究同时检测了良、恶性胸腹水中sHLA-G、MMP-3以及乳酸脱氢酶(lactate dehydrogenase,LDH)表达水平,探讨对良、恶性胸腹水的鉴别诊断价值。
1 资料与方法
1.1 一般资料 选取2018年9月至2020年9月本院住院的82例胸腹水患者为研究对象,均经临床明确诊断。根据最终诊断将患者分为良性胸腹水组(n=49)和恶性胸腹水组(n=33)。良性胸腹水组,男性29例,女性20例;年龄36~79岁,平均(59.64±8.07)岁;原发疾病:重症肺炎12例、心功能衰竭10例、肺结核9例、肝硬化18例。恶性胸腹水组,男性20例,女性13例;年龄34~81岁,平均(60.27±7.55)岁;原发疾病:肺癌7例、原发性肝癌6例、结肠癌11例、胃癌6例、宫颈癌2例、卵巢癌1例。本研究经医院伦理委员会批准。
1.2 选取标准
1.2.1 纳入标准 ⑴恶性胸腹水患者经手术或内镜病理证实,或胸腹水细胞病理学阳性;⑵良性胸腹水患者均经病史、临床体征、影像学检查及实验室检查确诊;⑶年龄不低于18岁;⑷研究取得患者知情同意。
1.2.2 排除标准 ⑴具有胸腹腔穿刺禁忌证;⑵胸腹水诊断不明确;⑶同时存在良恶性胸腹水;⑷临床资料不完整者。
1.3 方法 采集胸水或腹水,留取10ml送检验科检测肿瘤标志物包括癌胚抗原(CEA)、癌抗原125(CA125),10ml送病理科行细胞病理学检查,其余20ml离心后冻存于-80℃冰箱待检测sHLA-G、MMP-3及LDH水平。CEA、CA125选用COBAS 6000型全自动电化学发光仪(德国罗氏公司)及配套试剂检测。sHLA-G测定采用酶联免疫吸附法(ELISA)测定,sHLA-G ELISA试剂盒购自上海联硕生物科技有限公司;MMP-3含量测定采用胶乳增强免疫比浊法,试剂盒购自上海华臣生物试剂有限公司;LDH采用比色法测定,试剂盒购自罗氏公司;各指标检测均严格按操作说明书要求进行。
1.4 统计学方法 应用SPSS 20.0统计软件分析数据,计量资料以(±s)表示,采用t检验比较;计数资料使用例数表示,采取χ2检验;相关性分析采用Pearson相关性分析法;应用受试者工作特征(ROC)曲线及曲线下面积(AUC)评价各指标的鉴别诊断效能,AUC比较使用Z检验。所有检验均采取双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组胸腹水中sHLA-G、MMP-3及LDH水平比较 恶性胸腹水组患者的胸腹水sHLA-G、MMP-3及LDH水平均显著高于良性胸腹水组(P<0.05)。见表1。
表1 两组胸腹水中sHLA-G、MMP-3及LDH水平比较(±s)
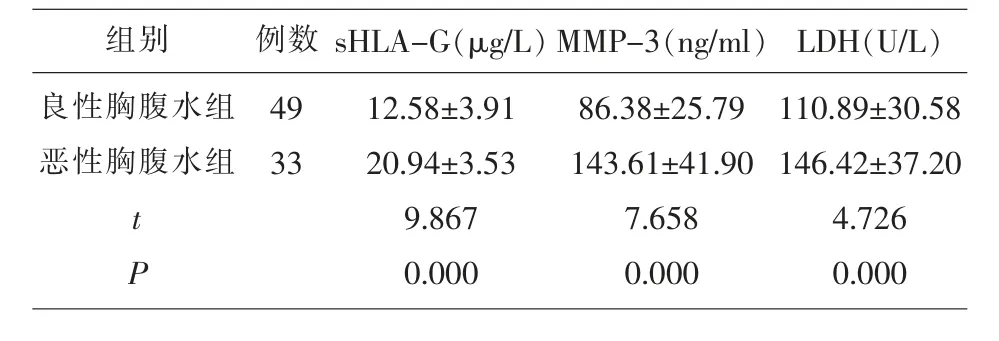
表1 两组胸腹水中sHLA-G、MMP-3及LDH水平比较(±s)
?
2.2 两组胸腹水中肿瘤标志物CEA、CA125水平比较 恶性胸腹水组患者的胸腹水CEA水平显著高于良性胸腹水组(P<0.05),两组胸腹水CA125水平比较无显著差异(P>0.05)。见表2。
表2 两组胸腹水中肿瘤标志物CEA、CA125水平比较(±s)
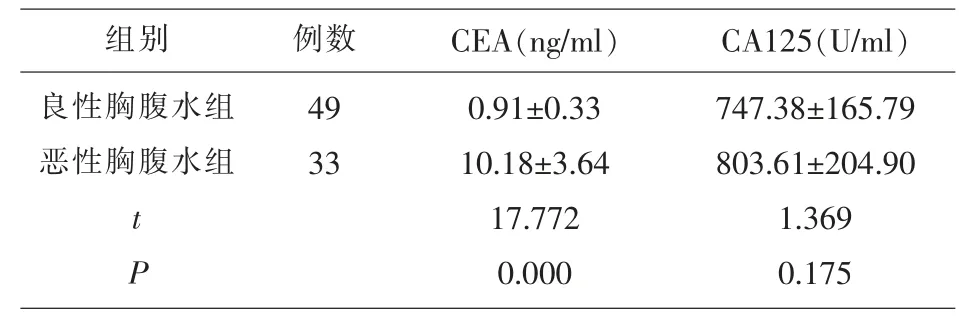
表2 两组胸腹水中肿瘤标志物CEA、CA125水平比较(±s)
?
2.3 恶性胸腹水中sHLA-G、MMP-3、LDH与CEA、CA125的相关性分析Pearson相关性分析显示,恶性胸腹水患者的胸腹水sHLA-G、MMP-3水平与CEA水平呈显著正相关(均P<0.05)。见表3。
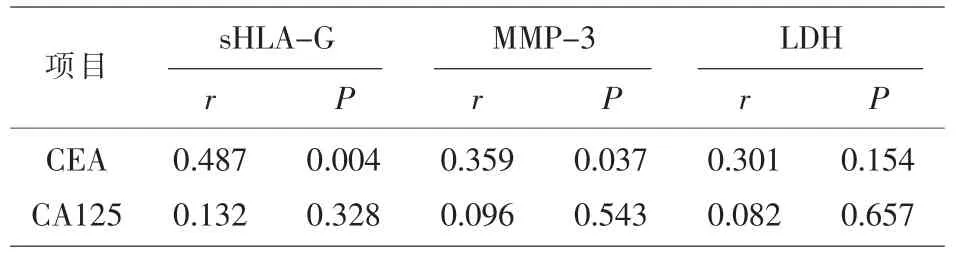
表3 恶性胸腹水sHLA-G、MMP-3、LDH与CEA、CA125的相关性分析
2.4 胸腹水sHLA-G、MMP-3、LDH联合检测对良、恶性胸腹水的鉴别诊断价值 绘制胸腹水sHLA-G、MMP-3及LDH鉴别良、恶性胸腹水的ROC曲线,见图1。取约登指数最大时对应的各指标值为最佳临界值,sHLA-G、MMP-3及LDH鉴别诊断良、恶性胸腹水的最佳临界值分别为17.04 μg/L、117.82 ng/ml、130.10U/L;三者联合检测鉴别良、恶性胸腹水的AUC分别大于LDH(Z=3.481,P=0.000)、MMP-3(Z=2.822,P=0.005)单独鉴别诊断良、恶性胸腹水的AUC,与sHLA-G单独鉴别诊断良、恶性胸腹水的AUC比较无显著差异(Z=1.804,P=0.071);三者联合检测鉴别良、恶胸腹水的灵敏度为90.91%(30/33),高于腹水细胞学检查的灵敏度57.58%(19/33)(χ2=9.587,P=0.002),见表4。
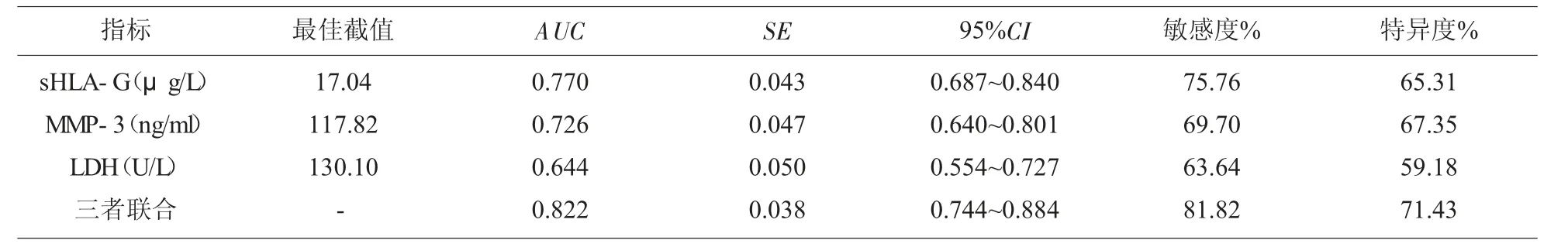
表4 胸腹水sHLA-G、MMP-3、LDH鉴别良、恶性胸腹水的效能比较
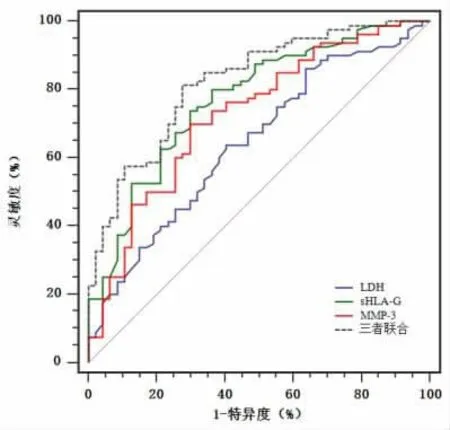
图1 sHLA-G、MMP-3、LDH及三者联合鉴别良、恶性胸腹水的ROC曲线
3 讨论
胸腹水细胞病理学检查是鉴别诊断良、恶性胸腹水的金标准[4]。然而,临床诊断中细胞病理学检查灵敏度低,且易受其他因素干扰,如胸腹水中存在大量红细胞时可降低细胞学阳性检出率,易导致临床漏诊。胸腹腔脏器的原发性肿瘤或者转移性肿瘤是引起恶性胸腹水的主要原因。本研究检测了胸腹水中肿瘤标志物CA125、CEA含量,结果显示CEA在良、恶性胸腹水组间存在显著差异,而CA125在两组间未见统计学差异。通过进一步的相关性分析发现恶性胸腹水患者的胸腹水sHLA-G、MMP-3水平与CEA水平呈显著正相关。以往研究[5]提示CEA有助于良恶性胸腹水的临床鉴别。以上数据提示sHLA-G、MMP-3可能是鉴别良、恶性胸腹水的潜在指标。
sHLA-G是一种重要的免疫调节分子,有研究[6]指出sHLA-G可通过抑制CD4+T细胞增殖和NK细胞功能,诱导CD8+T细胞凋亡的机制参与肿瘤细胞的免疫逃逸。已有研究[2]显示,sHLA-G在恶性肿瘤的表达水平明显上调,参与其发生、发展及转归。研究[7]指出sHLA-G可作为鉴别诊断甲状腺良恶性肿瘤的辅助指标,ROC曲线下面积达0.790。本研究通过ELISA法检测发现,恶性胸腹水组患者的胸腹水sHLA-G水平显著高于良性胸腹水组,提示sHLA-G可能是鉴别良、恶性胸腹水的潜在诊断指标。
基质金属蛋白酶是一组依赖于锌离子、具有降解细胞外基质活性的内肽酶家族,已被大量报道证实在肿瘤生长、侵袭及转移过程中发挥关键作用[8]。MMP3是基质金属蛋白酶家族中的重要成员,能降解基底膜和细胞外基质[9-10]。MMP3在结肠癌、口腔鳞癌、非小细胞肺癌等恶性肿瘤表达增加,并与肿瘤的浸润和转移等有着密切联系[11]。恶性肿瘤在形成恶性胸腹水的过程中,基质金属蛋白酶活性明显增加,细胞外基质降解,使细胞基底膜的完整性受到破坏,从而使恶性肿瘤发生侵袭和转移[12]。本研究发现,恶性胸腹水组患者的胸腹水MMP3水平显著高于良性胸腹水组,提示MMP3是鉴别良、恶性胸腹水的潜在诊断指标。
LDH是一种糖酵解酶,几乎存在于人体所有的组织中。在恶性胸腹水患者,组织细胞坏死增加并脱落进入胸腹水中引起LDH水平升高,此外肿瘤细胞自身分泌的LDH导致癌性胸腹水中的LDH水平进一步升高。研究[13]证实,恶性胸腹水中肿瘤细胞渗出大量的LDH,与肿瘤组织的代谢活性和增殖力成正相关。Verma等研究[14]检测了肺癌胸水中LDH水平,结果显示其含量明显升高,并可作为预后评估指标。本研究发现,恶性胸腹水组患者的胸腹水LDH水平显著高于良性胸腹水组,提示LDH是鉴别良、恶性胸腹水的潜在诊断指标。通过进一步的ROC曲线分析,笔者发现胸腹水sHLA-G、MMP-3及LDH对良、恶性胸腹水均有一定的鉴别诊断价值,其中sHLA-G和MMP-3鉴别诊断的AUC均大于0.7。良、恶性胸腹水的早期鉴别直接关系到患者的治疗及预后评价,降低漏诊率是临床诊断时的重中之重,将三者联合用于鉴别诊断时,AUC达0.822,鉴别诊断效能明显提高,有助于对良、恶性胸腹水进行早期鉴别诊断。
综上所述,恶性胸腹水患者胸腹水中sHLAG、MMP-3及LDH水平明显升高,联合检测此三项指标有助于鉴别诊断良、恶性胸腹水。
