大孔树脂纯化马兰总黄酮树脂吸附特性及工艺的研究
2012-11-28田徽阮期平赖恩阳欧平李强
田徽,阮期平,赖恩阳,欧平,李强
1(绵阳师范学院分子生物学与生物制药重点实验室,四川绵阳,621000)2(成都中医药大学药学院中药教研室,四川 成都,611137)3(绵阳羌山源中药科技有限公司,四川绵阳,621000)
大孔树脂纯化马兰总黄酮树脂吸附特性及工艺的研究
田徽1,2,阮期平1,赖恩阳1,欧平3,李强3
1(绵阳师范学院分子生物学与生物制药重点实验室,四川绵阳,621000)2(成都中医药大学药学院中药教研室,四川 成都,611137)3(绵阳羌山源中药科技有限公司,四川绵阳,621000)
研究大孔树脂纯化马兰总黄酮树脂吸附特性及工艺条件及参数。文中分别进行静态吸附、静态解吸、静态吸附动力学过程(Lagergren准一级动力学方程)、静态吸附等温曲线(Langmuir和Freundich等温吸附方程)、动态吸附实验,从7种大孔树脂中筛选用于马兰总黄酮分离的最佳树脂,并系统研究最佳大孔树脂分离纯化的吸附性能和最优洗脱参数。结果表明:D101型大孔树脂为分离马兰黄酮类组分最佳树脂,其分离的最佳工艺为总黄酮浓度为9.36 mg/mL的样液,以3 BV/h的流速,控制pH值为4~5上柱,用75%乙醇以3 BV/h用量进行洗脱,可获得样品总黄酮纯度达70%以上。
马兰,黄酮类组分,大孔树脂
马兰(Kalimeris indica(L.)Sch.Bip)为常见药食两用蔬菜,又名马兰头、路边菊、泥鳅串等。特别在我国北方及江浙一带,是早春市场的珍稀蔬菜,市场需求量大。马兰在我国应用历史悠久[1-4]。课题组前期研究也证明了马兰具有显著的健胃作用,而且通过进一步研究发现马兰黄酮类组分为其健胃作用的物质基础之一[5]。为了开发马兰黄酮类组分,为其工业化生产奠定基础,本实验采用大孔树脂吸附技术分离纯化马兰黄酮类组分,现将有关工艺研究报道如下。
1 材料
UltroSPec 3300 pro紫外可见分光光度计(美国安玛西亚公司);Buchi旋转蒸发仪(瑞士Buchi公司);NKA-9、DM-130、D-101、DM-301、AB-8、HPD-100、X-5大孔吸附树脂(天津市海光化工有限公司提供,产品标准号:津Q/HG3790—91)。
马兰(采于绵阳师范学院内,经绵阳师范学院生命科学与技术学院罗明华教授鉴定为植物Kalimeris indica(L.)Sch.Bip);芦丁对照品(中国药品生物制品检定所,批号100080-200707);其他化学试剂均为国产分析纯(成都科龙化学试剂厂)。
2 方法
2.1 马兰提取液的制备
采摘新鲜马兰植物全草,置60℃下真空干燥至恒重(3 h),粉碎,过药典2号筛[L1](24目)。称取一定量马兰粉末,采用固液比1∶30、乙醇体积分数75%提取90 min,过滤,重复2次,合并滤液。滤液经旋转蒸发仪浓缩至无醇味,60℃真空干燥后即得马兰黄酮类组分的粗制品,并将该粗制品配置成一定浓度的样液,供纯化使用。
2.2 马兰黄酮类组分含量测定方法
2.2.1 对照品溶液的制备。
精密称取经120℃恒温干燥至恒重的芦丁对照品10 mg,置50 mL的量瓶中,加适量乙醇,用超声处理使其全部溶解,放冷,然后再加适量乙醇至刻度线,摇匀即得所需要的对照品溶液(每1 mL中含无水芦丁0.2 mg)。
2.2.2 标准曲线的制备。
精密量取对照品溶液 2、4、6、8、10、12 mL,将其分别置于50 mL的量瓶中,然后分别加水至12 mL,再分别滴加5%亚硝酸钠溶液2mL,摇匀,放置6 min,然后再分别滴加10% 硝酸铝溶液2 mL,摇匀,放置6 min,再滴加4%氢氧化钠试液20 mL,最后再加水至刻度线,摇匀,放置15 min,用相应试剂作为[L2]空白对照组,然后立即照紫外-可见分光光度法,设定波长在500 nm处测定各组对照品溶液的吸光度,记录实验所得各组吸光度[6]。以浓度(mg/L)为横坐标,各组所测的吸光度值为纵坐标,绘制标准
曲线所求得的回归曲线方程为A=10.46c-0.000 9,R2=0.999 5(n=7)。总黄酮以芦丁计在0.008~0.048 mg/L线性关系良好。
2.3 树脂的选择
2.3.1 树脂的前处理
称取干大孔树脂 NKA-9、DM-130、D-101、DM-301、AB-8、HPD-100、X-5,分别用丙酮连续洗涤数次,加适量水至无白色浑浊现象出现为止,再用蒸馏水洗涤至无有机溶剂味,用配制好的10%的NaCl溶液浸泡24 h,随后用蒸馏水冲洗至中性,再用已配制好的1 mol/mL的盐酸溶液冲洗,最后再用蒸馏水洗至中性即可。
2.3.2 静态吸附及静态解吸
准确称取7种已经处理好的大孔树脂各1 g置于100 mL的具塞磨口三角瓶中,然后分别加入马兰总黄酮水溶液50 mL(配制成总黄酮的含量为5.39 mg/mL),置往复式水浴恒温振荡仪上振荡,持续24 h,充分吸附后抽滤,分别量取各大孔树脂吸附后的溶液0.5 mL置于50 mL的量瓶中,按2.2.2法测定含量,最后按以下公式计算各种大孔树脂对马兰总黄酮的吸附量以及吸附率。将静态吸附的树脂过滤抽干后,加入50 mL 75%的乙醇溶液,然后将具塞磨口三角瓶置于旋转摇床上振荡24 h,充分解吸后再抽滤,再分别量取各大孔树脂解吸附后的溶液0.5 mL置于50 mL的量瓶中,按2.2.2法测定含量,最后按以下公式计算各种树脂对马兰总黄酮的解吸率[7]。

其中:c0起始浓度(mg/mL),c1为剩余浓度(mg/mL),V0为吸附溶液体积(mL),m 为树脂质量(g),c2为解吸液浓度(mg/mL),V1为解吸液体积(mL)。
2.3.3 静态吸附等温曲线
准确称取静态吸附和解吸率特性较好的D-101及HPD-100树脂,各5份,每份1.0 g,装入100 mL的具塞锥形瓶中,加入不同浓度的马兰总黄酮水溶液50 mL,置于25℃(298 K)往复式水浴恒温振荡器上振摇24 h,过滤,测定吸附后溶液的浓度,计算树脂的吸附量。根据平衡后吸附量与水溶液中总黄酮平衡浓度之间的关系,利用Langmuir和Freundich等温吸附方程的线性形式对实验结果进行拟合[8,9],绘制不同树脂吸附马兰总黄酮的等温吸附曲线并计算相关参数。
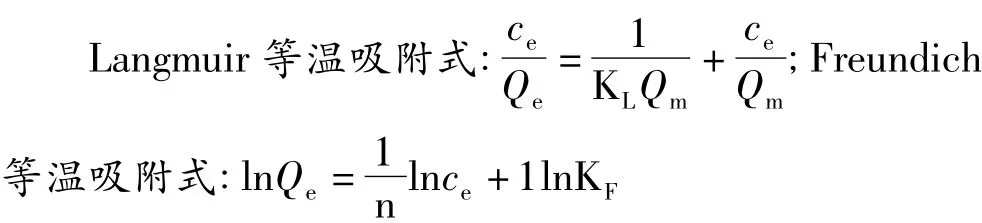
其中:Qe为平衡吸附量(mg/g),ce为平衡浓度(mg/mL),Qm为饱和吸附量(mg/g),KL为结合常数(mL/mg);n、KF为等温吸附特征常数。KL可以评价吸附量的大小,n则可描述等温线的变化趋势。
2.3.4 静态吸附动力学
准确称取静态吸附和解吸率特性较好的D-101及HPD-100树脂,每份1.0 g,装入100 mL具塞锥形瓶中,加入马兰总黄酮水溶液50 mL,置往复式水浴恒温振荡器上振荡,然后分别再测定各树脂在t时刻内(t=0.5,1,2,4,8,16,24 h)时达到的吸附量。以 Qt对 t作图,并依照Lagergren准一级动力学方程,拟合-ln(1- Qt/Qe)与 t的曲线,并计算平衡速率常数 K[[8,9]。

其中:Qe为平衡吸附量(mg/g),Qt为时间t时的吸附量(mg/g),K平衡速率常数(h-1)。
2.3.5 动态吸附与解析
取D-101及HPD-100树脂湿法装于1 cm×20 cm的柱内(计算柱床体积=半径2×π×树脂层高),装柱高度为12.8 cm,加马兰总黄酮水溶液100 mL(按2.2.2法已知测定含量)于柱顶,先用水100 mL冲洗,再用75%乙醇100 mL洗脱[10]。分别收集残留液,水洗液和乙醇洗脱液,测定吸光度,计算总黄酮含量,以总黄酮的比吸附量(mg/mL),解吸率(%)为评价指标,筛选最佳树脂。

其中:V为树脂湿体积(mL);M上为上柱液中成分的质量(mg);M残为过柱流出液中成分的质量(mg);M水洗为水洗脱下来成分的质量(mg);M醇洗脱为乙醇洗脱成分的质量(mg)。
2.4 树脂柱分离条件的考察
考察影响大孔树脂纯化过程中的主要因素即样液[L3]浓度、上样流速、pH 等的最优条件[11-12]。
2.4.1 上样浓度的考察
以筛选出的D101型大孔树脂为马兰总黄酮的纯化载体,采用湿法装柱。层析柱的规格为(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为2.34、4.68、7.02、9.36、11.70、14.04 mg/mL 的样液各 50 mL,以3 BV/h的流速,分别加入6根同样的树脂柱中。吸附完全后,用5BV去离子水冲洗,再用5 BV浓度75%乙醇以3 BV/h的流速洗脱,测定回收率,选择最适上样浓度。(1BV=31.4 mL)
回收率/%=(乙醇洗脱所得总黄酮的质量/上样前总黄酮的质量)×100
2.4.2 上样量的考察(泄漏曲线)
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为9.36 mg/mL的样液若干,以3 BV/h的速度上样,每10 mL为一个收集段,检测每段收集液中总黄酮浓度,绘制泄漏曲线。
2.4.3 上样速率的考察
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为9.36 mg/mL的样液100 mL,分别以 1 BV/h、2 BV/h、3BV/h、4BV/h、5 BV/h的流速加入到5根同样的树脂柱中。吸附完全后,用5BV去离子水冲洗,再用浓度75%乙醇以3 BV/h的流速洗脱,乙醇用量为5 BV,测定回收率。
2.4.4 样液pH值的考察
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为9.36 mg/mL的样液100 mL。然后分别调 pH 值至4~5、6~7、8~9、10 ~11、12~13以3 BV/h的流速加入到5根同样的树脂柱中。吸附完全后,用5 BV去离子水冲洗,再用体积分数75%的乙醇以3 BV/h的流速洗脱,乙醇用量为5 BV,测定回收率。
2.4.5 乙醇洗脱浓度的考察
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为9.36 mg/mL的样液100 mL,以3 BV/h的流速上柱,吸附完全后,用5BV去离子水冲洗。分别用浓度45%、55%、65%、75%、85%的乙醇溶液对按以上方法上样的5根树脂柱进行洗脱,洗脱速率为3 BV/h,乙醇用量为5 BV,测定其回收率。
2.4.6 洗脱速率的考察
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为9.36 mg/mL的样液100 mL,以3 BV/h的流速上柱,吸附完全后,用5BV去离子水冲洗。用浓度75%的乙醇溶液分别以按1、2、3、4、5 BV/h的速率对按以上方法上样的5根树脂柱进行洗脱,乙醇用量为5 BV,测定其回收率。
2.4.7 洗脱体积的考察
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。取总黄酮浓度为9.36 mg/mL的样液100 mL,以3 BV/h的流速上柱,吸附完全后。用75%乙醇,以3 BV/h的速度洗脱,每10 mL一个收集段收集洗脱液,检测每段收集液中总黄酮浓度,绘制洗脱曲线。
2.5 工艺验证实验
以D101型大孔树脂装柱(2 cm ×20 cm),装柱高度为10 cm。根据以上分离条件筛选实验结果,即:总黄酮浓度为9.36 mg/mL的样液100 mL,以3 BV/h的流速,控制pH值为4~5上柱,5BV去离子水冲洗后,用75%乙醇100 mL以3 BV/h用量进行洗脱。收集洗脱液,在60℃真空干燥后即得马兰总黄酮的精制品,称重,并按2.2.2法测定其总黄酮纯度。
3 结果
3.1 树脂筛选实验
3.1.1 静态吸附及静态解吸结果
静态吸附及静态解吸结果见下表1。

表1 七种大孔吸附树脂对马兰黄酮类组分的静态吸附及静态解吸结果
实验结果显示D-101及HPD-100树脂吸附率及解析率均较好。因此选择这二者进行下一步实验。
3.1.2 静态吸附等温曲线
静态吸附等温曲线实验结果如下表2、图1、图2。

表2 25℃(298 K)下等温吸附方程及参数

图1 Langmuir等温吸附线
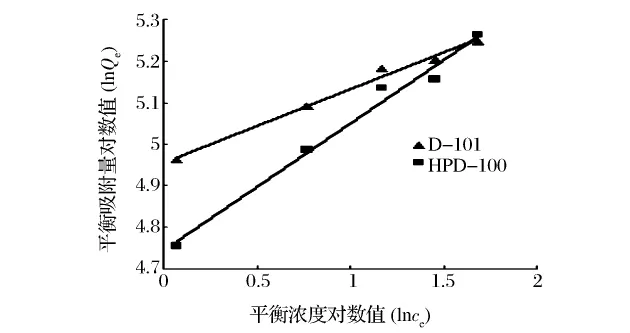
图2 Freundich等温吸附线
由以上结果可以看出马兰黄酮类组分在的D-101及HPD-100树脂上的吸附基本符合Langmuir和Freundich等温吸附方程。而从相关系数比较看,选用Langmuir描述更佳。根据Langmuir等温吸附模型的假定,可初步推测这两种树脂大孔树脂对马兰黄酮类组分的吸附呈单分子吸附。Freundich模型的等温吸附特征常数n值介于2~10,说明马兰黄酮类组分在这2种树脂上的吸附容易实现。
3.1.3 静态吸附动力学
静态吸附动力学结果如下表3、图3、图4。

表3 Lagergren准一级动力学方程及参数
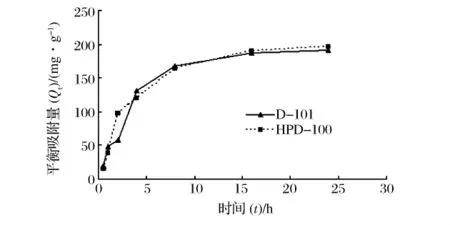
图3 吸附动力曲线

图4 Lagergren曲线
由以上结果可以看出,D-101及HPD-100树脂的R2值均在0.99以上,说明液膜扩散是2种树脂的控制速率步骤。平衡速率常数K显示,D-101树脂吸附速率略高于HPD-100树脂。
3.1.4 动态吸附与解析
动态吸附与解析结果如下表4。

表4 D-101、HPD-100两种大孔树脂的动态吸附筛选实验结果
由以上结果可以看出D-101型与HPD-100型2种大孔树脂对马兰中的黄酮类组分都具有比较好的吸附能力及解吸能力,二者相较D-101型树脂在比吸附量及解吸率上都优于HPD-100型树脂。因此选择D-101型树脂为分离马兰中的黄酮类组分的最优树脂。
3.2 工艺筛选结果
3.2.1 上样浓度
上样浓度实验结果见表5。
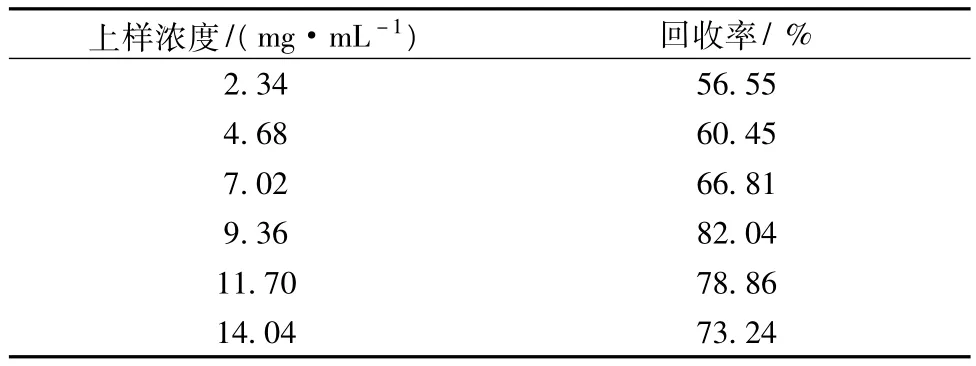
表5 上样浓度的影响
由以上结果可以看出上样浓度在9.36 mg/mL时回收率较高,继续提高上样浓度回收率有所下降,故选择最适上样浓度为9.36 mg/mL。
3.2.2 上样量
上样量实验结果见图5。

图5 上样量的影响
由以上结果可以看出当上样体积达到50 mL后开始出现渗漏。渗漏液的总黄酮含量随上样体积增加而上升,当上样体积达到100 mL时,渗漏液浓度接近上样浓度,说明树脂基本达到饱和。
3.2.3 上样速率
上样速率实验结果见表6。
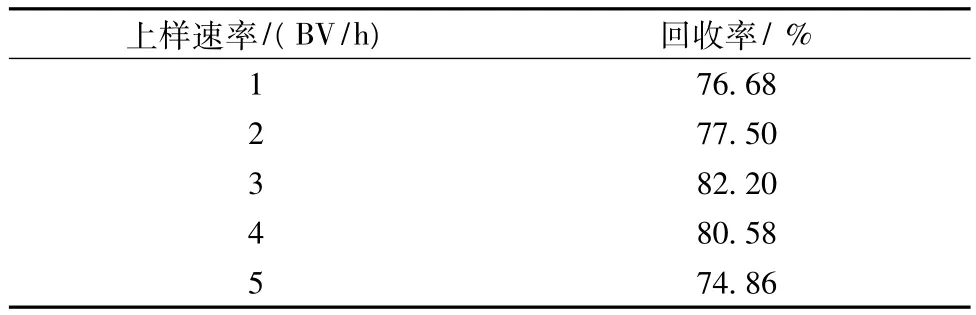
表6 上样速率的影响
由以上结果可以看出当上样速率对回收率影响差异不大,以3BV/h上样略优。
3.2.4 样液pH值
样液pH实验结果见表7

表7 样液pH值的影响
由以上结果可以看出样液pH值4~5的条件下上样回收率较高。
3.2.5 乙醇洗脱浓度
乙醇洗脱浓度实验结果见表8。
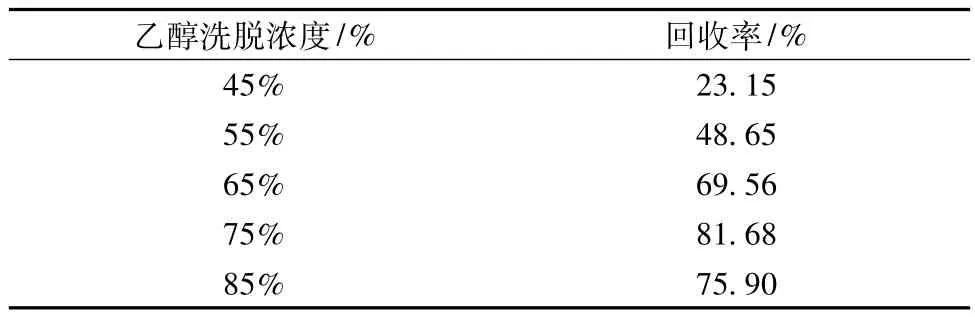
表8 乙醇洗脱浓度实验结果
由以上结果可以看出以75%的乙醇进行洗脱,回收率较高。
3.2.6 洗脱速率
洗脱速率实验结果见表9。

表9 乙醇洗脱速率实验结果
由以上结果可以看出以3 BV/h的速率进行洗脱,回收率较高。
3.2.7 洗脱体积
洗脱体积实验结果见图6。

图6 洗脱体积的影响
由以上结果可以看出当洗脱体积达到150mL后基本洗脱完全。
3.3 工艺验证实验
工艺验证实验结果如下表10。

表10 验证实验结果
由以上结果可以看出用D101型大孔树脂分离马兰黄酮类组分其纯度可达70%以上。
4 讨论
本实验选用了7种常用于分离黄酮类组分的大孔吸附树脂进行筛选。通过静态吸附、静态解吸初步实验实验,课题组首先确定了D-101型与HPD-100型两种大孔吸附树脂对马兰黄酮类组分的吸附及分离效果较好。AB-8型大孔吸附树脂的吸附量虽然最大,但是AB-8型大孔吸附树脂洗脱效果较差,故不予选择。进一步对D-101型和HPD-100型2种大孔吸附树脂进行静态等温曲线、静态吸附动力学实验以及动态筛选实验。二者比较D-101型树脂各项指标均优于HPD-100型树脂,因此最终选择D-101型树脂为分离载体。分析其吸附机理,D-101型树脂自身极性较弱,其对马兰黄酮类组分吸附力较强,可以推断马兰黄酮类组分极性基团可能较少。
通过对影响D-101型大孔树脂吸附及解吸的各种因素系统研究,最后确定了大孔树脂分离马兰黄酮类组分的最佳工艺,该工艺重复性良好,产品纯度较高,可为日后研究马兰抗胃溃疡机理以及大规模开发马兰奠定基础。
[1] 雷载权,张廷模.中华临床中药学[M].北京,人民卫生出版社,1998:1 023-1 025.
[2] 黄敏.菜药兼用型植物——马兰[J].山东食品科技,2004,6(2):8.
[3] 林蒲田.野菜中的上品——马兰[J].湖南农业,2010(9):20.
[4] 李林.野生蔬菜马兰人工栽培技术[J].西北园艺:蔬菜,2009(4):25-26.
[5] 涂朝勇,田徽,王建,等.路边菊水煎液抗实验性胃溃疡的研究[J].时珍国医国药,2009,20(10):2 595.
[6] 国家药典委员会.中华人民共和国药典2010版一部[M].北京,中国医药科技出版社,2010:30.
[7] 励娜,杨荣平,张小梅,等.大孔树脂分离山楂总黄酮工艺优化[J].中国中药杂志,2007,32(13):1 352-1 355.
[8] 李稳宏,唐璇,李新生,等.黄姜黄色素在大孔树脂上的吸附动力学研究[J].离子交换与吸附,2008,24(6):526-534.
[9] 王穆君,孙越,周玮,等.大孔树脂对水溶液中邻苯二甲酸的吸附行为及其热力学研究[J].离子交换与吸附,2004,20(6):533 -540.
[10] 钟明媚,陈飞虎,袁丽萍,等.大孔树脂对鬼针草总黄酮的吸附分离特性研究[J].中药材,2007,30(3):338-341.
[11] Kim S Y,Gaa J J,Lee W C,et a1.Antioxidant flavonoids from leaves of Morus alba[J].Arch Pharm Res,1999,21(1):8l-85.
[12] 盛华刚,朱立俏,张超,等.金荞麦提取液的大孔树脂分离纯化工艺研究[J].中国中药杂志,2008,33(15):1832-1835.
Studies on Adsorption Characteristics and Purification Process of Flavonoids From Kalimeris indica(L.)Sch.Bip by Macroreticular Resin
Tian Hui1,2,Ruan Qi-ping1,Lai En-yang1,Ou Ping3,Li Qiang3
1(Key Laboratory for Molecular Biology and Biopharmaceutic,Mianyang Normal University,Mianyang 621000,China)2(Department of Chinese Materia Medica,Chengdu University of Traditional Chinese Medicine,Sichuan Chengdu 611137,China)3(Mianyang Qiangshanyuan Pharmaceutical Co.Ltd,Mianyang 621000,China)
To investigate the adsorption characteristics and purification process of the flavonoids from Kalimeris indica by macroreticular resin.The static capacity absorption,static capacity desorption,static adsorption dynamics(quasi-order kinetic equation of Lagergren),static adsorption isothermal(Langmuir and Freundich),dynamic absorption ratio and dynamic elution ratio of seven types of macroreticular resin were studied and compared in order to find the best one,and the adsorption and desorption performances of the best one were studied in detail.The type of D101 resin gave the best effect of separation with the sampling rate 3 BV/h and concentrations of 9.36 mg/mL in pH 4-5,and the concentration of elution was 75%ethanol with eluting velocity 3 BV/h.The purity of total flavonoids in the product was up to 70%,and the purification process was feasible.
Kalimeris indica(L.)Sch.Bip,flavonoids,macroreticular resin
硕士研究生。
*四川省科技支撑计划项目项目(2010SZ0245);四川省教育厅自然科学科研项目(10ZC030));绵阳师范学院自然科学科研项目(MA2009015)
2011-07-06,改回日期:2011-0-
