万年蒿总黄酮超声波提取工艺的优化*
2012-11-28黄静郝文芳
黄静,郝文芳
(西北农林科技大学生命科学学院,陕西杨凌,712100)
万年蒿总黄酮超声波提取工艺的优化*
黄静,郝文芳
(西北农林科技大学生命科学学院,陕西杨凌,712100)
以万年蒿为原料,研究超声波提取万年蒿总黄酮的最佳工艺。通过单因素试验研究乙醇体积分数、料液比、超声波功率及超声时间对总黄酮提取量的影响。以此为基础,采用L9(34)正交试验设计,优化超声波提取万年蒿总黄酮工艺条件;并将其与传统的热回流法和浸提法进行了比较。超声波提取万年蒿总黄酮的最佳提取工艺参数为:乙醇体积分数60%,料液比1∶20(g:mL),超声波功率350 W,超声时间60 min。在此工艺条件下,万年蒿总黄酮提取量为69.55 mg/g。
万年蒿,超声波提取,总黄酮,提取工艺,正交试验设计
黄酮类化合物是植物体中普遍存在的次生代谢物,是许多传统药物的有效成分。研究证实,黄酮类化合物具有抗细菌、抗真菌、抗病原体、抗癌、抗氧化和消炎等多种药理作用[1-3],具有重要的研究价值。目前,有关万年蒿(Artemisia sacrorum Ledeb.)化学成分的研究已有大量报道,而黄酮类化合物,如芹黄素、芫花黄素,则是其重要的化学成分[4-5]。万年蒿,又名白莲蒿、铁杆蒿,为菊科(Compositae)蒿属(Artemisia)草本植物[6],常作为民间药用于治疗急慢性肝炎、小儿惊风、发热、急慢性胃肠炎等疾病,并具有一定的抗肿瘤、保肝护肝之功效[7-11]。因此,对万年蒿中黄酮类化合物的研究和开发具有重要意义。
传统提取技术,如热回流提取或浸渍提取,常用于黄酮类化合物的提取,但存在着耗时耗能,溶剂和样品需求量大,提取产物易损失等不足[12-14]。超声波提取技术主要依靠超声波在提取溶剂中的空化效应进行有效成分的提取。当超声波在溶液中传播时,负压促使空化泡的不断形成和破裂,引起细胞壁破碎,有效增强了溶剂的传质作用,进而促进有效成分从植物组织中快速释放出来[15-16]。作为一门新兴的提取技术,超声波提取展现出穿透力强、效率高、周期短、操作简单等显著特点[13,17-18],并已广泛应用于生物活性物质的提取,且取得了较好的效果[19-20]。本研究以总黄酮提取量为评价指标,采用超声波提取技术对万年蒿总黄酮的最佳提取工艺进行研究,并与传统提取方法进行比较,以期建立高效快速、操作简便的提取万年蒿总黄酮的工艺方法。
1 材料、试剂与仪器
万年蒿于2010年9月下旬采自陕西省安塞地区(经西北农林科技大学生命科学学院吴振海高级实验师鉴定)。将材料地上部分自然阴干,粉碎,过40目筛,保存于干燥处备用。
芦丁对照品(上海晶纯试剂有限公司;纯度≥98%),亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、石油醚(60~90℃)等,均为分析纯。
KQ-500DE型超声波清洗机(昆山市超声仪器有限公司),RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂),SHZ-D(Ⅲ)真空泵(巩义市予华仪器有限责任公司),752紫外-可见分光光度计(上海光谱仪器有限公司)。
2 试验方法
2.1 对照品溶液的制备
称取干燥至恒重的芦丁对照品20.00 mg,用体积分数为30%的乙醇溶解并定容至100 mL,摇匀,即得0.20 mg/mL芦丁对照品溶液。
2.2 标准曲线的建立[21]
吸取上述芦丁对照品溶液 0、2.0、4.0、6.0、8.0、10.0 mL分别置于25 mL具塞试管中,30%乙醇补充至10.0 mL,加入5%NaNO2溶液0.7 mL,混匀后静置6 min,再加入0.7 mL 10%Al(NO3)3溶液,摇匀后静置6 min,然后加入4%NaOH溶液 5 mL,用30%乙醇稀释至刻度,摇匀后静置10 min,于波长510 nm下测定吸光度。以吸光度(Y)为纵坐标、质量浓度(X)为横坐标建立直线回归,得回归方程:Y=
11.927X﹢ 0.000 4,R2=1,线性范围为 0.016~0.080 mg/mL。
2.3 总黄酮的超声波提取及含量测定
称取万年蒿粗粉1.000 g置于50 mL塑料密封管中,按不同料液比加入一定浓度的乙醇溶液,密封,在一定功率和时间下,将温度控制在(45±1)℃,进行超声波提取,冷却、过滤并合并滤液,乙醇提取液经旋转蒸发仪减压回收,蒸干,残渣用50 mL蒸馏水溶解,经石油醚萃取脂溶性成分,弃去石油醚层,水层加无水乙醇配成30%乙醇溶液后转入100 mL容量瓶中,用30%乙醇定容至刻度,摇匀即得供试品溶液,并按以下公式计算总黄酮提取量:
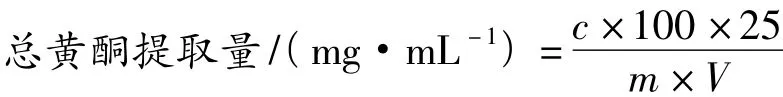
式中:c为线性方程计算出的总黄酮质量浓度(mg/mL);V为检测时所取溶液体积(mL);m为样品质量(g)。
2.4 精密度试验
精密量取相同量对照品溶液6份,按2.2节标准曲线的制备方法测定吸光度值,结果测得平均吸光度为0.387,相对标准偏差(RSD)为0.78%,表明精密度良好。
2.5 稳定性试验
按2.3节操作,将同一份供试品溶液分别在0、10、20、30、40、50、60 min 内进行吸光度值测定。结果测得RSD为0.48%,表明供试液在60 min内基本稳定。
2.6 重复性试验
平行称取万年蒿样品6份,制备供试品溶液,按2.3节测定吸光度值,结果测得平均吸光度为0.621,RSD为1.33%,表明重复性良好。
2.7 加标回收率试验
称取总黄酮含量已知的万年蒿样品6份,加入芦丁对照液0.5 mL,按2.3节测定吸光度值,结果测得平均回收率为92.22%,RSD为1.61%。
2.8 单因素试验
2.8.1 乙醇体积分数对总黄酮提取量的影响
在料液比1∶20(g:mL)、超声波功率300 W的条件下,超声提取30 min后,测定乙醇体积分数为30%、45%、60%、75%、90%、100%时总黄酮提取量。
2.8.2 料液比对总黄酮提取量的影响
在乙醇体积分数为60%、超声波功率300 W的条件下,超声提取30 min后,测定料液比为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g:mL)时总黄酮提取量。
2.8.3 超声波功率对总黄酮提取量的影响
在乙醇体积分数为60%、料液比1∶20(g:mL)的条件下,超声提取30 min后,测定超声波功率为200、250、300、350、400、450 W 时总黄酮提取量。
2.8.4 超声时间对总黄酮提取量的影响
在乙醇体积分数为60%、料液比1∶20(g:mL)和超声波功率300 W的条件下,测定超声提取0、15、30、45、60、75 min 后总黄酮提取量。
2.9 正交试验设计
在单因素试验的基础上,以乙醇体积分数、料液比、超声波功率和超声时间为影响因素,按L9(34)正交试验设计优化万年蒿总黄酮超声波提取工艺,每个因素设计3个水平(见表1)。
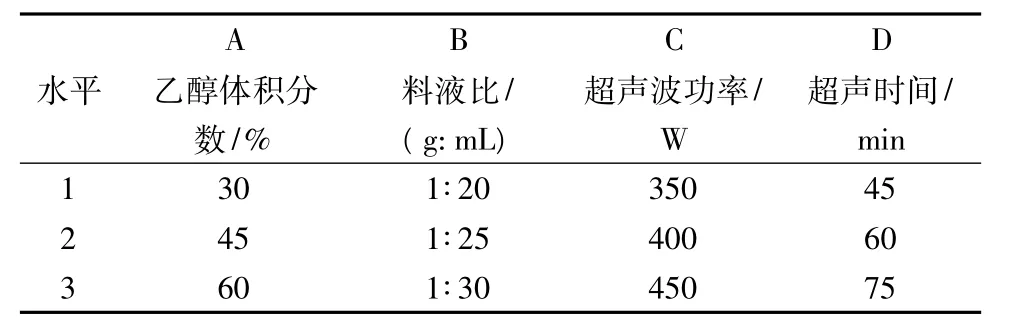
表1 正交试验因素水平
2.10 回流法和浸渍法提取万年蒿总黄酮
浸渍法:称取1.000 g万年蒿样品2份,按料液比1∶20(g:mL)置于60%的乙醇水溶液中,在常温和45℃下分别浸泡24 h,冷却、过滤并合并滤液,按2.3方法测定总黄酮的提取量。
回流法:称取5.000 g万年蒿样品2份,按料液比1∶20(g:mL)加入60%乙醇水溶液,在45℃下分别回流提取60、120 min后,冷却、过滤并合并滤液,按2.3方法进行总黄酮提取量的测定。
3 结果与分析
3.1 单因素试验
3.1.1 乙醇体积分数对总黄酮提取量的影响
如图1所示,当乙醇体积分数由30%增加至60%时,总黄酮提取量缓慢增加,当体积分数为60%时,总黄酮提取量达到最大值,此后随着乙醇体积分数的增加总黄酮提取量迅速降低,无水乙醇时达到最小值。这主要与溶剂的极性相关,依据“相似相溶”原理,目标物的极性同溶剂的极性越相似,目标物越容易被溶解。同时,水的存在有助于干燥材料扩散能力和渗透能力的恢复[19],促进植物材料的膨胀,增加材料和提取溶剂之间的接触面积[22]。相关研究证明[16],在相同的乙醇体积分数下,超声波法提取的有效成分含量明显高于浸渍提取。这是由于超声波在一定程度上加速了干样的水化过程,促进了有效成分从细胞内释放[23]。并且,提取溶剂表面张力的增加、黏度和蒸汽压的降低也将引起超声波的空化作用的增强,进而促使提取率升高[24]。提取过程中,随着溶剂极性的不断降低,提取溶液由红棕色逐渐变化为深绿色,叶绿素等低极性杂质在提取溶剂中的含量不断增加,阻碍了黄酮类化合物的溶出,导致黄酮类物质提取量降低。因此,本研究选择体积分数为30%、45%、60%的乙醇作为后续正交试验的因素水平。

图1 乙醇体积分数对总黄酮提取量的影响
3.1.2 料液比对总黄酮提取量的影响
由图2 可知,在料液比1∶10 ~1∶20(g∶mL)之间,万年蒿总黄酮提取量随着料液比的增加而提高,而当料液由1∶20增加至1∶30时,总黄酮提取量变化则相对稳定,大于1∶30后提取量开始下降。一般情况下,提取溶剂量越大,细胞壁内外浓度差越大,有效成分越容易从细胞内渗出,提取率越高。但是溶剂用量过大,溶剂对超声波能量的吸收增加,而空化泡对能量的吸收则相应减少,细胞壁破裂不完全,目标化合物不能从细胞中很好溶出,从而导致提取率降低[25-26]。实际生产过程中,溶剂用量太大不仅会增加后续浓缩工作的难度而且会造成溶剂和能源的严重浪费。但是,料液比过小,材料中的有效成分则不能被充分提取,提取率将偏低。因此,若想以最低的成本获得最高的效益,选择合适的料液比至关重要。综合考虑,本研究选择料液比1∶20、1∶25、1∶30 作为后续正交试验的因素水平。
3.1.3 超声波功率对总黄酮提取量的影响
如图3所示,其他条件一定时,随着超声波功率的增加,万年蒿总黄酮提取量随之增加,400 W时达到最高点,当功率大于400 W后总黄酮提取量开始下降。总黄酮提取量之所以随着超声波功率的增加而不断提高是因为功率的增加引起超声波空化作用的增强[16]。当超声波在溶剂中传播时,形成的空化泡在材料表面周围的破碎,产生强烈的剪切力,引起了植物组织细微裂缝的形成。由于共振态气泡尺寸与声波的振幅成比例,所以超声波功率越大,超声波在提取介质中的振幅越大,空化泡的破碎越剧烈[27],有效成分的提取率越高。但当功率过高时,一些目标化合物的结构则会受到破坏,并且非有效成分也将随着材料的剧烈破碎大量溶解于提取溶剂中,有效成分的溶解量相应减少,因此万年蒿总黄酮提取量不会随着功率增加而持续升高。综合考虑,选择超声波功率300、350、400 W作为后续正交试验的因素水平。
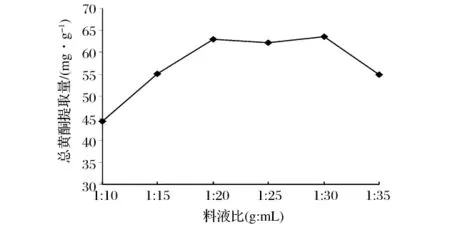
图2 料液比对总黄酮提取量的影响
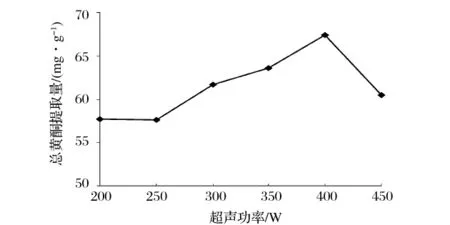
图3 超声功率对总黄酮提取量的影响
3.1.4 超声时间对总黄酮提取量的影响
由图4可知,当以无超声波处理(0 min)为对照时,延长超声波处理时间总黄酮提取量明显提高,但超声波仅在最初的30 min内作用显著,此后随着提取时间的延长,总黄酮提取量缓慢增加。对于这种现象可从两方面解释[16],其一,提取溶剂中目标化合物的浓度与其溶解性之间的差异性。初始阶段,黄酮类化合物在60%乙醇溶液中浓度很低并具有较高的溶解度,故可在短时间内迅速释放到提取溶剂中;随着提取时间的延长,溶剂中黄酮类化合物含量不断升高,溶液趋于饱和,溶解度降低,总黄酮提取量变化缓慢。其二,由于材料颗粒的完整性,存在于颗粒表面的目标物质相比于颗粒内部的更容易获得。最初阶段,提取溶剂主要溶解样品颗粒外的黄酮类物质,故提取量在短时间内迅速增加,此后则主要是存在于材料颗粒内部的有效成分依靠浓度差缓慢释放到溶剂中,所以随着时间的延长总黄酮提取量增加并不明显。综合以上分析,选取45、60、75 min的超声时间作为后续正交试验因素水平。
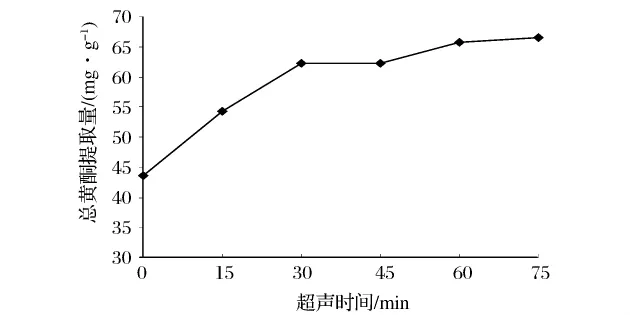
图4 超声时间对总黄酮提取量的影响
3.2 正交试验设计结果与分析
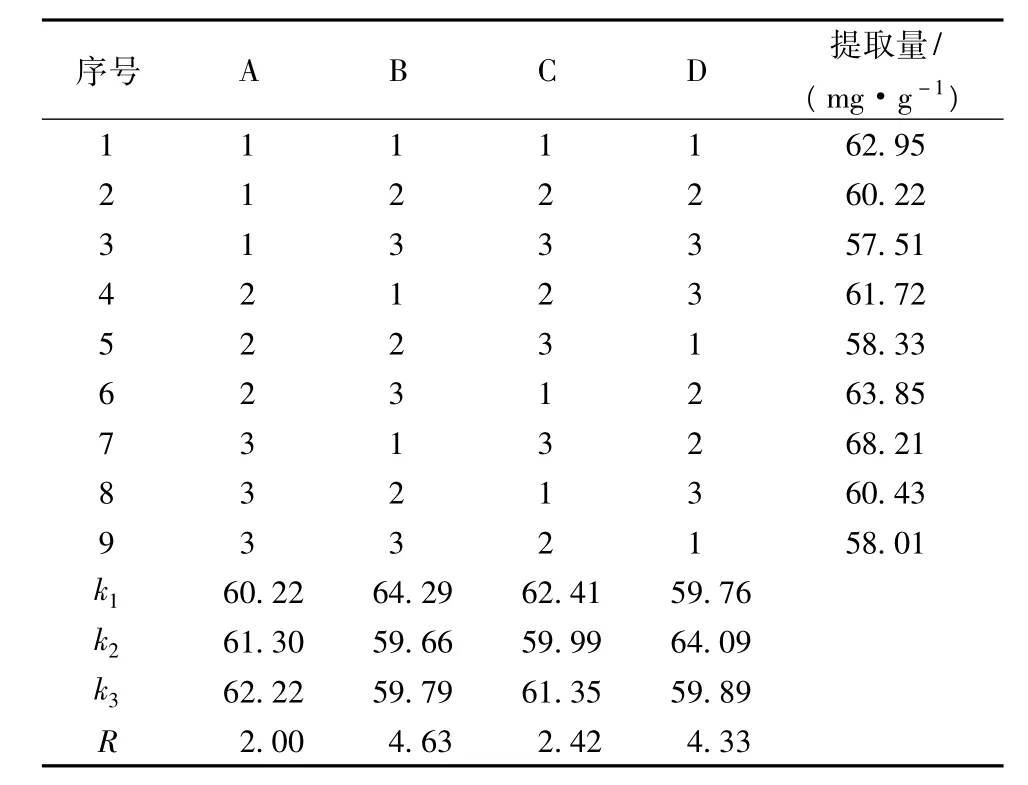
表2 L9(34)正交试验结果
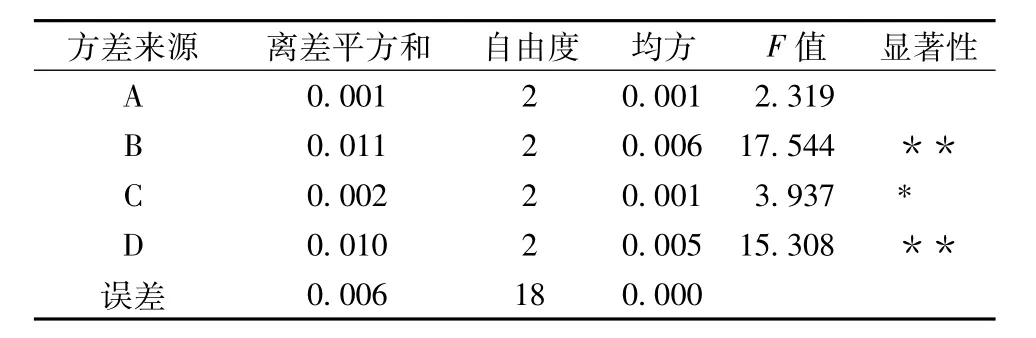
表3 方差分析
由表2分析,各因素对万年蒿总黄酮提取量影响从大到小的顺序依次为B>D>C>A,即料液比>超声时间>超声波功率>乙醇体积分数。此顺序同方差分析结果一致(见表3)。从方差分析结果可以看出,料液比和超声时间对总黄酮提取量具有极显著影响,超声功率具有显著影响,而乙醇体积分数则对万年蒿总黄酮提取量影响不显著。由此得出,最佳工艺条件为A3B1C1D2,即乙醇体积分数60%、料液比1∶20、超声波功率350 W、超声时间60 min。但是,最优工艺条件不存在正交试验设计中,因此,需对最优工艺进行进一步验证。
3.3 验证实验
按照上述最佳工艺A3B1C1D2制备3份供试样液,进行工艺验证。结果测得总黄酮提取量的平均值为69.55 mg/g,RSD为1.2%,由此证明该工艺稳定可行。
3.4 超声波提取法同传统提取方法的比较研究
为了合理的评价超声波提取总黄酮的效率,分别将热回流法和浸渍法同超声波最优提取工艺进行比较。如图5所示,相对于浸渍提取和热回流提取,超声波法获得的总黄酮提取量最高,达到69.55 mg/g;尽管常温条件下浸渍提取最易操作,但是总黄酮提取量很低且耗费时间较长;与常温浸提相比较,45℃下浸提提取量增加了15.03%,提取率大幅度提高,但仍存在着耗时耗能等缺点;回流时间由1 h延长到2 h,提取量增加了8.59%,但热回流提取操作麻烦,耗时耗能。由此可以得出,超声波提取优于传统提取的方法,提取时间短,得率高,操作简便,是提取万年蒿总黄酮有效可行的方法。
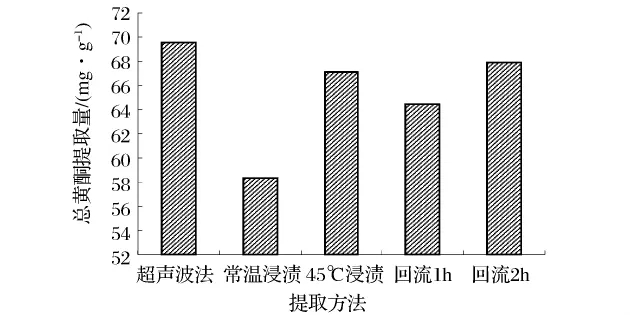
图5 比较不同提取方法对总黄酮提取量的影响
4 讨论
通过单因素试验和正交试验设计,本研究确定了超声波提取万年蒿总黄酮的最佳工艺为:乙醇体积分数60%、料液比1∶20(g:mL)、超声波功率350 W、超声时间60 min。在此最佳提取工艺条件下,总黄酮提取量达到69.55 mg/g。经验证,该工艺合理有效,稳定可行,适合于万年蒿总黄酮的提取。
除了乙醇体积分数、料液比、超声功率和提取时间对万年蒿总黄酮的提取有一定影响之外,温度[18]同样也是影响超声波提取总黄酮的重要因素之一。提取过程中,随着超声波功率的增加和超声时间的延长,提取温度将不断上升,因此本试验将超声波清洗仪同自来水直接连接,通过循环水的流动将温度控制在(45±1)℃,以降低温度对试验的影响。
传统的浸渍提取和热回流提取主要依靠一系列的渗透和溶解过程去提取植物材料组织内的有效成分[16],故提取效率较低。相对而言,超声波提取技术除了依赖超声波空化效应进行有效成分提取外,其乳化、扩散、破碎和震荡等效应也会促进有效成分从原材料中快速释放出来[28]。所以,相比较于热回流提取和浸渍提取,超声波提取工艺省时高效、操作更为简便,值得进一步深入研究。
[1] Merken H M,Beecher G R.Measurement of food flavonoids by high-performance liquid chromatography:a review[J].J Agric Food Chem,2000,48(3):577 -599.
[2] Robards K,Antolovich M.Analytical chemistry of fruit bioflavonoids.A Review[J].Analyst,1997,122(2):11R -34R.
[3] Velickovic D T,Nikolova M T,Ivancheva S V,et al.Extraction of flavonoids from garden(Salvia officinalis L.)and glutinous(Salvia glutinosa L.)sage by ultrasonic and classical maceration[J].J Serb Chem Soc,2007,72(1):73-80.
[4] 师彦平,李瑜,张会昌.铁杆蒿化学成分研究[J].高等学校化学学报,1992,13(10):1258 -1261.
[5] 王宗伟.万年蒿中绿原酸对DPPH自由基的清除作用[J].国外医学中医中药分册,1997,20(2):148-154.
[6] 林有润.中国植物志[M].北京:科学出版社,1991:44-46.
[7] Yuan H D,Jin G Z,Piao G C.Hepatoprotective effects of an active part from Artemisia sacrorum Ledeb.against acetaminophen-induced toxicity in mice[J].J Ethnopharmacol,2010,127(2):528 -533.
[8] 戴小军,刘延庆,梅全喜.蒿属药用植物药理活性研究进展[J].中药材,2005,28(3):243-246.
[9] 李红梅.万年蒿抗肝损伤活性部位研究[D].延吉:延边大学,2008.
[10] 朴光春,权迎春.万年蒿提取物对小鼠肝损伤的保护作用[J].时珍国医国药,2007,18(7):1 646-1 647.
[11] 王心喜,金光洙.中药万年蒿的化学成分与药理作用研究进展[J].中药材,2010,33(5):831-833.
[12] Li H,Chen B,Yao S Z.Application of ultrasonic technique for extracting chlorogenic acid from Eucommia ulmodies Oliv(E.ulmodies)[J].Ultrason Sonochem,2005,12(4):295-300.
[13] Gao M,Liu C Z.Comparison of techniques for the extraction of avonoids from cultured cells of Saussurea medusa Maxim[J].World J Microb Biot,2005,21(8/9):1 461-1 463.
[14] Chen F,Sun Y Z,Zhao G H,et al.Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry[J].Ultrason Sonochem,2007,14(6):767 -778.
[15] Cravotto G,Boffa L,Mantegna S,et al.Improved extraction of vegetable oils under high-intensity ultrasound and/or microwaves[J].Ultrason Sonochem,2008,15(5):898-902.
[16] Hemwimol S,Pavasant P,Shotipruk A.Ultrasound-assisted extraction of anthraquinones from roots of Morinda citrifolia[J].Ultrason Sonochem,2006,13(6):543 -548.
[17] Mason T J,Paniwnyk L,Lorimer J P.The uses of ultrasound in food technology[J].Ultrason Sonochem,1996,3(3):S253-S260.
[18] Zhang H F,Yang X H,Zhao L D,et al.Ultrasonic-assisted extraction of epimedin C from fresh leaves of Epimedium and extraction mechanism[J].Innov Food Sci Emerg Technol,2009,10(1):54 - 60.
[19] Toma M,Vinatoru M,Paniwnyk L,et al.Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J].Ultrason Sonochem,2001,8(2):137 -142.
[20] Vinatoru M.An overview of the ultrasonically assisted extraction of bioactive principles from herbs[J].Ultrason sonochem,2001,8(3):303 -313.
[21] 王卫东,陈复生.陈皮中黄酮类化合物抗氧化活性的研究[J].中国食品添加剂,2007,59(2):59-62.
[22] Li H Z,Pordesimo L,Weiss J.High intensity ultrasoundassisted extraction of oil from soybeans[J].Food Res Int,2004,37(7):731 -738.
[23] Hemwimon S,Pavasant P,Shotipruk A.Microwave-assisted extraction of antioxidative anthraquinones from roots of Morinda citrifolia[J].Sep Purif Technol,2007,54(1):44-50.
[24] Rostagno M A,Palma M,Barroso C G.Ultrasound-assisted extraction of soy isoyavones[J].J Chromatogr A,2003,1 012(2):119 -128.
[25] 林海禄,彭雪娇,罗明标,等.八角茴香中莽草酸超声提取工艺研究[J].食品科技,2007,32(4):76-78.
[26] 杨潇,代娟,芮光伟,等.知母中芒果苷的超声提取工艺研究[J].食品科技,2008,34(3):207-210.
[27] Suslick K S,Casadonte D J,Green M L H,et al.Effects of high intensity ultrasound on inorganic solids[J].Ultrasonics,1987,25(1):56 -59.
[28] Roldán-Gutiérrez J M,Ruiz-Jiménez J,Luque-de-Castro M D.Ultrasound-assisted dynamic extraction of valuable compounds from aromatic plants and flowers as compared with steam distillation and superheated liquid extraction[J].Talanta,2008,75(5):1 369 -1 375.
Optimization of Ultrasonic Extraction Processes of Total Flavonoids from Artemisia sacrorum Ledeb.
Huang Jing,Hao Wen-fang
(College of Life Science,Northwest A&F University,Yangling 712100,China)
Artemisia sacrorum Ledeb.was extracted by ultrasound and the processing was optimized.The influence of four extraction variables on extraction yields of total flavonoids was investigated,including ethanol concentration,the ratio of material to solvent,ultrasonic power and time.Based on the results of our investigations,orthogonal test design L9(34)was used to optimize the extraction yields.In addition,heat reflux and maceration were also employed to compare with ultrasonic extraction processes.The results indicated that the optimum ultrasonic extraction conditions were as follows:ethanol concentration 60%(v/v),the ratio of material to solvent 1∶20(w/v),ultrasonic power 350 W,time 60 min.Under the above conditions,the total?avonoids yields could arrive 69.55 mg·g-1.Meanwhile,the optimized ultrasonic extraction processes was stable and feasible.In addition,it had several remarkable advantages,including time saving,high efficiency and easier-operation.
Artemisia sacrorum Ledeb.,ultrasonic extraction,total avonoids,extraction processes,orthogonal test design
硕士研究生(郝文芳教授为通讯作者,E-mail:haowenfang@nwsuaf.edu.com)。
*中国科学院“西部之光”人才培养项目(2008DF02)
2011-09-09,改回日期:2011-11-22
