复合酶法超声辅助提取高寒香菊花多糖*
2012-11-28敬思群张晓鸣
敬思群,张晓鸣
1(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡,214122)2(新疆大学生命科学与技术学院,新疆乌鲁木齐,830046)
复合酶法超声辅助提取高寒香菊花多糖*
敬思群1,2,张晓鸣1
1(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡,214122)2(新疆大学生命科学与技术学院,新疆乌鲁木齐,830046)
通过对复合酶超声辅助提取高寒香菊花多糖的工艺研究,以提取得率和纯度为指标,确定了适宜工艺条件。以未经酶解和未采用超声处理的多糖做对照,通过近红外光谱分析加酶及超声处理对高寒香菊花多糖结构的影响。结果表明:在复合酶2.5%(纤维素酶2.0%,酸性蛋白酶0.5%),酶解温度55℃,pH值4.5的条件下酶解2.0 h,多糖提取得率和纯度分别达到9.83%和28.58%,经聚酰胺柱纯化后纯度为64.57%。近红外光谱分析表明加酶和超声对多糖的结构没有显著影响,但提高了多糖提取得率。
复合酶,超声辅助提取,高寒香菊花多糖,光谱分析
高寒香菊(Coreopsis basalis)属一年生草本植物,全株无毛,叶羽状深裂,裂片线形,在我国主要分布于新疆海拔3 000 m左右的昆仑山区。高寒香菊降血压降血脂效果非常好,是一味能够治疗高血脂等心血管疾病的中草药[1-2]。文中对高寒香菊花多糖的提取工艺进行了研究。
1 材料与方法
1.1 材料、试剂与仪器
高寒香菊花,由新疆和田沙漠玫瑰有限责任公司提供;三氯甲烷、正丁醇、丙酮、浓硫酸、碘化钾、苯酚、磷酸氢二钠、柠檬酸等化学试剂,均为分析纯;聚酰胺,中国医药集团上海化学试剂公司;纤维素酶(40 000 U/g)和酸性蛋白酶(50 000 U/g),均购于杰诺生物科技有限公司。
AL104分析天平(Mettler-Toledo Group),RE-52AA旋转蒸发器(上海亚荣生化仪器厂),Anke TDL-5-A离心机(上海安亭科学仪器厂FZ102),SIM真空冷冻干燥设备(德国西门子公司),KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司),722S型分光光度计(上海安亭科学仪器厂),VERTEX70型红外光谱分析仪(BRUKER公司)。
1.2 方法
1.2.1 高寒香菊多糖提取工艺流程[3-5]
高寒香菊花→粉碎→过筛→加水混匀→调pH值→超声处理→加酶→灭酶→冷却→离心→收集上清液→去蛋白→浓缩→醇沉→洗涤→冷冻干燥→称重
1.2.2 操作要点
(1)原料预处理:将高寒香菊花放入50℃烘箱中干燥24 h取出磨成细粉,过80目筛,密封后保存。
(2)超声处理:精密称取高寒香菊花粉末1.0 g,置于100 mL三角瓶中,取5 mL水混均后,加10 mL磷酸氢二钠-柠檬酸缓冲溶液,调节pH值后进行超声处理(40℃,15 min,36 kHz)。
(3)酶解:按一定比例量取酸性蛋白酶和纤维素酶后混合,将混合酶液加入到高寒香菊溶液中,将加入酶液的溶液在55℃水浴锅中加热1 h后在90℃下灭酶10 min,冷却至室温。
(4)离心:将灭酶后的溶液在3 500 r/min下离心15 min,取上清液,按以上操作将残渣重复提取3次,合并上清液。
(5)去蛋白:上清液用 severag法[6][V(三氯甲烷)∶V(正丁醇)=5∶1]去蛋白。
(6)浓缩:将除去蛋白的多糖溶液浓缩至1/3。(7)乙醇醇沉:浓缩后的溶液加入5倍体积的95%的乙醇进行醇沉。
(8)洗涤:沉淀用无水乙醇洗涤3次。
(9)烘干称重:将得到的多糖进行冷冻干燥并称重。
1.2.3 酶活力的测定
酸性蛋白酶酶活按SB/T10317-1999测定,纤维素酶酶活按GB/T23881-2009测定。
1.2.4 高寒香菊多糖提取得率和纯度的计算
多糖含量测定采用硫酸-苯酚比色法,其标准曲线制作方法参考文献[7],得线性回归方程为:Y=0.003 5X -0.017 3(Y:吸光度,X:糖含量)。
1.2.4.1 高寒香菊多糖提取得率和纯度的计算

式中:W为高寒香菊多糖的提取得率,%;m1为提取得到的高寒香菊多糖质量,g;m2为原料质量,g。
1.2.4.2 高寒香菊多糖的纯化[8]
将得到的高寒香菊多糖滤液过聚酰胺柱。上柱时,聚酰胺用量为需脱色粗多糖的4倍,聚酰胺柱用1倍体积的去离子水以1.5 mL/min的流速进行洗脱。将纯化后样液移入250 mL容量瓶,定容。移取样品溶液1 mL置于具塞试管中,按照1.4.1方法测定吸光度(A),计算多糖含量。
纯化后高寒香菊多糖纯度计算

式中:C为高寒香菊多糖的纯度,%;m1为纯化后得到的高寒香菊多糖质量,g;m2为纯化前高寒香菊多糖提取物质量,g。
1.2.5 高寒香菊花多糖的光谱分析
分别取2 mg加酶超声处理、加酶未经超声处理、未经加酶超声处理、未加酶未采用超声处理的4组高寒香菊多糖干燥样品,与200 mg干燥的KBr粉末在红外灯下于玛瑙钵中轻轻研磨均匀,研磨均匀的粉末经压片机压成薄片后即可上机测定。测定条件:在500~4 000 cm-1内,扫描累积次数64次,分辨率4.0 cm-1,采集样品的红外光谱谱图。
2 结果与分析
2.1 两种酶的酶活
酸性蛋白酶和纤维素酶两种酶的酶活见表1。

表1 不同酶酶活力
2.3 复合酶超声辅助提取高寒香菊多糖工艺条件的优化
2.3.1 pH值对高寒香菊花多糖提取得率和纯度的影响
加入2%的纤维素酶和0.5%的酸性蛋白酶,在酶解温度55℃下酶解2.5 h,调节pH值分别为4.0、4.5、5.0、5.5、6.0,测定多糖提取得率和纯度。
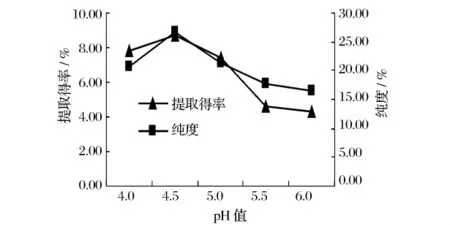
图1 pH值对高寒香菊多糖提取得率和纯度的影响
由图1可知,随着pH值的增加,高寒香菊花多糖的提取得率和纯度提高,在pH=4.5时高寒香菊花多糖的提取得率和纯度达到最大值,增大pH值,高寒香菊花多糖提取得率反而下降,纯度的变化趋势与提取得率相似,这可能是因为酶有其作用的最适pH值,高于此值,结构解离,活性降低,则提取得率降低。
2.3.2 温度对高寒香菊花多糖提取得率和纯度的影响
加入2%的纤维素酶和0.5%的酸性蛋白酶,调节 pH 值为4.5,在温度为 40、45、50、55、60℃下酶解2.5 h,测定多糖提取得率和纯度。
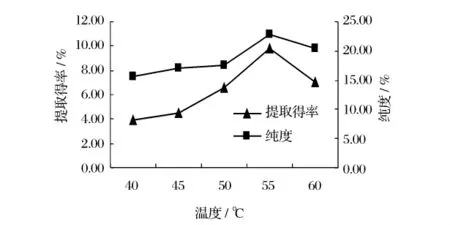
图2 温度对多糖提取得率和纯度的影响
由图2可知,随着温度的升高,高寒香菊花多糖的提取得率增加,在55℃时达到最高,但随着温度的继续升高,提取得率反而降低,这可能是因为酶的最适温度为55℃,在最适温度下酶的活性最大,提取得率最高,而高于最适温度,酶的活性降低,提取得率就降低。
2.3.3 时间对高寒香菊花多糖提取得率和纯度的影响
加入2%的纤维素酶和0.5%的酸性蛋白酶,调节pH 值为 4.5,在温度为 55℃下,酶解 1.0、1.5、2.0、2.5、3.0 h,测定多糖提取得率和纯度。
由图3可知,随着时间的延长,高寒香菊花多糖的提取得率增加,在90 min时提取得率达到最大值,但随着时间的继续延长,提取得率和纯度有所下降,考虑成本等因素,酶解时间选择90 min。
2.3.4 正交优化试验及方差分析
在复合酶提取高寒香菊花多糖单因素试验的基础上,选取提取温度、提取时间以及pH值为影响因素,以提取得率和纯度为考察指标,选用L9(34)正交表进行试验,用正交设计助手Ⅱv3.1.1统计软件进行结果分析。正交试验结果及分析见表2~表4。

图3 时间对多糖提取得率和纯度的影响
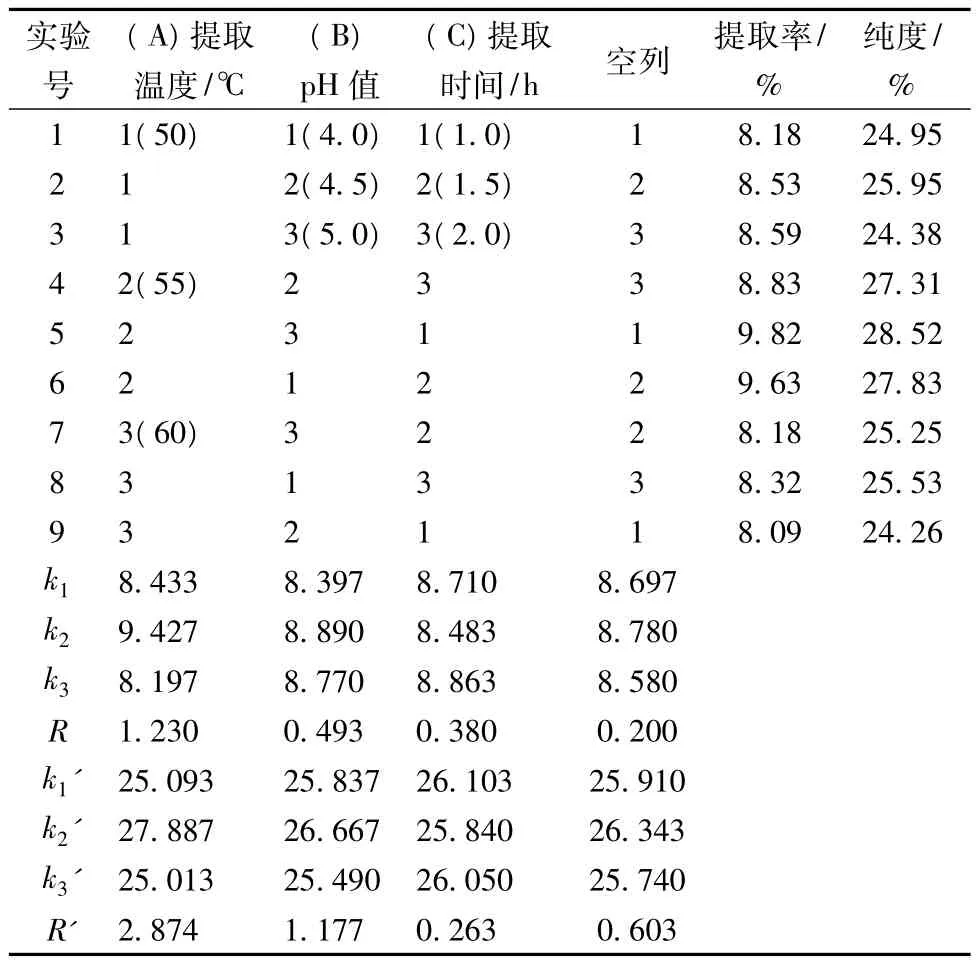
表2 正交实验设计及结果
由表2知,各因素对提取得率的影响顺序为A>B>C,即提取温度>pH值>提取时间。各因素对纯度的影响顺序也为A>C>B,即提取温度>提取时间>pH。比较k值的大小可以看出,高寒香菊花多糖提取工艺的优化条件是A2B2C3及A2B1C1,分别进行验证试验,采用A2B2C3组合得到高寒香菊花多糖提取得率为9.83%,纯度为28.58%;采用A2B1C1组合得到高寒香菊花多糖提取得率为9.78%,纯度为28.34%,因此取 A2B2C3为最优组合,即55℃,pH 4.5,提取时间2.0h,在此条件下得到的多糖经聚酰胺柱纯化后的纯度为64.57%。而经试验,用传统热水提取工艺得到金鸡菊多糖的提取得率仅为3.41%,可见利用加酶和超声技术可提高高寒香菊花多糖提取得率。

表3 以提取得率为考察指标的方差分析表

表4 以纯度为考察指标的方差分析表
由表3、表4可知,提取温度对提取得率和纯度在所考察的范围内影响显著,而pH值提取时间对提取得率和纯度在所考察的范围内影响不显著,因为酶的本质是蛋白质,其活性受温度的影响较大,其次pH值变化会引起其解离状态的变化。
酸性蛋白酶对植物中的游离蛋白质具有水解作用,可使植物结构变得松散,同时蛋白酶还会使糖蛋白和聚糖中游离蛋白质水解,降低了它们与原料的结合力,有利于植物多糖的浸出,但蛋白酶可分解蛋白质,对多糖纯度有一定影响。植物中纤维素含量普遍较高,纤维素酶是一种复合酶,纤维素酶可以破坏阻碍多糖溶出的细胞壁,是多糖便于溶出,缩短提取时间和周期,并将淀粉和纤维素质转化为糖类。纤维素酶和酸性蛋白酶复合可充分发挥各自的作用方式,有效增加提取得率,并缩短提取时间和周期。
2.4 加酶和超声技术对高寒香菊花多糖结构影响评价[9]
在500~4 000 cm-1波段范围内分别扫描加酶超声处理、加酶未经超声处理、未经加酶超声处理、未加酶未经超声的采用不同手段提取得到的4组高寒香菊花多糖样品,得到了4个红外光谱谱图,将这4个图进行叠加就得到4个高寒香菊花多糖红外光谱叠加效果图,(见图4)。
由图4可以看出,4组光谱图的重叠效果很好,说明四组多糖分子结构不存在显著差异,所以酶解和超声技术对高寒香菊花多糖结构无显著影响。

图4 四组高寒香菊花多糖红外光谱叠加效果图
3 结论
通过正交试验得出复合酶法超声提取高寒香菊花多糖的最佳工艺条件为:提取温度为55℃,pH 4.5,提取时间2.0 h,在此条件下,多糖提取得率为9.83%,纯度为28.58%,经聚酰胺柱纯化后多糖的纯度为64.57%。采用加酶和超声技术均可提高高寒香菊花多糖提取得率,但对高寒香菊花多糖的结构没有显著影响,因此利用加酶超声辅助提取高寒香菊花多糖手段是高效可行的。
[1] 梁淑红,庞市宾,刘晓燕,等.金鸡菊提取物降血脂作用的动物实验研究[J].农垦医学,2009,31(6):495-498.
[2] 刘伟新,邓继华,徐鸿.一种金鸡菊花的生药学研究[J].中国民族医药杂志,2009,15(1):24 -25.
[3] 刘小丽,徐鹏.酶水解辅助法浸提山药多糖的工艺研究[J].食品科技,2009,34(10):193 -196.
[4] 夏平,谢何青.复合酶法提取桑叶中多糖的工艺条件优化[J].安徽农业科学,2009,37(1):198-199.
[5] 李萍,孔明航.超声波协同纤维素酶提取山药多糖的工艺及组分测定研究[J].农产食品科技,2009,3(3):24-28.
[6] 徐任生.天然产物化学[M].北京:科学出版社,1997:475.
[7] 敬思群,关延新.温桲果实中多糖含量测定及纯化[J].食品科学,2008,29(3):229-232.
[8] 朱笃,曾庆桂,江玉梅,等.大孔树脂对金鸡菊黄酮吸附分离特性研究[J].食品科学,2006,26(10):420-423.
[9] 乐俊明,陈鹰,丁映.近红外光谱分析法测定烟草化学成分[J].贵州农业科学,2005,33(3):62-63.
Optimization Techniques for the Extraction of Polysaccharides from Coreopsis basalis Flower by Ultrasound-Assisted Compound Enzymolysis
Jing Si-qun1,2,Zhang Xiao-ming1
1(State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)2(College of Life Sciences and Technology ,Xinjiang University,Urumqi 830046 China)
With yield and purity of crude polysaccharide as evaluation indexes,the optimal extraction process conditions of polysaccharides from Coreopsis basalis flowers by ultrasoound-assisted compound enzymolysis was studied.Effect of enzymatic hydrolysis and ultrasonic treatment on the structure of Coreopsis basalis flowers polysaccharides was evaluated through the near infrared spectral analysis,no enzyme and ultrasound-assisted treatment was used as control.The results showed that the optimal extraction process conditions were:compound enzyme 2.5%(cellulase 2%,acid protease 0.5%),temperature 55℃,pH 4.5,2.0 h.Under these conditions,the yield of crude polysaccharide was up to 9.83%,purity was 28.58%,and the purity was up to 64.57%after polyamide column purification.The result of near infrared spectral analysis showed that enzymatic hydrolysis and ultrasonic assisted extraction technology had no significant effect on the structure of Coreopsis basalis polysaccharides,but they can improve the extraction yield of polysaccharides.
compound enzyme,ultrasonic assisted extraction,Coreopsis basalis flower polysaccharide,spectroscopy analysis
硕士,副教授(张晓鸣教授为通讯作者)。
2011-07-31,改回日期:2011-11-24
