灵芝孢子多糖提取工艺优化*
2012-11-28孟凡冰李云成张淑蓉曾晓漫钟耕
孟凡冰,李云成,张淑蓉,曾晓漫,钟耕,2
1(西南大学食品科学学院,重庆,400716) 2(重庆市特色食品工程技术研究中心,重庆,400715)
灵芝孢子多糖提取工艺优化*
孟凡冰1,李云成1,张淑蓉1,曾晓漫1,钟耕1,2
1(西南大学食品科学学院,重庆,400716) 2(重庆市特色食品工程技术研究中心,重庆,400715)
采用响应面分析法对灵芝孢子多糖的提取工艺进行优化。考察3个变量(水料比、超声温度、微波时间)对灵芝孢子多糖提取率的影响,并通过响应面设计法确定灵芝孢子多糖提取技术的最佳工艺条件为水料比20∶1,超声提取时间为55 min,微波(200 W,60℃)提取时间20 min,在此条件下测得多糖的提取率为2.23%。
灵芝孢子,响应面分析法,多糖,提取
灵芝(Ganoderma),是担子菌纲多孔菌科(Polyporaceae)灵芝属(Ganodelma)真菌赤芝(G.lucidum·karst)和紫芝(G.japonicrn L Loyd)的总称,灵芝孢子(Ganoderma lueidium sp.)是灵芝生长成熟期从菌盖弹射出来极其细小的袍子,为灵芝的生殖细胞,具有灵芝的全部遗传活性物质。它富含蛋白质(18.53%)及多种氨基酸(总量为6.1%),还含有丰富的多糖、萜类、生物碱、维生素等成分。破壁后的灵芝孢子粉具有显著的药理作用,它比灵芝实体具有更强、更全面的作用。灵芝孢子粉在抑制肿瘤、增强免疫力方面远远超过灵芝子实体,疗效相当于灵芝子实体的 75 倍[1-2]。
灵芝的多种药理活性大多和灵芝多糖有关,目前已分离到的灵芝多糖有200多种。灵芝多糖的主要生物活性有免疫调节作用、抗肿瘤作用、降血糖作用、抗辐射作用、抗氧化作用以及促进核酸和蛋白质的合成[4-8]。灵芝多糖主要分布于灵芝孢子中,毛泉明等[3]比较栽培灵芝与灵芝孢子粉的有效成分含量,结果表明,灵芝孢子粉的总多糖是栽培灵芝总多糖1.79倍。
目前灵芝多糖的提取方法主要是传统的水提醇沉法,还有膜分离法、酶解法、超声提取方法、微波提取方法等[4]。白在贤等人[8]利用水提醇沉法得到3个品种破壁灵芝孢子的多糖提取率分别为1.062%、1.076%和1.097%。胡斌杰[10]等人用正交超声提取,得到灵芝子实体多糖提取率为1.92%。但这些方法对灵芝多糖的提取率都相对较低,并且提取温度较高,不利于灵芝多糖的活性保持。
为了提高灵芝孢子多糖的提取率,避免部分多糖因提取温度过高而受到破坏和分解[11],最大限度的保持其活性,本文采用超声波结合微波提取法,并在相对较低的温度下进行提取。在预试验的基础上采用单因素和中心组合实验,用Box-Behnken软件绘制响应面曲线,并拟合出多元线性回归方程,以探寻灵芝孢子多糖提取的优化参数,旨在为开辟灵芝孢子多糖综合提取工艺路线提供理论参考。
1 实验材料和方法
1.1 实验材料
破壁灵芝孢子粉,破壁率达到99%,由重庆市生物技术研究所提供,产地为山东泰安。
1.2 仪器与试剂
PHG-9070A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;HH-4数显恒温水浴锅,金坛市富华仪器有限公司;Eppendorf 5810离心机,德国Eppendorf公司;KQ-250E超声波清洗器,昆山市超声仪器有限公司;MAS-Ⅱ型常压微波萃取仪,上海新仪微波化学科技有限公司;SHZ-D(Ш)型循环水多用真空泵,郑州市荣阳华盛仪器厂;R502B旋转蒸发仪,上海亚荣生化仪器厂;UV-2450紫外可见分光光度计,日本Shimadzu公司。
无水乙醇、硫酸、苯酚等所用试剂均为分析纯。
1.3 试验方法
1.3.1 提取工艺流程
破壁灵芝孢子粉在50℃下烘干至恒重→称取1g样品(精确到0.001g)→体积分数95%乙醇浸提24 h脱脂和除去低聚糖→真空抽滤→取滤渣按水料比加水配料→超声处理→微波处理(200 W,60℃)→真空抽滤→滤液60℃真空浓缩→浓缩物用95%乙醇4℃醇沉12 h→离心分离(6 000 r/min,15 min)→沉
淀物用50 g水溶解稀释→取1 mL测定多糖含量
1.3.2 灵芝孢子多糖的测定
以葡萄糖为标准溶液绘制标准曲线,采用苯酚-硫酸法[12-14]测定灵芝孢子多糖,其多糖提取率计算公式为:

1.3.3 单因素试验
分别以水料比、超声时间、微波时间为单因素进行试验,考察各单因素对灵芝孢子多糖提取率的影响。
1.3.4 响应曲面法试验设计[15-18]
在单因素试验基础上,根据Box-Behnken的中心组合设计原理,以灵芝孢子多糖含量为响应值,通过响应面分析对提取条件进行优化。试验因素与水平设计如表1所示。

表1 Box-Behnken设计响应面分析因素及水平表
1.3.5 数据处理
每个试验处理重复3次,以平均值表示,数据处理采用Excel和DPS7.05统计软件。
2 结果与分析
2.1 单因素试验[18-21]
2.1.1 水料比对多糖提取率的影响
参考有关文献,设计单因素水料比10∶1,15∶1,20∶1,25∶1,30∶1,固定超声时间 40 min,微波时间20 min,按照1.3.1工艺流程进行测定,考察水料比对多糖提取率的影响(见图1)。
由图1可知,水料比为20∶1时多糖的提取率达到最高值,当水料比大于30∶1时,多糖提取率有所上升,但均低于水料比为20∶1时的多糖提取率。在实际生产过程中,水料比越大,耗时耗能就越多,也不利于后续的纯化工序。故为了方便下一步的浓缩和提纯,本试验选择水料比为20∶1。2.1.2 超声时间对多糖提取率的影响
由预试验可知,料液在超声条件下处理60 min后,其提取液的温度仍不会超过40℃。本实验设计单因素超声时间为20,30,40,50,60 min,固定水料比20∶1,微波时间20 min,按照1.3.1工艺流程进行测定,考察超声提取时间对多糖提取率的影响。由图2可以看出,随着超声时间的延长,多糖的提取率在增大,但是在50 min后,增大效果不明显(P>0.05),为了最大限度的提取到多糖,故将超声时间设定在50 min左右。

图1 水料比对灵芝孢子多糖提取率的影响
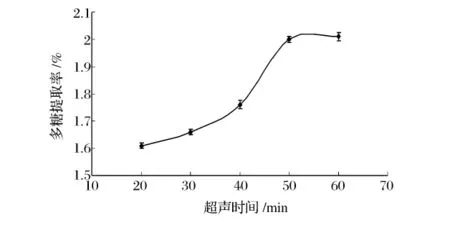
图2 超声时间对灵芝孢子多糖提取率的影响
2.1.3 微波时间对多糖提取率的影响
在微波条件下,高温和较大功率容易破坏多糖的结构以及加快多糖降解[20],从而使多糖活性降低。故本试验选择微波温度为60℃,功率为200 W,这样能有利于保护多糖。同时为了降低转移过程对多糖造成的损失,在室温下直接把用于超声处理的圆底烧瓶放在微波萃取仪中进行萃取。设计单因素微波时间5,10,15,20,25 min,固定水料比 20∶1,微波时间20 min。按照1.3.1工艺流程进行测定,考察微波提取时间对多糖提取率的影响。由图3以看出,微波时间在20 min左右时多糖的提取率达到最大,故选择微波条件为20 min(60℃,200 W)。
2.2 响应面法优化提取工艺条件
2.2.1 响应面试验设计
在单因素试验结果基础上,以水料比X1,超声时间X2,微波时间X3为自变量,以多糖提取率Y为响应值,进行响应面分析试验,试验结果见表2。

图3 微波时间对灵芝孢子多糖提取率的影响

表2 响应面设计方案及试验结果
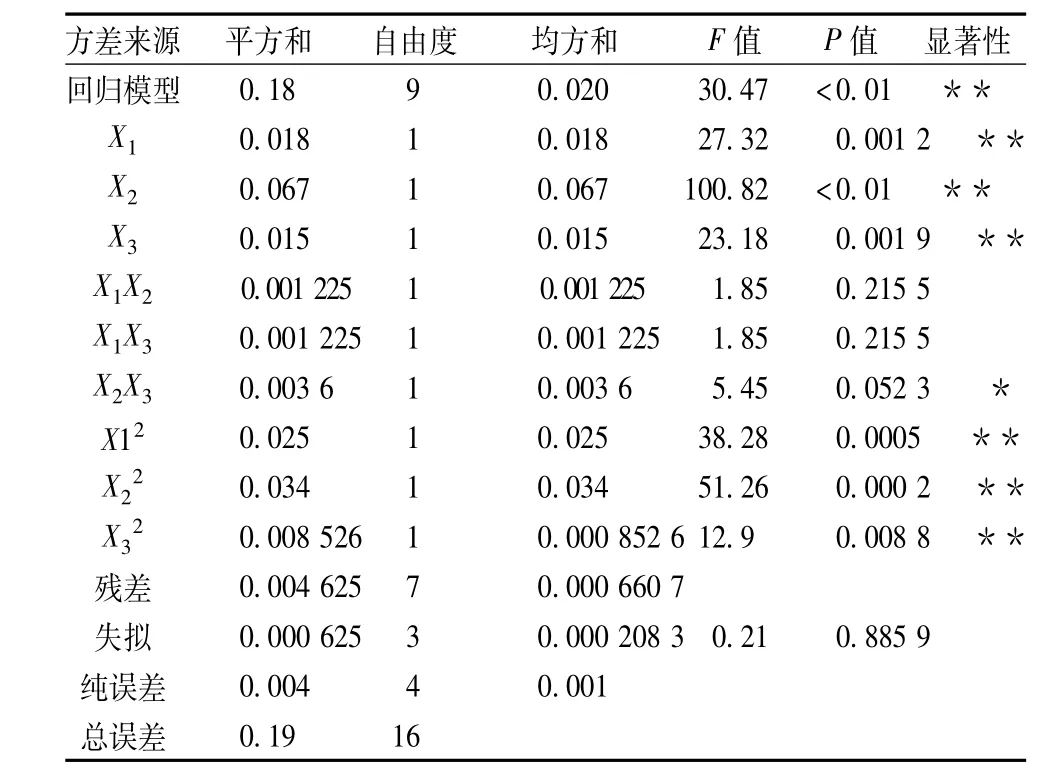
表3 响应面二次回归模型方差分析表
由表3可知,模型的一次项X1、X2、X3极显著,交互项 X2X3显著,X1X2、X1X3不显著,二次项 X12、X2
2、X32都是极显著,因此各个具体试验因子与响应值都不是简单的线性关系。
多糖提取率所建的回归模型P<0.01是极显著的,并且该回归模型的R2=0.975 1调整系数R2=0.943 1,模型与实际试验失拟项P=0.885 9不显著,说明试验拟合较好,试验误差小,可用该回归方程代替试验真实点对灵芝多糖提取率进行分析和预测。
2.2.2 拟合模型的建立
采用Design-Expert程序对表2所得数据进行回归分析,各因素经过回归拟合后,解得回归方程:

2.3 响应面图解
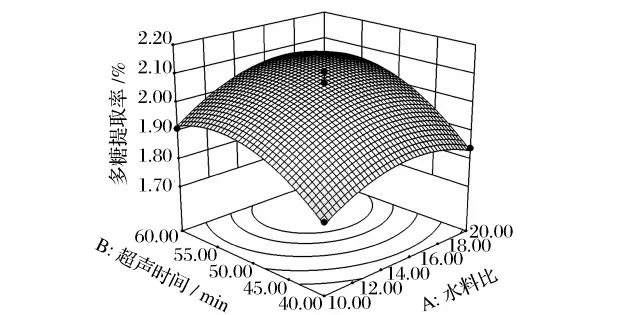
图4 水料比和超声时间对灵芝孢子多糖提取率影响的响应曲面
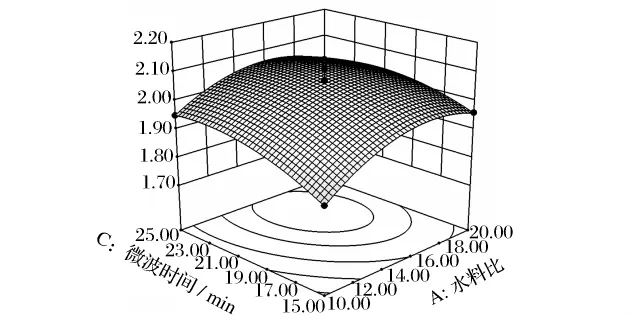
图5 水料比和微波时间对灵芝孢子多糖提取率影响的响应曲面
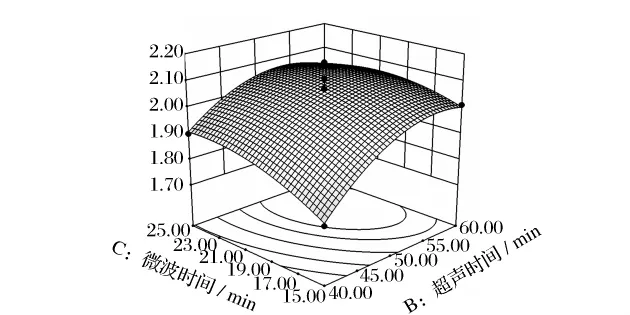
图6 超声时间和微波时间对灵芝孢子多糖提取率影响的响应曲面
由图4~图6可知,超声时间(X2)对灵芝孢子多糖的提取率影响最显著,表现为曲线较陡;水料比(X1)与微波时间(X3)次之,表现为曲线稍为平滑,随其数值的增加或减少,响应值变化不大。
通过软件分析,多糖提取的最佳条件为水料比为20∶1,超声时间为55.88 min,微波时间为20.48 min,在此条件下多糖提取率的理论值为2.27%,P=0.933。为了方便实际操作,将提取条件修正为水料比20∶1,超声时间55 min,微波时间20 min。在此条件下多糖提取的理论值为2.26%,而实际测得的提取率为2.23%,即与理论值的误差为1.35%,说明实际值与理论值基本相符,采用响应曲面法优化得到的超声波结合微波的提取条件参数,具有一定的实用价值。
3 结论
本实验在低温即尽可能的保留多糖活性的条件下,利用响应面优化实验条件,得到最优的提取条件为水料比20∶1,超声时间55 min,微波时间20 min(200 W,60℃),在此条件下灵芝糖的提取率达到了2.23%,具有较强的实用价值,为今后灵芝孢子多糖的工业化提取提供参考。
[1] 张伟,曾园山.灵芝孢子的研究进展[J].中西医结合学报,2004,2(6):463-465.
[2] 赵东旭,杨新林,朱鹤孙,等.灵芝孢子研究进展[J].中草药,1999,30(4):305-307.
[3] 毛泉明,叶福提,吴倩,等.栽培灵芝与灵芝抱子粉有效成分含量比较[J].药学实践杂志,1997,15(3):172-173.
[4] 向俊宇,徐安,夏懋,等.灵芝多糖的研究进展.药学实践杂志[J].2010,28(4):241-244.
[5] Liu X,Yuan J P,Chung C K,et al.Antitumor activity of the sporoderm-broken germinating spores of Ganoderma lucidum[J].Cancer Letters,2002,182(2):155-161.
[6] Shao B M,Dai H,Xu W,et al.Immune receptors for polysaccharides from Ganoderma lucidum[J].Biochemical and Biophysical Research Communications,2004,323(1):133-141.
[7] Zhang H N,Lin Z B.Hypoglycemic effect of Ganoderma lucidum polysaccharides[J].Acta Pharmacologica Sinica,2004,25(2):191-195.
[8] 杨睿悦,裴新荣,张召锋,等.海洋蛋白肽及其与灵芝多糖配伍的防辐射作用实验研究[J].食品与发酵工业,2008,34(5):1-5.
[9] 白在贤,周雪梅,韩塔娜,等.破壁灵芝孢子粉中多糖的含量测定[J].中国民族医药杂志,2006,4(2):36-39.
[10] 胡斌杰,韩艳霞,姬红.正交实验法超声提取灵芝多糖最佳工艺研究[J].中药材,2008,31(1):142-143.
[11] 陈小强,张志发,王川丕,等.热处理对高温煎煮和低温酶法提制绿茶多糖的影响[J].应用化学,2011,28(3):444-456.
[12] 李艳,赵海燕,吕建宁.灵芝多糖提取工艺研究[J].中成药,2006,28(7):1 052-1 054.
[13] 张志军,刘建华,李淑芳,等.灵芝多糖含量的苯酚硫酸法检测研究[J].食品工业科技,2006,27(2):193-195.
[14] 李坚,刘东波,夏志兰,等.分光光度法快速测定灵芝中多糖含量[J].湖南农业科学,2009(2):34-38.
[15] Lee S,Bae H,Kim N,et al.Optimization of growth conditions of Lentinus edodes Mycelium on corn processing waste using response surface analysis[J].Journal of Bioscience and Bioengineering,2008,105(2):161-163.
[16] Li Q H.,Fu C L.Application of response surface methodology for extraction optimization of germinant pumpkin seeds protein[J].Food Chemistry,2005,92(4):701 -706.
[17] Ferreira S L,Bruns R E,Ferreira H S,et al.Box-Behnken design:An alternative for the optimization of analytical methods[J].Analytica Chimica Acta,2007,597(2):179-186.
[18] 刘春泉,宋江峰,李大婧,等.响应曲面法优选灵芝子实体多糖的提取工艺[J].江苏农业学报,2007,23(3):239-243.
[19] 董艳红,李姝婧,郑惠华,等.响应曲面优化超声波提取灵芝多糖工艺研究[J].食品科学,2009,30(6):98-101.
[20] 李国香,戴军,朱松.等.微波辅助法提取赤灵芝孢子多糖及其相对分子质量分布分析[J].食品与发酵工业,2009,35(12):168-172.
[21] 张艳荣,单玉玲,刘婷婷,等.微波萃取技术在姬松茸多糖提取中的应用[J].食品科学,2006,27(12):267-270.
Optimization of Extraction Process of Polysaccharides from Ganoderma Lucidum Spore by Response Surface Analysis
Meng Fan-bing1,Li Yun-cheng1,Zhang Shu-rong1,Zeng Xiao-man1,Zhong Geng1,2*
1(College of Food Science,Southwest University,Chongqing 400716,China)
2(Engineering Technique Research Center of Chongqing for Special Food,Chongqing 400715,China)
This paper describes the optimization of extraction process of polysaccharides from Ganoderma lucidumspore by response surface analysis.The effects of three independent variables(namely,ratio of water to material,ultrasonic extraction time and microwave-assisted extraction time)on the yield of polysaccharides from Ganoderma lucidumspore were evaluated.Extraction ratio of water to material of 20:1,ultrasonic extraction time of 55 min,microwave-assisted extraction time of 20 min and were found optimum.Under these optimized conditions,the experimental value of Polysaccharides yield was 2.23%.
Ganoderma lucidum spore,response surface analysis,polysaccharides,extraction
硕士研究生(钟耕教授为通讯作者,E-mail:zhonggdg@126.com)。
*重庆市科技攻关计划项目(CSTC,2009AC5183)
2011-07-13,改回日期:2011-10-25
