PI3K与ERK1/2信号传导通路在吡格列酮保护大鼠心肌缺血再灌注损伤中的作用机制
2012-11-23赵永强隽兆东管英俊刘宝堂王永明
赵永强,隽兆东,管英俊,刘宝堂,王永明
(1.潍坊医学院附属医院 心胸外科,山东 潍坊261031;2.潍坊医学院 组织学与胚胎学教研室;3.潍坊市第二人民医院 胸外科)
曹泽玲等[1]研究表明吡格列酮对大鼠心肌缺血再灌注损伤有保护作用。王浩等[2]研究显示吡格列酮通过上调磷酸化ERK1/2表达,从而对大鼠心肌产生保护作用。我们的前期研究也表明吡格列酮通过激活Ras/PI3K/AKT信号转导通路发挥抗缺血再灌注心肌细胞凋亡作用。但两信号通路之间是否有联系以及如何联系国内尚未见报道。本研究采用培养Wistar大鼠乳鼠心肌细胞的缺氧复氧模型,观察PI3K与ERK1/2信号通路在吡格列酮介导大鼠心肌缺血再灌注损伤中的联系。
1 材料与方法
1.1 实验动物
一日龄Wistar大鼠乳鼠20只(Wistar大鼠由山东鲁抗实验动物中心提供)。
1.2 实验材料
吡格列酮(朵英),DMEM培养基、0.1%胰蛋白酶液(Solarbio),bs-2637R、bs-3016R免疫组化试剂盒、DAB显色试剂盒(北京博奥森),小鼠抗横纹肌肌动蛋白单克隆抗体、蛋白抽提试剂盒、ECL发光液(北京中杉金桥)。
1.3 实验方法
1.3.1 心肌细胞培养 按王强等[3]原代心肌细胞培养方法,依实验室条件加以改进。1-2日龄 Wistar大鼠乳鼠无菌条件下开胸取出心脏,剪取心室肌,剪碎至1mm3左右,0.1%的胰蛋白酶液振荡水浴(37℃)消化10min,沉淀取上清,按1∶1比例加含10%胎牛血清的低糖DMEM培养基终止消化,以1 000r/m的转速离心10min,弃上清,DMEM重悬 ,重复至消化完全。收集重悬液,差速贴壁法去除成纤维细胞,用培养基将细胞密度调整至(0.5%-1)×106/ml,接种至培养瓶中,放入培养箱培养,两天后换液。
1.3.2 分组及模型建立 实验分为四组:每组5只,大鼠乳鼠取出心脏按上述方法培养出心肌细胞,正常组(Co组)、缺血再灌注组(Ⅰ组)、Ⅰ组+吡格列酮预处理组(Pi组)、Pi组+PI3K 抑制剂LY294002组(Pi+LY组)。四组培养至第4日以后,换无血清低糖DMEM培养过夜。将无血清低糖DMEM培养基置三气培养箱(37℃,95%N2,5%CO2)无氧预处理30min。弃去原有培养基,加入2 ml预处理培养基,并按分组加入以下试剂:①Ⅰ组:2μl DMSO。②Pi:2μl吡格列酮使用液。③Pi+LY组:2μl吡格列酮使用液+2μl LY294002使用液。三组置三气培养箱(37℃,95%N2,5%CO2)缺氧处理3h,然后换含血清高糖DMEM转到常氧条件(37℃、5%CO2)复氧处理3h。Co组:2ml含血清高糖DMEM+2μl DMSO在常氧条件下培养。
1.3.3 免疫细胞化学法检测ERK1/2、p-ERK1/2细胞爬片长满80%左右时室温下冷丙酮固定20 min,PBS洗涤三次,3%H2O2阻断内源性过氧化物酶,37℃山羊血清封闭孵育后,分别滴加ERK1/2、p-ERK1/2抗体(1∶200),湿盒中4℃冰箱过夜,加入过氧化物酶标记羊抗鼠IgG(1∶500),DAB显色,镜下观察,适时终止反应,脱水透明封片,共聚焦显微镜下拍照,Image-pro plus 6.0软件分析得出 OD值。
1.3.4 Western-blotting定量检测p-ERK 1/2 细胞经洗涤后加入细胞裂解液,转移至离心管,超声破碎。4℃、12 000转/min离心15min,取上清。取部分样品酶标仪BCA法测定蛋白质浓度。样品中加入5×上样缓冲液,取90μg蛋白用12%SDSPAGE进行电泳。90V恒压将蛋白转到硝酸纤维膜(NC膜),转膜时间90min。室温下将NC膜用5%脱脂奶粉/0.01mol/L PBS封闭1h。加适当比例稀释的p-ERK1/2抗体,4℃冰箱孵育过夜。5%脱脂奶粉/0.01mol/L PBS漂洗3次/10min。加通用二抗,室温孵育2h。0.01mol/L PBS漂洗3次/10min。将化学发光剂ECL的增强液和稳定的过氧化物酶溶液1∶1比例混合后滴加到NC膜上,室温反应2min。暗室中感光及UVP凝胶成像系统拍照。Quantity One软件分析条带,得出光密度OD值。
1.4 统计学处理 应用SPSS 12.0软件进行统计处理。各组间用单因素方差分析(ANOVA),各组之间的两两比较用SNK-q检验。P<0.05有统计学意义。
2 结果
2.1 免疫组织化学法检测 ERK1/2(图1)与p-ERK1/2表达(图2)
ERK1/2在各组中的表达无显著差异(P>0.05);Pi组p-ERK1/2表达明显高于Ⅰ组与 Pi+LY组(0.1199±0.0211vs0.0827±0.0089,0.1199±0.0211vs 0.0920±0.0110,P<0.05),Ⅰ组p-ERK1/2表达也明显高于 Co组(0.0827±0.0089 vs 0.0669±0.0115,P<0.05)。
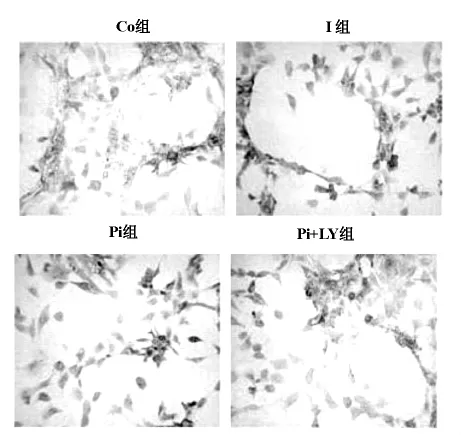
图1 免疫细胞化学法示ERK1/2(×200)在四组心肌细胞中的阳性表达
2.2 p-ERK1/2蛋白水平的表达变化(图3)
Western blotting结果显示,与Ⅰ组与Pi+LY组相比,Pi组明显升高(0.8858±0.0474vs0.4906±0.0106,0.8858±0.0474vs0.5630±0.0245,P<0.05),Ⅰ组表达明显高于 Co组(0.4906±0.0106 vs0.2707±0.0202,P<0.05)。

图2 免疫细胞化学法示p-ERK1/2(×200)在四组心肌细胞中的阳性表达
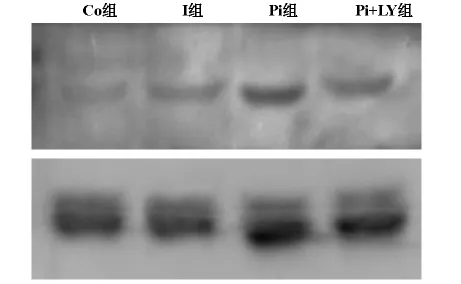
图3 四组内p-ERK1/2在蛋白水平的表达变化
3 讨论
近年来,随着溶栓疗法、动脉搭桥术、导管技术、经皮腔内冠脉血管成形术、心脏外科体外循环等方法的建立和推广,使心脏重新获得血液供应,明显减轻了细胞损伤,提高了临床疗效。但是,恢复血液再灌注后,患者细胞功能代谢障碍和结构破坏反而加重,因而将这种现象称为心肌缺血再灌注损伤(ischemia-reperfusion injury)。心肌缺血再灌注损伤的发生机制尚未完全阐明,目前认为细胞凋亡是心肌缺血再灌注损伤发病机制中的重要环节之一,主要与活性氧生成、钙超载、中性粒细胞激活、线粒体损伤等有关[4]。
Hausenloy DJ 等[5]把 PI3K-AKT、ERK1/2、JNK MAPK等信号途径在缺血再灌注损伤中的激活称为促生存激酶级联反应,或再灌注损伤救援激酶途径。已经证明激活上述再灌注损伤救援激酶可能减轻再灌注损伤中的细胞凋亡。1999年,Matsui T等[6]发现在某些条件下激活PI3K/Akt信号通路可有效抑制低氧诱导的心肌细胞凋亡发生,具有心血管保护作用的因子,如胰岛素[6]、促红细胞生成素[7]、刺五加[8]、瑞舒伐他汀[9]等均是通过激活PI3K/Akt通路抑制细胞凋亡发挥心血管保护作用。我们的前期研究表明与缺血再灌注损伤比较,吡格列酮组凋亡指数降低,磷酸化AKT表达明显增加,但这种变化被PI3K特异性抑制剂LY294002抑制;吡格列酮通过激活Ras/PI3K/AKT信号转导通路发挥抗缺血再灌注心肌细胞凋亡作用。同样王浩等[2]对吡格列酮通过ERK1/2信号通路抑制大鼠心肌缺血再灌注对心肌的损伤也进行了比较透彻的研究,研究显示缺血再灌注后,大鼠心肌磷酸化ERK1/2表达上调,吡格列酮上调磷酸化ERK1/2表达,从而对大鼠心肌产生保护作用。
PI3K和ERK1/2信号通路是膜受体信号向细胞内转导的重要途径,都调节着细胞生长、凋亡及一些细胞内重要基因的表达。吡格列酮分别通过这两条通路对大鼠心肌细胞缺血再灌注损伤产生保护作用的研究比较多,但两者在吡格列酮产生保护作用中的影响研究甚少。本实验研究显示:Pi组p-ERK1/2的表达水平明显高于Ⅰ组,而这种表达被PI3K特异性抑制剂LY294002抑制,这说明在吡格列酮保护大鼠心肌缺血再灌注损伤中还存在PI3K/ERK1/2信号传导通路。这为以后临床用药减轻心肌缺血再灌注对心肌的损伤提供了新的靶点。
[1]曹泽玲,叶 平,龙超良,等.吡格列酮对大鼠心脏缺血再灌注损伤的保护作用[J].中华临床药理学与治疗学,2005,10(10):1112.
[2]王 浩.PPARγ激动剂吡格列酮对大鼠心肌缺血再灌注损伤保护作用的机制研究[D].北京:中国人民解放军军医进修学院,2008.
[3]王 强,王东进,朱凌云,等.改良的原代心肌细胞培养方法[J].中国组织工程研究与临床康复,2007,11(6):1168.
[4]李 凯,郑世营.心肌缺血再灌注损伤与心肌细胞凋亡的研究进展[J].医学综述,2008,14(1):6.
[5]Hausenloy DJ,Yellon DM.New directions for protecting the heart against ischemia-reperfusion injury:targeting the Reperfusion Injury Salvage Kinase(RISK)pathway[J].Cardiovasc Res,2004,61(3):448.
[6]Matsui T,Li L,del Monte F,et al.Adenoviral gene transfer of activated phosphatidylinositol 3'-Kinase and Akt inhibits apoptosis of hypoxic cardio-myocytes in vitro[J].Circulation,1999,100:2373.
[7]Gao F,Gao E,Yue T L,et al.Nitric oxide mediates the antiapoptotic effect of insulin in myocardial ischemia-reperfusion:the roles of PI3-Kinase,Akt,and endothelial nitric oxide synthase phosphory1ation[J].Circulation,2002,105(12):1497.
[8]Cai Z,Semenza GL.Phosphatidylinositol-3-Kinase signaling is required for erythropoietin-mediated acute protection against myocardial ischemia/reperfusion injury[J].Circulation,2004;109(17):2050.
[9]刘宝堂,隽兆东,陈 峰,等.PI3K/AKT通路在刺五加保护大鼠缺血再灌注心肌细胞损伤中的作用[J].解剖科学进展,2010,16(3):249.
[10]Cai W,Fang J,Chen ZY,et al.Rosuvastatin enhances the protective effects of ischemic postconditioning on myocardial ischaemia-reperfusion injury in type 2diabetic rat[J].Zhonghua Xin Xue Guan Bing Za Zhi,2010,38(9):814.
