磷钨杂多酸银盐催化合成缩酮(醛)
2012-11-13魏云霞马明广李生英李康兰
魏云霞 马明广 李生英 李康兰
(兰州城市学院化学与环境科学学院,城市环境污染控制甘肃省高校重点实验室,兰州 730070)
磷钨杂多酸银盐催化合成缩酮(醛)
魏云霞 马明广*李生英 李康兰
(兰州城市学院化学与环境科学学院,城市环境污染控制甘肃省高校重点实验室,兰州 730070)
利用沉淀法制备了一系列磷钨杂多酸银盐(AgxH3-xPW12O40,0<x<3)。经XRD物相分析和d-间距组成图证明,产品为斜方晶系的完全互溶取代固溶体,结果符合Vegard定律。热分析证明,Agx的分解温度非常相似,而且银离子数越多,磷钨酸盐越稳定。以Agx为催化剂合成6种重要缩酮结果表明,催化剂的活性与结构中的酸性质子和水合银离子分离出的质子有关。催化剂Ag2H1PW12O40在合成缩酮的反应中催化活性最高。催化剂可重复使用。
磷钨酸;银盐;缩酮
0 前 言
基于分子设计,将传统杂多酸分子中的杂原子、多原子以及氢原子等取代,可得到新型的杂多酸及其盐[1-5]。在杂多酸盐中,对磷钨酸铯的研究最深入。调节磷钨酸和碳酸铯的物质的量之比进行反应,可制得x在0~3范围变化的CsxH3-xPW12O40酸式盐,而且其性质随x变化[6-7]。在x=2.5时,表面酸性最强,H0可达-13.16,是酸强度与纯的磷钨酸相近的超强酸。研究还表明[8-10],CsxH3-xPW12O40具有微孔结构,其孔径与x有关。通过精细调节x的值,制得具有选择性作用的固体超强酸催化剂。杂多酸盐分为A组和B组[11]。构成A组的金属离子体积较小,为水溶性盐。构成B组的金属离子体积较大为难溶性盐,例如,Ag+,NH4+,Cs+。B组的比表面积(5~200 m2·g-1)和孔体积(0.3~0.5 mL·g-1)较大,酸强度高(H0<-8.2)[12]。大多数B组杂多酸盐为超细粒子,具有较大的外表面积,质子能均匀分布在催化剂的表面,因而具有较多的表面酸中心。杂多阴离子对反应还可能具有协同作用[13]。显然,B组为更理想的固体酸催化材料。缩酮(醛)是一类重要化工原料,通常用于保护羰基或作为合成中间体[14],同时还是一类广为使用的香料。通常用于糖类物质的合成,食品、烟草、化妆品和制药工业等的中间体和目标产物,甚至用作特殊的反应溶剂[15]。因此,研究和开发缩醛的方法具有一定的意义。无机酸催化下的羟醛(酮)缩合是传统的合成缩酮(醛)的方法,但该法存在副反应多、产品纯度不高、产率不高[16],而且设备腐蚀严重、后处理中含有大量的酸性废水,造成环境污染等缺点。
杂多酸(盐)型催化剂是一类含有氧桥的多核无机高分子化合物,它是一种新型高效催化剂,不论在均相还是非均相体系中,均可作为性能优异的酸碱、氧化还原或双功能催化剂[17-20]。作者通过实验发现磷钨酸银盐对合成6种重要缩酮具有良好的催化活性,并对其进行了研究,得到了较为满意的结果。
1 实验部分
1.1 试剂及仪器
磷钨酸(H3PW12O40)分析纯,中国医药(集团)上海化学试剂公司;硝酸银,分析纯,成都化学试剂厂;乙醇(96%),天津化学试剂厂;乙二醇,1,2丙二醇,丁酮,丁醛,异丁醛,环己烷,(分析纯)天津化学试剂厂;无水MgSO4。实验用水为二次蒸馏水。
LXJ-64-01型高速离心机;DHG-9030型电热恒温鼓风干燥箱;U-3400日立近红外紫外分光光度计;岛津XRD-6000型X射线衍射仪(石墨单色器滤波,Cu靶Kα1辐射,管电压40 kV,管电流30 mA,扫描范围2θ=5°~60°);pyris Diamond TG/DTA型热分析仪(α-Al2O3作参比物,N2气氛,升温速率10℃· min-1)。DF-101S集热式恒温磁力搅拌器(巩义市英峪予华仪器厂),DIGILAB 5DX型傅立叶变换红外光谱仪(美国);WYA-2SAbbe折光仪(上海物理光学仪器厂),MERCUR400 plus核磁共振波谱仪(美国)(CDCl3为溶剂,TMS(四甲基硅烷)为内标)。
1.2 磷钨杂多酸银盐(Agx)的制备
以制备Ag2H1PW12O40为例:称取5g H3PW12O40溶解于15mL溶剂中(95%的乙醇与水等体积混合作为溶剂),室温搅拌下缓慢滴加20mL 0.2 mol·L-1AgNO3水溶液,继续搅拌反应30 min后静置,离心分离,所得固体物用蒸馏水反复洗涤后,于90℃干燥备用。
1.3 缩酮(醛)合成实验
于100 mL三颈瓶(配有温度计、分水器和回流冷凝管)中按一定计量比加入酮(醛)、醇、环己烷和催化剂,控温加热回流分水,冷却至室温,分离,弃水相,合并有机相。有机相用无水MgSO4干燥,收集规定沸程的馏分,即得无色透明具有果香味的液体产品。反应如下所示:
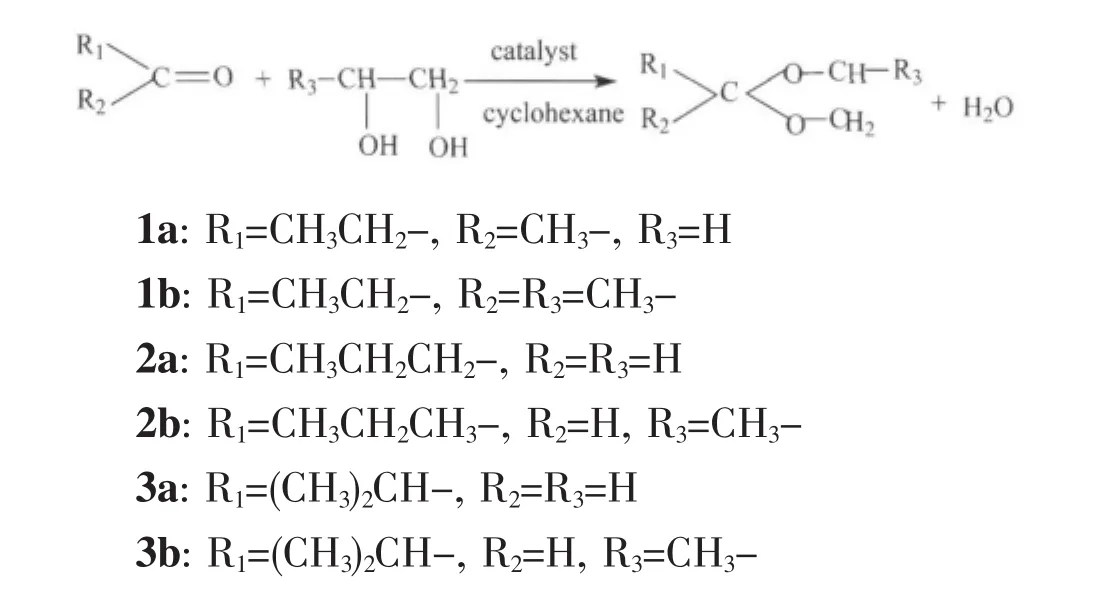
2 结果与讨论
2.1 催化剂的表征
2.1.1 X-射线粉末衍射(XRD)
对所合成的AgxH3-xPW12O40(0≤x≤3)分别进行XRD物相分析(图1),结果与H3PW12O40纯相图谱一致,属斜方晶系(JCPDS 38)。

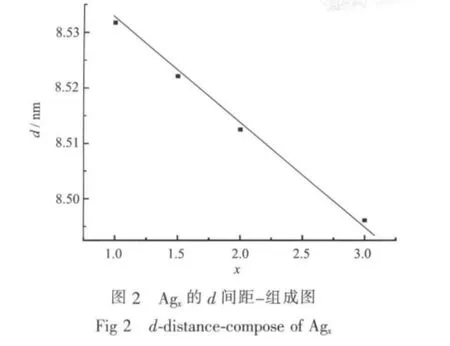
为了进一步验证固溶体的性质,测定了不同x值样品110晶面的d间距,并作了d-间距(110面)-组成图,近似得一直线,见图2,结果符合Vegard定律,即晶胞参数与组成呈线性变化[21],证明该固溶体为完全互溶取代固溶体。
2.1.2 差热分析(TG-DTA)
图3为磷钨酸系列银盐的热分析(DTA)图。从DTA图可以看出,Agx中Ag+是被水合的。银盐中存在3种形态的水,前两种属于杂多酸结构的特征。和纯的磷钨酸一样,Agx在100℃失去结晶水。这一点与银盐中银的含量无关。在300℃,随着银离子数目的增加,水合质子逐渐减少。磷钨酸二级结构中的水合质子被银离子完全取代时,水合质子完全消失。同时可以看出,磷钨酸系列银盐的热稳定性可达610℃。Agx的分解温度非常相似,从600到610℃,而且银离子数越多,磷钨酸盐越稳定。
2.1.3 Hammett法测定酸强度
将4种催化剂于300℃马弗炉中焙烧2 h,取出后用Hammett指示剂法迅速测定其酸强度。结果见表1。
从表1可以看出,Ag2和Ag3都具有较强的酸强度,H0均小于-11.35。而且随着H3PW12O40中质子数目的减少酸强度却增强,说明Ag2和Ag3中有额外的质子产生。

2.2 合成缩酮(醛)的表征
合成缩酮(醛)的红外光谱,1H核磁谱数值列于表2。经对照,各产物对应的光谱值分别与各缩酮(醛)标准谱图对应一致,说明合成的产品为目标产物。
2.3 Ag x H3-x PW 12O40催化合成缩酮(醛)的研究
2.3.1 催化剂的选择
以合成丁酮乙二醇缩酮(1a)为例。为了验证磷钨酸系列盐(Agx)中x对缩合反应收率的影响,固定丁酮为7.2 g,酮醇物质的量比为1∶1.5,带水剂环己烷10 mL,催化剂用量为反应物总质量的0.5%,反应90min。缩合反应结果见图4。
结果表明随着x的增大缩酮收率也增大,当x= 2时收率最高。继续增大时收率反而下降。归其原因,一方面可能与比表面积有关[22];另一方面可能是,Agx有额外的质子产生。从图4可以看出,磷钨酸二级结构中的质子被Ag+全部取代时催化剂的活性仍很高,所以Agx必定产生质子。对Agx的热分析可知,Ag+是被水合的,当x越大,裸水合质子的数目就越少,同时与Ag+水合的水分子数目越多,释放的质子就越多。
水合金属离子产生额外质子的化学方程式如下所示[3]:
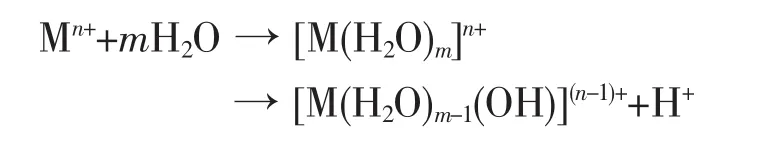
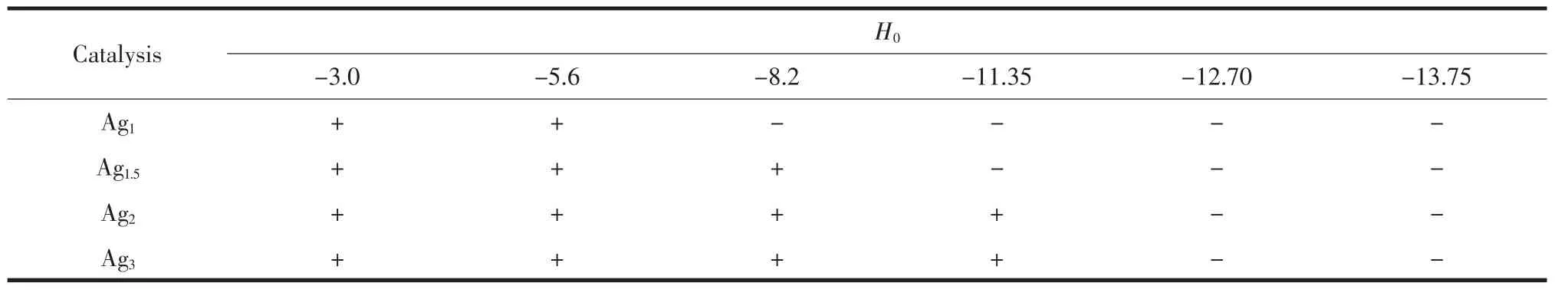
表1 Ag x的Hammett酸强度Table 1 Hammett acid strength of Ag x

表2 产品的红外光谱及核磁共振谱数据Table 2 IR and 1HNMR spectra of 6 classes of acetals or ketals

所以本实验中以Ag2H1PW12O40为催化剂进行研究。
2.3.2 最佳反应条件
不同反应条件对缩酮产率的影响列于表3。
从表3中可以看出,当催化剂用量为反应物总质量的1%时,固定丁酮用量,加入10mL环己烷为带水剂,变化乙二醇的用量,控制回流温度反应60 min考察不同酮醇物质的量比对产品收率的影响。结果表明,增加乙二醇的用量有利于提高产物的收率,当丁酮与乙二醇的物质的量比为1∶1.5时,收率最高;若继续增加乙二醇的量,收率反而下降。因此,丁酮与乙二醇的最佳物质的量比确定为1∶1.5。
在确定丁酮与乙二醇的物质的量比为1∶1.5后,改变催化剂的用量考察其对产物收率的影响,结果表明,本实验中催化剂的最佳用量为0.5%。从表中还可以看出,实验进行到90min时基本完成。
2.3.3 其它6种缩酮(醛)的合成
分别以Ag2H1PW12O40和H3PW12O40为催化剂,固定醇酮物质的量比为1.5∶1,催化剂用量0.5%,反应90min合成其它缩酮(酮)。结果示于表4。从表中可以看出,在相同条件下合成缩酮,Ag2H1PW12O40的催化活性远远高于H3PW12O40的。
催化剂(Ag2H1PW12O4)经去离子水洗,100℃干燥后,可重复使用。结果列于表5。从表5可以看出,虽然催化剂在合成六种缩酮(醛)的反应中具有很高的催化活性,但是该催化剂寿命较短,连续使用产品的收率迅速下降。
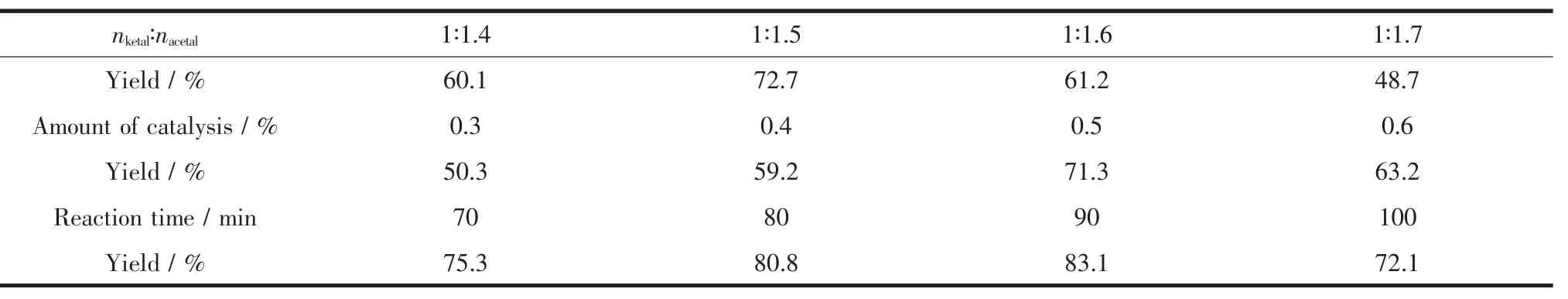
表3 不同反应条件对缩酮产率的影响Table 3 Effect of different reaction condition on the yield of ketal

表4 其它6种缩酮(醛)的合成数据Table 4 Yields of ketal

表5 催化剂重复使用对缩酮(醛)收率的影响Table 5 Effect of reusing of catalyst on the yield of ketal
[1]TATEMATSU S,HIBIT,OKUHARA T,et al.Chem.Lett., 1984,13(6):865-868
[2]McGarvey G B,Moffat JB.J.Cataly.,1991,128(1):69-83
[3]Ganapathy S,Fournier M,Paul J F,et al.J.Am.Chem., 2002,124:7821-7828
[4]LIWei-Yuan(李威渊),LIU Yuan-Yuan(刘媛媛),ZHANG Hua-Yan(郑华燕),et al.Chem.Ind.Eng.Prog.(Huagong Jinzhan),2010(2):243-249
[5]Corma A,Martnez A,Martnez C.J.Catal.,1996,164(2): 422-432
[6]Gayraud PY,Essayem N,Védrine JC.Catal.Lett.,1998,56 (1):35-41
[7]HEHe-Yong(贺鹤勇),ZOUYan(邹艳),MA Zho-Na(马卓娜), et al.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2004, 20(S1):1024-1031
[8]Tian J,Fang C,Cheng M,et al.Chem.Eng.Technol., 2011,34:482-486
[9]Zhang JZ,Sun M,Cao C J,et al.Appl.Catal.A:General, 2010,38(1/2):87-94
[10]Okuhara T,Watanabe H,Nishimura T,et al.Chem.Mater., 2000,12(8):2230-2238
[11]WANG En-Bo(王恩波),HU Chang-Wen(胡长文),XU Lin (许林).Introduction to Heteropolyacidic Chemistry:Vol.175 (多酸化学导论:第 175卷).Beijing:Chemical Industry Press,1997:36-37
[12]Corma A.Curr.Opin.Solid StateMateri.Sci.,1997,2:63-75
[13]JoshiM V,Narasimhan C S.J.Catal.,1989,120:282-286
[14]Srikrishna A,Viswajanani R.Tetrahedron,1995,51:3339-3344
[15]Lloyd AW.Drug Discovery Today,1996,1:219-220
[16]Yang SJ,Yu XQ,BaiAM.RareMetals,2005,24:22-27
[17]Ferrell JR,Kuo M C,Turner JA,et al.Electrochim.Acta, 2008,53:4927-4933
[18]Mansilla D S,Torviso M R,Alesso E N,et al.Appl.Catal. A:General,2010,375:196-204
[19]ZHAO Zhong-Kui(赵忠奎),LI Zong-Shi(李宗石),WANG Gui-Ru(王桂茹),et al.Prog.Chem.(Huaxue Jinzhan), 2004,16(4):620-630
[20]LIXiu-Kai(李秀凯),LEIYu(雷宇),ZHAO Jing(赵静),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Hauxue Xuebao),2005,26(9):1716-1721
[21]West A R,Translated by SU Mian-Zeng(苏勉曾),XIE Gao-Yang(谢高阳),SHEN Pan-Wen(申泮文).Solid Chemistry and its application:Vol.407(固体化学及其应用:第407卷). Shanghai:Fudan University Press,1989.
[22]Okuhara T.Catal.Today,2002,73:167-176
Synthesis of Ketal Catalyzed w ith Silver Salts of Tungstophosphoric
WEIYun-Xia MA Ming-Guang*LISheng-Ying LIKang-Lan
(Provincial Key Laboratory of Urban Environmental Pollution Control,College Chemistry and Environmental Science,Lanzhou City University,Lanzhou 730070,China)
A series of silver salts of 12-tungstophosphoric acid A gxH3-xPW12O40(Agx) (where 0<x<3),were prepared.XRD and cell parameters-component figures of the series of the solid solutions powder that the compounds aremutuallymiscible in the solid solutions.Furthermore,DTA show that,the temperature for the Agxdecomposition is very similar.The catalytic activity for the formation of ketalswas also studied.Itwas found that the Ag2H1PW12O40is the best catalyst in the reaction.The results showed that catalystic activity is related to acid protons and protons generated by dissociation ofwatermolecules coordinated by silver cations.
dodecatungstophosphate;silver salt;ketal
TQ426.91
A
1001-4861(2001)09-1909-05
2012-02-21。收修改稿日期:2012-05-03。
兰州城市学院2011年度博士科研启动基金资助项目。
*通讯联系人。E-mail:mamg-001@163.com
