Vasostatin基因对胰腺癌内皮细胞迁移的影响
2012-11-06李雷刘军宛新建陆伦根郑萍董育玮黄春兰王兴鹏袁耀宗
李雷 刘军 宛新建 陆伦根 郑萍 董育玮 黄春兰 王兴鹏 袁耀宗
·论著·
Vasostatin基因对胰腺癌内皮细胞迁移的影响
李雷 刘军 宛新建 陆伦根 郑萍 董育玮 黄春兰 王兴鹏 袁耀宗
目的观察Vasostatin基因表达对胰腺癌内皮细胞迁移能力的影响。方法应用不同浓度的载有Vasostatin基因的腺病毒(Ad-vasostatin)感染胰腺癌内皮细胞,以Ad-lacZ感染及磷酸盐缓冲液(PBS)作为对照组。应用损伤修复、Transwell小室、小管形成3种不同方法观察胰腺癌内皮细胞迁移能力的变化及其与感染病毒的量效关系。结果培养48 h后,PBS组与Ad-lacZ组的划痕损伤区域几乎完全恢复;而Ad-vasostatin组的划痕损伤区域无明显恢复。以MOI 1、2、5感染细胞,Ad-lacZ组的迁移率分别为(84.7±2.6)%、(80.7±1.7)%和(81.3±4.0)%;Ad-vasostatin组为(77.7±2.1)%、(67.3±2.1)%和(38.8±2.1)%,Ad-vasostatin呈剂量依赖性抑制细胞迁移率,MOI=5时的细胞迁移率大幅度降低(F=180.88,P<0.05)。以MOI 1、5、10感染时,Ad-lacZ组的小管形成数分别为(118±6)、(120±6)、(82±5)个;Ad-vasostatin组为(65±4)、(21±4)、(4±1)个,Ad-vasostatin呈剂量依赖性抑制胰腺癌内皮细胞的小管形成,在MOI=10时已很难形成管状结构(F=300.85,P<0.05)。结论Vasostatin基因能显著抑制胰腺癌内皮细胞的体外迁移能力,且呈剂量依赖性。
胰腺肿瘤; 细胞运动; 内皮细胞; 血管生成抑制剂
血管生成是一个多步骤的复杂过程,其中血管内皮细胞的增殖和迁移是血管生成的关键步骤[1]。我们既往的研究发现,腺病毒介导的Vasostatin 基因对人胰腺癌裸鼠移植瘤生长具有抑制作用,并可显著抑制体内、外血管生成与裸鼠移植瘤的血管生成,明显抑制人脐静脉血管内皮细胞的体外增殖并诱导其凋亡[2-3]。本研究应用携带Vasostatin基因的腺病毒感染胰腺癌内皮细胞,观察其对内皮细胞迁移的影响。
材料与方法
一、胰腺癌内皮细胞及腺病毒
胰腺癌内皮细胞由本实验室前期分离、纯化,并鉴定[4]。采用含20%胎牛血清、10 ng/ml内皮细胞生长因子(Sigma公司)的专用培养液M131(Cascade公司)常规培养、传代。携带Vasostatin基因的腺病毒Ad-vasostatin与对照病毒Ad-lacZ由本实验室前期获得[2]。
二、损伤修复实验[5]
胰腺癌内皮细胞在6孔板中培养至90%融合后改无血清培养3 h,用移液头划个直痕,无血清M131洗两次,在含2%胎牛血清的M131培养液中分别加入PBS、Ad-vasostatin(MOI=5)和Ad-lacZ(MOI=5)培养0、12、24、48 h,显微镜观察直痕闭合状况。实验重复3次。
三、Transwell小室实验[6]
分别以PBS、Ad-vasostatin(MOI=1、2、5、10)和Ad-lacZ(MOI=1、2、5、10)感染胰腺癌内皮细胞24 h。收集细胞并重悬于无血清M131培养液,终浓度为5×105个/ml。取100 μl细胞悬液置于Transwell小室(Corning公司)上层,下层为含1%胎牛血清的M131培养液,置37℃培养12 h。取出滤膜,轻擦去上层的未穿膜细胞,摄片,中性甲醛固定,结晶紫(Sigma公司)染色。镜下计穿膜细胞数,穿膜细胞与总细胞数的百分值为迁移率。实验重复3次。
四、小管形成实验[2-3]
在无菌离心管内将冰上过夜融化的100 μl 10×缓冲液和900 μl ECMatrix溶液缓慢混匀,分别取50 μl加入预冷的96孔板的每孔中,37℃孵育1 h使其凝固,作为小管形成培养基。用MOI为1、5、10的Ad-lacZ和Ad-vasostatin感染细胞24 h,接种入96孔板,每孔5×104个细胞。常规培养6 h后倒置显微镜下每孔随机取5个视野,记录形成管状结构的总量。每组设3个复孔,实验重复3次。
五、统计学方法
结 果
一、细胞损伤的修复
随着时间的推移,对照组与Ad-lacZ组的迁移细胞数逐渐增加,划痕损伤区域逐渐得以修复,48 h时几乎达到完全恢复;而Ad-vasostatin组仅见少数细胞迁移,且迁移的距离较短,划痕损伤区域无明显恢复(图1)。

图1PBS组(上)、Ad-lacZ组(中)和Ad-vasostatin组(下)单层胰腺癌内皮细胞损伤的修复(×40)
二、细胞迁移率
以MOI 1、2、5感染细胞,Ad-lacZ组的迁移率为(84.7±2.6)%、(80.7±1.7)%和(81.3±4.0)%;Ad-vasostatin组为(77.7±2.1)%、(67.3±2.1)%和(38.8±2.1)%(图2),呈剂量依赖性抑制细胞迁移率。Ad-vasostatin组细胞的迁移率在MOI为2时较Ad-lacZ明显减少(F=8.82,P<0.05);MOI为5时的细胞迁移率大幅度降低(F=180.88,P<0.05)。
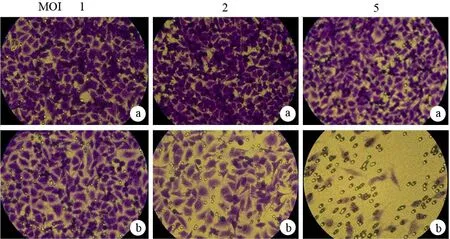

图2Ad-lacZ组(a)、Ad-vasostatin组(b)和PBS组(c)的穿膜细胞(×100)
三、小管形成数量
PBS组细胞在ECMatrix上呈线形排列,形成中空的管状结构约120个左右。以MOI 1、5、10感染,Ad-lacZ组的小管形成数为(118±6)、(120±6)、(82±5)个;Ad-vasostatin组为(65±4)、(21±4)、(4±1)个(图3),呈剂量依赖性抑制胰腺癌内皮细胞的小管形成。Ad-vasostatin组在MOI为1时小管形成即显著减少(F=102.4,P<0.05);MOI为5时小管形成进一步减少(F=476.17,P<0.05);MOI为10时已很难形成管状结构(F=300.85,P<0.05)。

图3Ad-lacZ组(a)、Ad-vasostatin组(b)和PBS组(c)细胞形成的小管(×100)
讨 论
肿瘤抗血管生成研究多是以人脐静脉血管内皮细胞或其他正常组织血管内皮细胞为研究对象的[2,7]。这是一种间接的、模拟的研究,并受到多种因素制约与干扰。随着细胞分离技术的日益成熟,肿瘤内皮细胞(tumor endothelial cells,TEC)的概念浮出水面。TEC是形成肿瘤内部新生血管的、增殖活跃的血管内皮细胞,是肿瘤血管生成的基本单位,也是肿瘤抗血管生成治疗的靶细胞[8]。我们前期已成功分离,纯化了胰腺癌TEC[2],并报道Ad-vasostatin转染可以抑制人脐静脉血管内皮细胞的增殖,诱导其凋亡[2-3]。本研究采用Ad-vasostatin感染胰腺癌内皮细胞,结果显示,Ad-vasostatin感染后,胰腺癌内皮细胞的损伤修复被抑制、穿膜细胞数量明显减少,难以形成管腔结构,从不同层面证实Vasostatin能明显抑制胰腺癌内皮细胞的迁移,且具有剂量依赖性,表明Vasostatin基因对胰腺癌的抗血管生成作用不但归因于其对血管内皮细胞增殖的抑制,而且归因于其对血管内皮细胞迁移的抑制。
[1] Lamalice L, Le Boeuf F, Huot J. Endothelial cell migration during angiogenesis. Circ Res,2007,100:782-794.
[2] Li L, Yuan YZ, Lu J, et al. Treatment of pancreatic carcinoma by adenoviral mediated gene transfer of vasostatin in mice.Gut,2006,55:259-265.
[3] 李雷,袁耀宗,章永平,等.Vasostatin基因对胰腺癌细胞和血管内皮细胞增殖的影响.胰腺病学,2006,6:12-15.
[4] 李雷,刘军,陆伦根,等.胰腺癌内皮细胞的分离纯化及鉴定.胃肠病学,2001,16:654-657.
[5] Lai FP,Szczodrak M,Oelkers JM,et al.Cortactin promotes migration and platelet-derived growth factor-induced actin reorganization by signaling to Rho-GTPases.Mol Biol Cell,2009,20:3209-3223.
[6] Lu N, Gao Y, Ling Y, et al. Wogonin suppresses tumor growth in vivo and VEGF-induced angiogenesis through inhibiting tyrosine phosphorylation of VEGFR2.Life Sci,2008,82:956-963.
[7] Pratheeshkumar P, Kuttan G. Andrographolide inhibits human umbilical vein endothelial cell invasion and migration by regulating MMP-2 and MMP-9 during angiogenesis.J Environ Pathol Toxicol Oncol,2011,30:33-41.
[8] Hida K, Klagsbrun M. A new perspective on tumor endothelial cells: unexpected chromosome and centrosome abnormalities.Cancer Res,2005,65:2507-2510.
Inhibitoryeffectofvasostatinonmigrationofpancreaticcancerendothelialcells.
LILei,LIUJun,WANXin-jian,LULun-gen,ZHENGPing,DONGYu-wei,HUANGChun-lan,WANGXing-peng,YUANYao-zong.
DepartmentofGastroenterology,ShanghaiFirstPeople′sHospital,ShanghaiJiaotongUniversity,Shanghai201620,China
LILei,Email:lilei2968900@hotmail.com
ObjectiveTo investigate the effect of vasostatin on the migration of pancreatic cancer endothelial cells.MethodsAd-vasostatin with different concentrations of vasostatin was used to transfect pancreatic cancer endothelial cells. Ad-LacZ transfection and PBS was used as control. The effect of vasostatin gene mediated by adenovirus on the migration of pancreatic cancer endothelial cells was measured by wound-healing assay, transwell migration assay, and tube formation assay.ResultsThe scratched lines in PBS group and Ad-LacZ group were almost healed 48 hours later, while the lines in Ad-vasostatin group were rarely healed. At the MOI of 1, 2, 5, the migration rate of Ad-Laz group was (84.7±2.6)%, (80.7±1.7)% and (81.3±4.0)%, while the corresponding values were (77.7±2.1)%, (67.3±2.1)% and (38.8±2.1)% in Ad-vasostatin group. Transwell migration assay indicated that the number of migrated cells in Ad-vasostatin group was inhibited in a dose-dependant manner, at the MOI of 5, the migration became significantly decreased (F=180.88,P<0.05). At the MOI of 1, 5, 10, the number of tubes in Ad-LacZ group was 118±6,120±6 and 82±5, while the corresponding values were 65±4, 21±4 and 4±1 in Ad-vasostatin group. The number of tubes of pancreatic cancer endothelial cells was inhibited by Ad-vasostatin in a dose-dependant manner, at the MOI of 10, it was difficult to form the tubes (F=300.85,P<0.05).ConclusionsThe vasostatin gene mediated by adenovirus has a significant inhibitory effect on the migration of pancreatic cancer endothelial cells in vitro in a dose-dependent manner.
共同第一作者:刘军
Pancreatic neoplasms; Cell movement; Endothelial cells; Angiogenesis inhibitors
10.3760/cma.j.issn.1674-1935.2012.01.006
国家自然科学基金(81072006);上海市自然科学基金(07ZR14063);国家留学基金(2009831457);上海交通大学医学院“新百人计划”
201620 上海,上海交通大学附属第一人民医院消化科(李雷、宛新建、陆伦根、郑萍、董育玮、黄春兰、王兴鹏);复旦大学附属肿瘤医院(刘军);上海交通大学医学院附属瑞金医院消化科(袁耀宗)
李雷,Email:lilei2968900@hotmail.com
2011-08-17)
(本文编辑:屠振兴)
