六株乳杆菌胃肠道定植能力分析
2012-11-04罗学刚张同存
郝 冉,罗学刚,贾 玮,李 方,张同存,2
(1.天津科技大学 生物工程学院 工业发酵微生物教育部及天津市重点实验室,天津 300457;2.武汉科技大学 医学院,湖北 武汉 430065)
六株乳杆菌胃肠道定植能力分析
郝 冉1,罗学刚1,贾 玮1,李 方1,张同存1,2
(1.天津科技大学 生物工程学院 工业发酵微生物教育部及天津市重点实验室,天津 300457;2.武汉科技大学 医学院,湖北 武汉 430065)
目的 分析确定Lactobacillus Acidophilus(L.acidophilus)1.1等六株乳杆菌胃肠道定植能力强弱。方法通过模拟人体胃酸环境(pH 3)和高胆盐环境(胆盐含量:0.1% ~0.3%),及用胶原蛋白和人结肠癌细胞SW-480模拟人肠道黏附环境,利用MTT法分别测定六株乳杆菌在酸性和高胆盐环境下37℃作用4 h后的存活菌率及与黏附介质作用1 h后的黏附率。结果 六株乳杆菌均具有一定的耐酸和耐胆盐能力,以及不同程度的胶原蛋白及肠道细胞黏附能力,其中以L.acidophilus1.2相对最为突出。结论 L.acidophilus 1.2等六株乳杆菌均能够不同程度的黏附定植在胃肠道中,发挥其益生作用,是较为理想的胃肠道微生态制剂候选菌株。
乳杆菌;耐酸;耐胆盐;黏附;定植
乳酸菌在人体胃肠道内的定植能力和存活能力的高低将直接关系到其益生作用的发挥。乳酸菌能否在人体内定植存活主要与其耐酸耐胆盐能力和肠道黏附能力有关[1]。本研究通过模拟人体胃酸环境及肠道高胆盐环境,测定了六株乳杆菌的耐酸、耐胆盐能力;同时用胶原蛋白和人结肠癌细胞SW-480模拟人肠道黏附环境,测定了不同乳酸菌对细胞外基质及肠道细胞黏附能力的差异,为筛选具有较高人体胃肠道存活定植能力的乳酸菌菌株,进而开发相应微生态制剂及功能食品奠定基础。
1材料
1.1 菌株和细胞
嗜酸乳杆菌 (Lactobacillus acidophilus,L.acidophilus)1.1、1.2,干酪乳杆菌(L.casei)1.2435、1.539,清酒乳杆菌(L.sake),植物乳杆菌(L.plantarum),人结肠癌细胞SW-480,均为本实验室在前期研究中所保存。
1.2 培养基
MRS培养基采用常规方法配制[2]。MRS低pH液体培养基:用0.1 mol/L盐酸将MRS液体培养基pH调整到3,115℃高压灭菌30 min。MRS高胆盐液体培养基:用猪胆盐将MRS液体培养基胆盐含量调整为1~3 g/kg(0.1% ~0.3%),115 ℃高压灭菌30 min。
细胞培养基:含10%灭活小牛血清的DEME低糖培养基。
1.3 试剂
四甲基偶氮唑盐(MTT)溶液的配制:MTT 100 mg,加 pH 7.2、0.01 mol/L 磷酸盐缓冲液(PBS)20 mL,使其充分溶解,用0.22μm微孔过滤器除菌,分装于1.5 mL的EP管中,4℃避光保存并在两周内使用。
2方法
2.1 菌株培养
冷藏菌株接入MRS液体培养基,37℃厌氧条件下活化转接三次,复苏菌液再转入MRS液体培养基,37℃厌氧条件下培养至活菌量约为109cfu/mL。
2.2 细胞培养
将SW480细胞置于含10%热灭活的新生牛血清和双抗(青霉素、链霉素浓度各为100 u/mL)的DMEM细胞培养液中,37℃、5%CO2培养箱中孵育,每2 d换一次培养液,4 d传代一次。将细胞接种于96孔细胞培养板待长至单层细胞后进行黏附实验。
2.3 耐酸能力测定
菌株于MRS液体培养基中37℃培养过夜(15 h),离心收集菌体重悬于pH为3.0的液体MRS培养基中,调整浓度为5×108cfu/mL。取菌液100μL于96孔板中,每个样液做3个复孔,同时以常规pH值MRS培养基培养组作为阴性对照。置于37℃培养箱中培养4 h,后每孔加入MTT溶液20μL,作用4 h后终止培养。每孔加入二甲亚砜(DMSO)100 μL,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪测量570 nm波长处的吸光度(A)值,存活率 =(A实验组/A对照组)×100%。
2.4 耐胆盐能力测定
菌株于MRS液体培养基中37℃培养过夜(15 h),离心收集菌体重悬于含0.1% ~0.3%胆盐的液体MRS培养基中,调整浓度为5×108cfu/mL,置于37℃培养箱中培养4 h。采用2.3项下方法测定存活率。
2.5 胶原蛋白黏附能力测定
从大鼠尾腱中提取鼠尾胶原,铺于96孔板至干燥。分别将六株乳杆菌(5×108cfu/mL)100μL加入96孔细胞培养板中,37℃,5%CO2培养箱中孵育1 h后,用灭菌的PBS漂洗3次,以洗去未黏附的菌。应用MTT法分别测定PBS漂洗后的乳杆菌、未漂洗的乳杆菌及未加菌空白对照孔的A值,黏附率=(A黏附菌-A对照)/(A总菌-A对照)×100%。
2.6 结肠细胞黏附能力测定
将已长至单层的SW480人结肠细胞用灭菌的PBS(pH 7.4)漂洗2次,分别将六株乳杆菌(5×108cfu/mL)100μL加入96孔细胞培养板中,采用2.5项下方法测定黏附率。
3 结果
3.1 耐酸能力
胃液pH值为3.0左右,食品通过胃的时间相对较短,一般为1~2 h,所以菌株应能够耐受胃酸,可以通过胃进入肠道,并符合活菌数达到106cfu/mL的要求[3]。为观察菌株在更长时间下的耐受能力,本实验将时间加倍,观察乳杆菌在pH为3.0的液体MRS培养基中4 h后的存活率。结果如图1所示。六株菌株均具有较强的抗酸能力,能顺利经由胃到达肠道。其中L.acidophilus的耐酸能力显著强于其它菌种,L.acidophilus 1.1、1.2 在 pH 为 3.0的条件下培养4 h后存活率为分别为15.09%和18.75%;L.sake耐酸能力最差,存活率仅为0.85%。本实验初始菌含量约为5×108cfu/mL,在pH 3.0的条件下,4 h后五种乳杆菌活菌数仍能达到107cfu/mL,而耐酸性最差的L.sake也能达到106cfu/mL以上。
3.2 耐胆盐能力
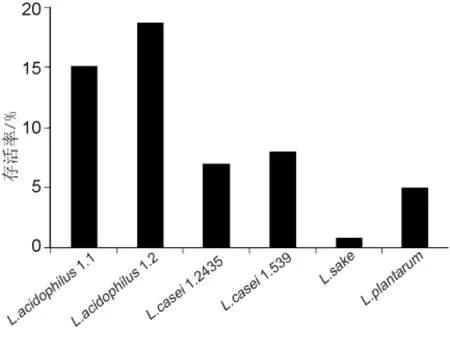
图1 六株乳杆菌耐酸能力分析Fig.1 Determination of the difference of acid resistantability of Lactobacillus
人体小肠中胆汁盐含量在0.03% ~0.3%之间波动,食物通过肠道的时间约2~3 h[4]。本实验用含0.1%,0.2%,0.3% 胆盐的液体 MRS 培养基将六株乳酸菌浓度调整为5×108cfu/mL,37℃恒温培养箱培养,观察菌株在4 h后活菌的变化情况。由图2可见,六株乳酸菌在含0.1% ~0.3%胆盐的MRS液体培养基中培养4 h后的菌存活率差异显著。L.plantarum耐胆盐能力最强,在含有0.1%胆盐的MRS培养基中培养4 h后,活菌数不但没有下降,反而有上升的趋势。在含0.2%和0.3%胆盐的MRS培养基中培养4 h后存活率也依然分别维持在72.24%和50.43%。L.sake耐胆盐能力最差,在含0.3%胆盐的培养基中培养4 h后存活率仅为5.51%。但六株乳杆菌在含0.3%胆盐的培养基中培养4 h后活菌数均超过106cfu/mL,有的甚至可超过107cfu/mL。由此表明,在小肠正常胆汁盐条件下,六株乳酸菌均具有较强的抗胆汁盐能力,能顺利通过小肠到达大肠。

图2 六株乳杆菌耐胆盐能力分析Fig.2 Determination of the difference ofbile sale resistantability of Lactobacillus
3.3 对胶原蛋白的黏附能力
胶原蛋白是一种重要的细胞外基质,对于乳酸菌的肠道黏附定植具有重要的作用。本研究提取鼠尾胶原铺于96孔板,模拟肠道黏附环境,MTT法分析不同乳酸菌对细胞外基质黏附能力的差异。结果见图3,这六株乳酸菌与胶原蛋白均有不同程度的黏附能力,黏附菌数均达到107cfu/mL以上,其中以L.acidophilus 1.2的黏附能力最强,黏附率达到37.87%,L.plantarum 黏附能力最差,只有5.23%。
3.4 对肠道细胞的黏附能力
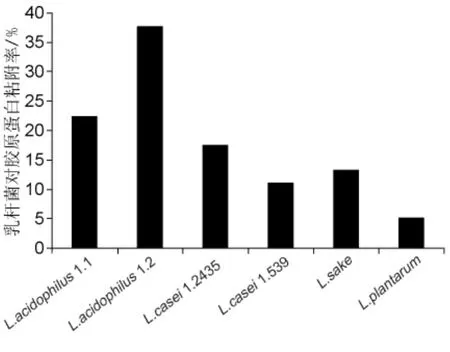
图3 六株乳杆菌对胶原蛋白的黏附能力分析Fig.3 Determination of the difference of adhesive ability of Lactobacillus to collagen
乳酸菌在肠道的黏附定植部位主要发生在结肠[5],因此本研究采用人结肠癌细胞SW480模拟肠道环境,通过MTT法测定不同乳酸菌对结肠细胞黏附能力的差异。结果如图4,与胶原蛋白黏附能力结果一致,这六株乳酸菌与结肠癌细胞黏附能力存在较为明显的差异,但黏附菌数均达到107cfu/mL以上,其中以L.acidophilus 1.2的黏附能力最强,黏附率达到62.19%,L.plantarum黏附能力最差,只有11.36%。

图4 六株乳杆菌对结肠细胞的黏附能力分析Fig.4 Determination of the difference of adhesive ability of Lactobacillus to human colon cells
4 讨论
人类的胃肠道含有1 000多种、约1013~1014个微生物,它们在人体胃肠道中定植并进行繁殖,构成了一个复杂的微生态环境[6-7]。大量研究证明,进入并定植于人类胃肠道的乳酸菌可以作为正常的微生物菌群成员而存在,它与宿主的共生对宿主具有很多益生作用,包括维持肠道的微生态平衡、增强机体的免疫机能、预防和抑制肿瘤的发生、改善肝脏功能、改善血脂平衡、增强免疫功能等[8]。随着微生态理论研究的不断加深,基于益生菌的微生态制剂的开发应用也日趋活跃。微生态制剂具有其他药物不可替代的优点,即“患病治病,未病防病,无病保健”的效果[9]。
据报道[10-11],只有摄入106cfu/mL以上的活性乳杆菌才能充分发挥其益生功效。胃酸和胆盐具有较强的抗菌作用,乳杆菌被食入后必须要通过恶劣的胃液并抵抗来自胆汁的胆盐、顺利抵达结肠进行黏附定植后,方可有效的发挥其益生作用。因此耐酸耐胆盐生长能力及黏附能力是乳杆菌作为益生菌筛选重要指标之一。各乳酸菌株间对胃酸和胆盐的耐受性有很大差异,pH 3、胆盐0.3%是衡量菌株耐受人体胃肠道的标准。在本研究中,耐酸与耐胆盐实验结果表明,L.acidophilus1.1、L.acidophilus 1.2、L.casei 1.2435、L.casei 1.539、L.sake、L.plantarum活菌数均能保持在106cfu/mL以上,且与胶原蛋白及结肠细胞的黏附菌数均可达到107cfu/mL以上,表明这六株菌均具有较强的黏附能力,能够有效的黏附定植在胃肠道中,发挥其益生作用,其中特别是L.acidophilus1.2具有非常好的胃肠道存活及定植能力。
此外,MTT可被活细胞线粒体中的琥珀酸脱氢酶将其四唑环还原为难溶性的蓝紫色结晶物甲臜(Fonmazan),而死细胞无此作用。因此通过用DMSO溶解所生成的甲臜,测定在一定波长下的光吸收值即可间接反映活细胞数量[12]。本研究采用的MTT快速活菌计数法,较平板计数法具有工作量小、操作简单快速、重复性好、能区分死活菌等有点,可很好的应用于涉及到活菌计数等分析研究中。
总之,在模拟胃肠环境条件下,本研究所用的六株乳杆菌可以顺利通过胃肠高酸、高胆汁盐环境,并在肠道实现黏附定植与正常繁殖,从而发挥其健康促进作用,其中以L.acidophilus1.2相对最为突出。该研究为胃肠道微生态制剂和功能食品开发奠定了很好的基础。
[1] 赵瑞香,孙俊良.发酵乳制品[J].中国乳品工业,1999(6):26-28.
[2]杨洁彬,郭兴华,张 篪,等.乳酸菌-生物学基础及应用[M].北京:中国轻工业出版社,1998:75-78.
[3]赵瑞香,孙俊良,李元瑞,等.嗜酸乳杆菌抗酸抗胆汁盐能力的研究[J].西北农林科技大学学报:自然科学版,2004,32(2):58-60.
[4]顾瑞霞,谭东兴,郭久和.胆汁酸盐和低pH值对乳酸菌活性的影响[J].微生物学通报,1996,23(3):144-146.
[5]李平兰,杨 华,张 篪.乳酸菌体外黏附人结肠癌细胞系HT-29 细胞的研究[J].中国农业大学学报,2002,7(1):19-22.
[6]Fuller R.Probiotics in human medicine[J].Gut,1991,32:439-442.
[7]Gill S R,Pop M D,Eboy R T,et al.Metagenomic analysis of the human distal gut microbiome[J].Science,2006(312):1355-1359.
[8]FAO/WHO.食品益生菌评价指南[J].中国食品卫生杂志,2003,15(4):377-379.
[9]杨琛杰,李光玉,刘晗璐,等.乳酸菌在微生态制剂上的研究进展[J].特产研究,2011,01,(55):55-58.
[10] Kurmann JA,Rasic JL.Technology of fermented special products[J].Bull Int Dairy Fed,1988,227:101-104 .
[11] Svenssonu.Industrial perspectives[M]//Tannock GW.Probiotics:a critical review.Wymondham:Horizon Scientific Press,1999:57-64.
[12]黄立坤,杜 鹏,霍贵成.MTT法测定乳酸菌活菌数的研究[J].食品工业,2008(3):62-65.
Study on the colonization ability of six strains of Lactobacillus in gastrointestinal tract
HAO Ran1,LUO Xue-gang1,JIAWei1,LIFang1,ZHANG Tong-cun1,2
(1.Key Laboratory of Industrial Microbiology,Ministry of Education and Tianjin City,School of Bioengineering,Tianjin University of Science and Technology,Tianjin 300457,China;
2.School of Medicine,Wuhan University of Science and Technology,Wuhan 430065,China)
Purpose To study the colonization ability of 6 strains of Lactobacillus in gastrointestinal tract.M ethods Lactobacillus were cultured at37 ℃ for 4 h in MRSbroth with high concentration of acid(pH 3)or bile salt to simulate human gastric or intestinal bile salt condition,respectively,and then the MTT assay was performed to determine the viability of different strains.The collagen and human colon cancer cells SW-480 were used to imitate the human intestinal environment and MTT assay was also be carried out to detect the adhesive ability of Lactobacillus after co-cultured for 1 h.Results All the six strains of Lactobacillus have acid and bile sale resistant ability,aswell as adhesive ability to collagen and human colon cancer cells.Of these strains,Lactobacillus acidophilus 1.2 exhibited the greatest ability to pass the gastrointestinal tractand colonize in the colon.Conclusion Six strains of Lactobacillus,especially the Lactobacillusacidophilus1.2,could adhere and colonize in the gastrointestinal tract,and then facilitate to play their healthcare functions in vivo.They can therefore be used as ideal probiotics candidates of functional food additives or drugs.
Lactobacillus;acid resitant;bile salt resistant;adhesion;colonization
R915
:A
:1005-1678(2012)05-0555-04
2011-09-20
国家高技术研究发展计划(863计划)资助(NO.2008AA10Z336)
郝 冉,女,在读硕士研究生,主要从事益生菌微生态制剂的研究开发;张同存,通信作者,博士生导师,Tel:022-60600518,Email:tony@tust.edu.cn;罗学刚,硕士生导师,Tel:022-60602099,Email:luoxuegang@tust.edu.cn。
