高效液相色谱法测定酵母粉腺嘌呤含量
2012-11-04刘国生王玉娟纪龙翔王秀强
刘国生,黄 倩,王玉娟,纪龙翔,王秀强
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.新乡拓新生化科技有限公司,河南 新乡453000)
高效液相色谱法测定酵母粉腺嘌呤含量
刘国生1,黄 倩1,王玉娟1,纪龙翔1,王秀强2
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.新乡拓新生化科技有限公司,河南 新乡453000)
目的 建立高效液相色谱法测定酵母粉腺嘌呤的含量,为酵母粉质量评价奠定方法学基础。方法 将酵母粉经过破壁处理后用高氯酸消解制备提取液,通过条件实验确定高效液相色谱法分离条件并测定腺嘌呤含量。结果 采用Diamonsil C18柱,以0.02 mol/L磷酸盐缓冲液(pH 6.0)为流动相,流速为0.8 mL/min,可以将腺嘌呤与其它成分有效分离。采用121℃高温高压-SDS法进行酵母粉前处理能有效破壁和促进核酸物质的释放,腺嘌呤测定值更接近其实际含量。结论 采用高温高压-SDS法制备酵母粉提取液、高效液相色谱测定腺嘌呤含量的方法简单易行、重现性好,测定结果可作为酵母粉质量评价的重要定量指标,对发酵生产有重要指导意义。
腺嘌呤;酵母粉;肌苷发酵;高效液相色谱法
肌苷发酵属于代谢控制发酵,生产所用的菌株是腺嘌呤缺陷型菌株,需在发酵原料中提供适宜浓度的腺嘌呤[1-3]。目前国内均利用天然培养基进行的肌苷发酵生产,腺嘌呤主要来自于酵母粉。肌苷产量很容易受到酵母粉原料质量的制约。不同厂家生产的酵母粉原料,其腺嘌呤含量有很大差别,甚至同一厂家不同批次的产品也会因生产季节、原料等变化而出现波动,从而影响肌苷发酵的产量[1],造成生产不稳定。目前企业对酵母粉质量的检测主要是测定蛋白含量、灰分及酵母形态等指标[4-5],这些指标虽然对于发酵生产有一定的意义,但尚无法满足精确、及时调整原料用量以指导生产。影响测定腺嘌呤含量的关键性因素包括细胞破壁、大分子消解、抽提以及色谱条件等 。本文在优化上述各条件的基础上,建立快速准确的酵母粉腺呤含量测定方法,为肌苷发酵生产中酵母粉质量评价奠定方法学基础。
1材料
酵母粉,新乡拓新生化科技有限公司提供;腺嘌呤(含量≥98%)、溶菌酶、蜗牛酶,国药集团化学试剂有限公司;甲醇为色谱纯;其他试剂均为分析纯。
LC-10A高效液相色谱仪(包括SPD-10AV检测器),岛津公司;BS110型电子天平,北京赛多利斯仪器系统有限公司。
2 方法与结果
2.1 高效液相色谱条件
色谱柱为 Diamonsil C18柱(200 mm ×4.6 mm,5 μm),检测波长 254 nm,进样量 20 μL。以 0.02 mol/L磷酸二氢钾缓冲液为流动相,用稀磷酸调节pH 3.0 ~7.8,流速 0.5 ~1.2 mL/min,考察不同条件下腺嘌呤与其它成分的分离效果。结果表明,在pH 6.0,流速为0.8mL/min条件下腺嘌呤峰与其它成分分离好、峰形对称(图1)。
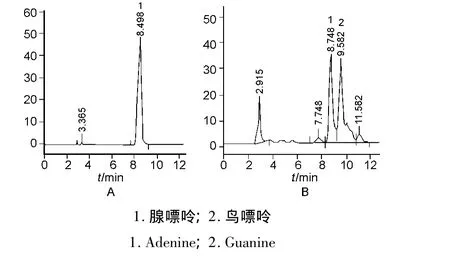
图1 腺嘌呤对照品(A)和酵母粉提取液(B)高效液相色谱图Fig.1 HPLC chromatograms of Adenine standard(A)and extract of yeast powder(B)
2.2 腺嘌呤标准曲线的绘制
精确称取腺嘌呤对照品25 mg,置1 000 mL量瓶中,加水溶解并稀释至刻度,摇匀,经0.25μm微孔滤膜过滤,作为对照品储备液。取对照品储备液稀释配制成浓度分别为5,10,15,20和25 mg/L的腺嘌呤标准溶液,进样20μL测定。将峰面积(A)对浓度(C)进行线性回归,得回归方程:C=2×10-5A -0.321 7,r=0.999 2。结果表明腺嘌呤在上述浓度范围内线性关系良好。
2.3 酵母粉提取液的制备及腺嘌呤含量测定
要准确测定酵母粉中腺嘌呤含量,关键在于细胞的破碎和核酸类物质的充分释放,因此不同的前处理方法将会影响测定结果的真实性。本实验为了考察SDS、溶菌酶、蜗牛酶、机械研磨、高温处理等不同因素对细胞破碎及腺嘌呤测定的影响,在综合其它腺嘌呤测定方法[8-13]的基础上,分别采用表1中的6种不同的前处理方法处理酵母粉悬液,处理后用HClO42 mL进行消解,调pH 6.0,加磷酸二氢钾缓冲液至10 mL,滤过得酵母粉提取液。提取液经过离心、0.25μm微孔滤膜过滤后进行液相色谱分析测定腺嘌呤含量(以酵母粉中腺嘌呤含量表示),结果见表1。
由表1可见,不同的前处理方法确实对测定结果有较大的影响。其中沸水浴-SDS、研磨-SDS法与SDS破壁法得到的结果相近,其中沸水浴-SDS法测定的腺嘌呤含量有所提高,说明高温处理有助于酵母细胞的破壁和测定目标物的释放;而研磨-SDS法测定数据有所降低,离心时发现处理液黏度增加、固形物分离难度增加。经蜗牛酶-SDS破壁、溶菌酶-SDS破壁前处理提到的提取液其测定结果显著高于前面3种方法,其中溶菌酶的效果优于蜗牛酶,表明酶处理有助于细胞破壁和内容物释放。因此酶-SDS处理法制备提取液测定嘌呤含量是比传统的SDS法更接近实际值。
在前处理实验中发现,沸水浴处理有助于碱基类物质的释放,因此在SDS处理前进行121℃高温高压处理,结果意外发现该法制备的提取液测定结果显著高于前面5种方法,且重现性好。测定数值的提高说明核酸等细胞内容物释放更充分、消解更彻底。其原因可能是通过高温高压细胞内蛋白等物质由于变性絮凝度增加,而含有嘌呤的核酸类物质与固形物更容易实现分离和被彻底消解并以碱基形式释放出来,因此测定值更能接近样品中腺嘌呤的实际含量。因此121℃高温高压-SDS法是一种比酶-SDS、研磨-SDS更有效的制备酵母提取液、测定腺嘌呤以及其它碱基含量的简单有效方法。在本文后续实验中采用此种方法进行酵母粉提取液制备和腺嘌呤含量测定。
2.4 高温高压-SDS法制备提取液测定腺嘌呤含量的重现性
用高温高压-SDS破壁对酵母粉进行前处理制备提取液,并测定腺嘌呤含量,进行了6次重复试验,换算为酵母粉中腺嘌呤含量,结果分别为7.48,7.66,7.70,7.61,7.68 和 7.59 mg/g,平 均7.62 mg/g,RSD 为1.0%,表明重现性良好。
2.5 回收率试验

表1 酵母粉不同前处理方法及其提取液腺嘌呤含量(n=3,x±s)Tab.1 Pre-treatingmethods for yeast powder and adenine content of extracts(n=3,x±s)
取已知腺嘌呤含量的酵母粉样品,分别加入一定量腺嘌呤对照品,用高温高压-SDS破壁法进行前处理制备提取液,并测定腺嘌呤含量,计算其回收率,结果见表2,平均回收率为 93.32%,RSD为2.4%。
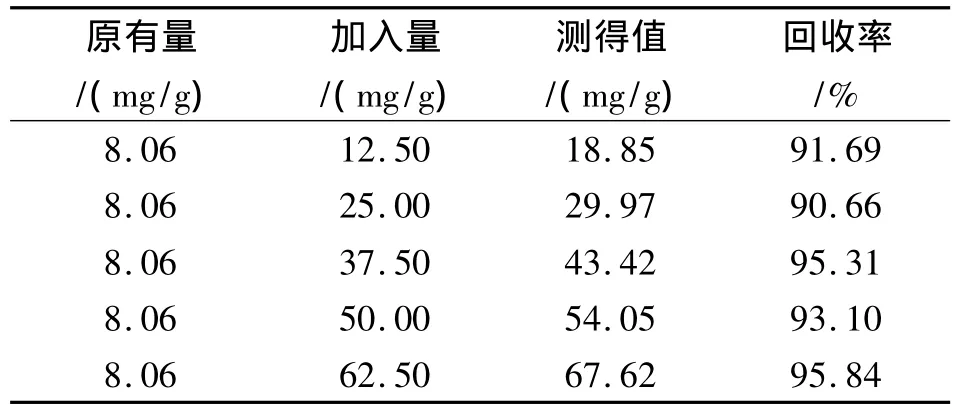
表2 回收率试验结果Tab.2 Results of recovery experiments
2.6 不同来源的酵母粉腺嘌呤含量测定及与发酵产肌苷的关系
不同来源的酵母粉外观颜色、味道会有所不同,显微检验观察细胞形态、大小也有较大的差别,通过长期实践人们也积累了一定的经验,比如具有典型的酵母香味、细胞形态较小且均匀的酵母粉通常发酵肌苷产量也较高。但这些尚不能对酵母粉质量进行较为准确的评价。本实验对生产过程中使用的不同来源的酵母粉用高温高压-SDS破壁法进行前处理制备提取液,并测定腺嘌呤含量,结果见表3,并跟踪这些酵母粉发酵生产肌苷的产量,从而为酵母粉质量提供评价依据。结果表明,不同厂家来源的酵母粉腺嘌呤含量有较大差异,同一厂家不同批次也有波动。一般能够满足肌苷发酵生产用的酵母粉的腺嘌呤含量在8~9 mg/g,含量高者肌苷产量也高,当腺嘌呤含量低于7 mg/g时,发酵产苷能力显著下降,不能用于生产。
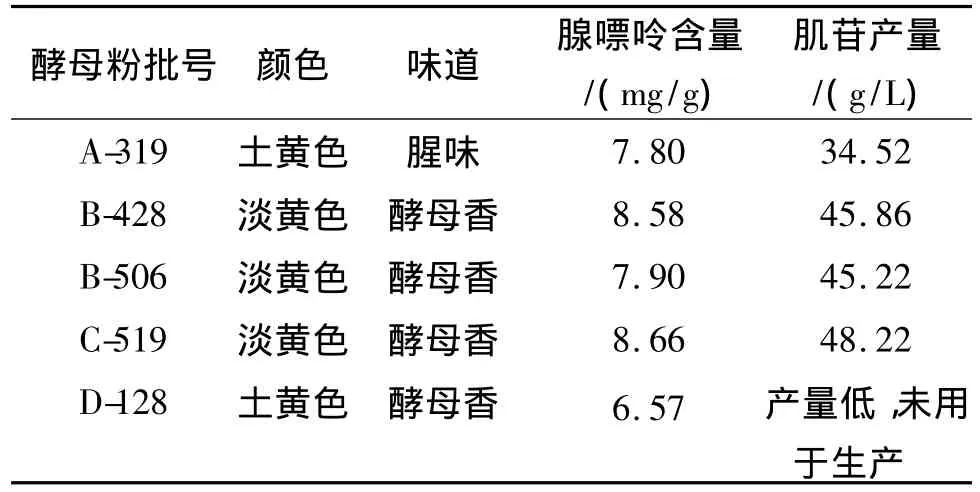
表3 不同来源的酵母粉Ade含量及其发酵产肌苷产量Tab.3 The content of adenine in different yeast powder and their fermentation of inosine
3 讨论
采用 Diamonsil C18色谱 柱(200 mm ×4.6mm,5 μm)、0.02 mol/L磷酸二氢钾缓冲液为流动相对酵母粉提取液进行腺嘌呤含量测定,条件试验表明流动相pH 6.0、流速0.8 mL/min时腺嘌呤峰分离良好。6种酵母粉前处理方法实验表明,采用121℃高温高压-SDS破壁处理是最为简单有效的方法,通过高温高压处理,细胞容易破壁、核酸类物质易于与其它固形物分离通过消解释放出碱基类物质,因此测定结果最接近样品中腺嘌呤的实际含量。通过高温高压-SDS前处理方法制备提取液,用高效液相色谱法测定其含量,结果可靠,重复性好,回收率高。用此法测定酵母粉腺嘌呤含量数据可以作为肌苷发酵生产中评价分析酵母粉质量的一个重要指标,从而更好地指导肌苷发酵生产。
[1]李良秋,邱玉堂.腺嘌呤对枯草杆菌GMI-971发酵生产肌苷的影响[J].微生物学杂志,1998,18(2):19-21.
[2]吴敏芝,刘咏梅,王焕章.肌苷发酵酵母粉量控制及其表现[J].发酵科技通讯,2001,30(4):8-11.
[3]Chen Shuangxi,Chu Ju,Zhuang Yingping.Enhancement of inosine production by Bacillus subtilis through suppression of carbon overflow by sodium citrate[J].Biotechnol Lett,2005,27:689-692.
[4]陈平洁,陈 庄,刘 婕,等.活性酵母粉中活酵母菌的测定[J].广州畜牧兽医科技,1998,2(23):11-12.
[5]李雨来.浅谈判定酵母粉质量的几种方法[J].饲料技术,2006,6:17.
[6]张素青,考桂兰,魏 波,等.酸-热处理法破碎酵母细胞的研究[J].内蒙古农业大学学报,2008,29(3):15-18.
[7]李夏兰,蔡阿娜,曾明荣.温和化学渗透法破碎酵母细胞的研究[J].药物生物技术,2007,7(1):23-27.
[8]刘 宇,孙 蕾,冯 蕾,等.高效液相色谱法测定萝芙木中育亨宾和利血平的含量[J].中国生化药物杂志,2008,29(2):107-109.
[9]Axel M,Tharcisse N,Gunter H.Determination of adenine caffeine theophylline and theobromine by HPLC with amperometric detection[J].Fresenius JAnal Chem,1996,356:284-287.
[10]魏雪勇,丁昆山,俞登荣.高效液相色谱法测定断血流滴丸中断血流皂苷A的含量[J].中国生化药物杂志,2010,31(3):199-201.
[11] Pilar GM,Maria JA,Jose A R.Simultaneousdetermination ofadenine and guanine in ruminant bacterial pellets by ion-pair HPLC[J].JChromatogr B,2005,7(44):257-260.
[12]刘 斌,蔺宁利,袁会利.宫颈癌片中腺嘌呤含量测定方法的研究[J].陕西中医学院学报,2005,28(6):44-45.
[13]张科卫,吴 皓,李 伟.HPLC同时测定半夏药材中次黄嘌呤核苷、鸟嘌呤核苷的含量[J].药物分析杂志,2005,25(5):487-489.
Determ ination of adenine content in yeast powder by HPLC
Purpose To establish amethod for the determination of adenine content in yeast powder by HPLC and to lay amethodology basis for the quality assessment of yeast powder.M ethods After the yeast powder was pre-treated by way of wall-breaking,degraded with perchloric acid,the extracts were prepared for the sepration and determination of adenine by HPLC.Results Under the following conditions:Diamonsil C18column,pH 6.0,0.02 mol/L phosphate buffer asmobile phase and flow rate 0.8 mL/min,adenine could be separated effectively from other components.The yeast powder pre-treatment experiments showed that yeast cell wall could be effectively broken through 121℃autoclaving-SDS pretreatment and nucleic acid was promoted to release,and the determination results of adenine were closer to the natural value.Conclusion Themethod using autoclaving-SDS to prepare yeast powder extracts and determining the adenine content by HPLC,is simple and reproducible.Analysing resultswould be an important evaluation index to investigate yeast powder quantitatively,which is of significance for guiding the production of inosine fermentation.
adenine;yeast powder;inosine fermentation;HPLC
TQ460.72
:A
:1005-1678(2012)05-0552-03
2011-09-10
国家科技部科技人员服务企业行动项目(2009GJD00044);河南省教育厅自然科学基金项目(2011B180032)
刘国生,男,博士,教授,从事工业微生物研究,Tel:15937310368,E-mail:hnliugs@163.com。
LIU Guo-sheng1,HUANG Qian1,WANG Yu-juan1,JILong-xiang1,WANG Xiu-qiang2
(1.School of Life Sciences,Henan Normal University,Xinxiang 453007,China;2.Xinxiang Tuoxin Biochemical and Technology & Science Co.,Ltd.,Xinxiang 453000,China)
