固定化细胞转化脱氧胸苷合成2'-脱氧腺苷
2012-11-04刘国生邢善涛王建琨
刘国生,陈 琳,邢善涛,王建琨,焦 璐,魏 聪
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.新乡拓新生化科技有限公司,河南 新乡453000)
固定化细胞转化脱氧胸苷合成2'-脱氧腺苷
刘国生1,陈 琳1,邢善涛2,王建琨1,焦 璐1,魏 聪1
(1.河南师范大学 生命科学学院,河南 新乡 453007;2.新乡拓新生化科技有限公司,河南 新乡453000)
目的 选择最优的载体包埋固定化AEM0957细胞酶促催化脱氧胸苷和腺嘌呤合成脱氧腺苷。方法分别用琼脂、聚丙烯酰胺、明胶、卡拉胶、海藻酸钠、聚乙烯醇等6种材料包埋固定细菌AEM0957细胞,以此为催化剂转化脱氧胸苷合成脱氧腺苷。结果 通过优化反应条件,聚丙烯酰胺固定化细胞催化脱氧胸苷的转化率可达57%,高于游离细胞反应能力,并能多次重复使用,10次重复反应的转化率仍能够保持在32%左右。结论 聚丙烯酰胺在稳定性、转化性能等方面优于其它材料,该研究为脱氧腺苷的工业化生产奠定了重要基础。
脱氧腺苷;脱氧胸苷;生物合成;固定化细胞;聚丙烯酰胺
抗病毒药物如拉米夫定、阿德福韦、替比夫定和恩替卡韦等都属于核苷类或核苷酸类化合物,其中部分采用化学合成法生产,如已应用于临床的阿糖腺苷、三氮唑核苷等[1]。2-脱氧腺苷(Deoxyadenosine,dA)是一种天然的脱氧核苷,是脱氧核糖核酸DNA的结构片段,被广泛地应用于合成寡聚核苷酸和基因工程的研究中,同时是合成多种抗病毒、抗肿瘤药物的重要中间体[2-4]。现在可以采用游离细胞(酶)法转化脱氧胸苷(Deoxythymidine,dT)合成dA[5-7],但由于游离细胞(酶)进行生物合成中,所制备的细胞或酶一次性使用,造成生产成本很高。采用固定化技术可克服上述不足。固定化技术操作连续及可控、工艺简便、产物分离更容易,从而可以大幅度降低生产成本。本实验考察了琼脂、聚丙烯酰胺、明胶、卡拉胶等多种载体用于固定化AEM0957菌细胞以合成dA,筛选出适宜的载体,通过反应条件优化提高转化率,降低生产成本,为工业化生产奠定基础。
1材料
菌种:AEM0957菌株,河南师范大学应用与环境微生物实验室分离保藏。
试剂dT、腺嘌呤(99.5%)由拓新生化科技有限公司提供;胸腺嘧啶、dA对照品(均为分析纯),Sigma公司(原装进口);牛肉膏、蛋白胨和酵母膏,北京双旋微生物培养基制品厂;其它试剂均为分析纯。
ZF8型三用紫外分析仪,上海康华生化仪器制造有限公司;高效液相色谱仪,日本岛津公司。
2方法
2.1 酶促转化用菌体细胞的制备
将冷藏备用的AEM0957菌种活化后接种于牛肉膏蛋白胨培养基,37℃、180 r/min恒温振荡器培养22 h。用高速冷冻离心机4 500 r/min离心收集菌体,所得湿菌体冷藏备用[8]。
2.2 细胞固定化方法
2.2.1 海藻酸钠固定化细胞 参考文献[9]进行改进:将4%海藻酸钠溶液10 mL与菌体细胞2 g混匀,使用6号针头注射器滴入2%CaCl2溶液中,得到固定化颗粒,4℃静置固定化4 h,洗涤后备用。
2.2.2 明胶固定化细胞 参考文献[10]进行改进:将保温于40℃的10%明胶溶液10 mL与菌体细胞2 g混匀,铺成2 mm厚的膜,4℃冷却2 h,切成2 mm3左右的小块,加入0.5%戊二醛溶液交联30 min,10%甲醛溶液通透处理1 h,洗涤后备用。
2.2.3 琼脂固定化细胞 取琼脂0.6 g溶于100 mmol/L磷酸二氢钾缓冲液(pH 7.0)10 mL,菌体细胞2 g溶于磷酸二氢钾缓冲液中,置于60℃水浴内,待两瓶温度基本一致后,混合摇匀。倒入培养皿中待其凝固,凝胶切成3 mm3小块,用缓冲液洗去残渣待用。
2.2.4 聚丙烯酰胺固定化细胞 参考文献[11]进行改进:菌体细胞2 g加100 mmol/L磷酸二氢钾缓冲液(pH 7.0、)13.7 mL 于锥形瓶中,加 62.5% 聚丙烯酰胺单体4.8 mL,3.3%交联剂 N-N'-甲撑双丙烯酰胺4.8 mL、50%β-二甲基氨丙腈催化剂0.4 mL和2.5%过硫酸钾引发剂1.6 mL以及2.5%维生素C溶液0.5 mL,搅拌均匀,倒入培养皿,25℃静置30 min,聚合成凝胶。
2.2.5 卡拉胶包埋 卡拉胶、明胶溶于100 mmol/L磷酸钾缓冲液(pH 7.0),37℃与菌体2 g混匀,铺成1~2 mm厚的膜,凝固后切成小块,用戊二醛溶液交联1 h,10%甲苯处理30 min,抽滤洗净后置冰箱备用[12]。
2.2.6 聚乙烯醇(PVA)海藻酸钠固定化细胞10%PVA水溶液10 mL,加入海藻酸钠0.02 g充分溶解,然后与菌体细胞3 g混匀,使用6号针头注射器,滴入2%CaCl2的饱和硼酸溶液中,边滴入边搅拌,在4℃冰箱固定8 h,甲苯处理水溶液通透处理1 h,清洗备用[13]。
2.3 酶促反应体系
生物转化合成dA的反应体系:将反应底物A和dT与一定量的菌体细胞混合,加入 pH 7.0,60 mmol/L的磷酸钾缓冲液,在55℃水浴振荡下进行生物转化反应6 h。
2.4 dA的简易定性定量测定
采用纸色谱-分光光度法[14]:分别取20 mmol/L dA对照品溶液、转化反应液2μL点样于色谱纸上,以正丁醇-异丙醇-氨水-水(3∶3∶2∶2)为展开剂进行展开,259 nm紫外光下观察显色斑点,将其剪下浸泡于水,用分光光度法测定dA含量。
2.5 dA的HPLC定量测定
色谱柱:Hypersil BDS C18柱(4.6 mm ×250 mm);流动相:甲醇-50 mmol/L磷酸二氢钾缓冲液(pH 6.5)(8∶92);流速:0.9 mL/min;检测波长:254 nm;进样量:20 μL。
将不同浓度的标准溶液通过HPLC进行测定,对浓度(Y)与峰面积(X)进行回归得到回归方程:Y=0.001 7 X+0.011 9(r=0.998)。将反应液离心上清液稀释100倍后进行HPLC检测,通过回归方程算得反应液中dA的浓度。
3 结果
3.1 采用不同载体进行固定化细胞合成dA的转化率及稳定性
分别以琼脂、聚丙烯酰胺、明胶、海藻酸酸钠、卡拉胶、聚乙烯醇为载体材料制备AEM0957固定化细胞。将固定化细胞加入反应体系20 mL:25 mmol/L dT、30 mmol/L腺嘌呤溶于pH 7.0的60 mmol/L磷酸钾缓冲液,55℃酶促反应6 h,检测反应液中产物dA的浓度,并以底物dT为标准计算转化率。dT转化率=dA摩尔浓度/dT起始摩尔浓度。
图1是3次重复实验的结果。实验表明,AEM0957细胞用6种载体材料固定化之后,催化反应效果不如游离细胞,产物转化率均低于游离细胞,原因是细胞经过上述材料包埋后增加了底物扩散并进入细胞及产物透出细胞的难度,导致转化反应速度降低。对比6种载体固定化细胞的酶促反应结果,转化率最高的是海藻酸钠,转化率是对照的73%,其次是琼脂、聚丙烯酰胺和卡拉胶,转化率分别是对照的57%,52%和54%,明胶和聚乙烯醇最低,转化率只达到对照的39%和36%。
反应过程观察固定化材料形态变化,海藻酸钠包埋材料在上述反应体系中很容易重新溶解,原因是反应系统中较高浓度的阳离子存在,故其转化率虽然与对照比较接近但不适合作为此类反应的固定化材料;琼脂与卡拉胶反应温度55℃下形状保持不好并有一定程度的溶解,连续进行3次转化反应后固定化的颗粒形态被完全破坏,故也不适合此高温条件下的转化反应。聚乙烯醇、明胶和聚丙烯酰胺的固定化颗粒经过多次的转化反应形态保持较好,三者都可以作为该类反应的固定化材料。考虑到聚丙烯酰胺在三者之中转化率最高,进一步以此为材料进行固定化转化反应条件的优化。

图1 6种载体固定化细胞合成dA的转化率比较Fig.1 Comparison of conversion rat for dA synthesis using immobilized cells of 6 kind carriers
3.2 聚丙烯酰胺固定化细胞催化活性的稳定性
固定化细胞催化活性的稳定性是进行连续生物合成dA的关键,其稳定性越高,可以反复使用的次数就越多,成本也随之降低。将聚丙烯酰胺固定化的AEM0957细胞在上述反应体系和反应条件下进行dA的转化合成,每次反应完成分离固定化材料再加入新的反应溶液,如此连续重复多次转化反应,测定每次反应产物的浓度,计算转化率(图2)。结果表明,在固定化材料重复使用过程中,其催化活性在最初的几次重复反应中下降较快,2~4次重复反应的转化率是初次反应的83%,79%和71%,之后其催化活性相对稳定并略有降低。表明以聚丙烯酰胺包埋的AEM0957细胞能够在高温条件下较长时间保持催化活性,在连续55℃条件下反应60 h,其催化能力仍能保持初始的70%。
3.3 聚丙烯酰胺固定化细胞转化条件的优化

图2 聚丙烯酰胺固定化细胞重复反应生成dA的转化率Fig.2 Conversion rat of dA synthesis in iterative reaction using polyacrylamide immobilized cells
以上进行的固定化细胞的转化反应是依据前期游离细胞的最适反应条件进行的。当细胞被固定化之后,其适宜的反应条件有可能变化,故进行如下单因子实验进行条件优化。
3.3.1 反应温度 其它条件不变,改变转化反应的温度,测定46~64℃范围内聚丙烯酰胺固定化AEM0957细胞的转化能力(图3),结果发现固定化细胞的最适反应温度为52℃,低于游离细胞的最适反应温度。温度高于60℃,催化活性迅速降低。

图3 聚丙烯酰胺固定化细胞合成dA的最适反应温度Fig.3 Optimal reaction temperature of dA synthesis using polyacrylamide immobilized cells
3.3.2 缓冲液pH 其它条件不变,改变转化反应缓冲液的pH,测定pH 5.5~8.0范围内聚丙烯酰胺固定化AEM0957细胞的转化能力(图4),结果表明最适反应pH为6.5,与游离细胞相比适宜的pH向酸性方向偏移;当反应pH高于7.5或低于5.5时,其催化活性迅速下降。
3.3.3 缓冲液浓度 其它条件不变,测定磷酸盐缓冲液20~300 mmol/L浓度范围内聚丙烯酰胺固定化AEM0957细胞的转化能力(图5)。结果发现聚丙烯酰胺固定化的材料适宜的磷酸盐缓冲液浓度有很大改变,前期实验表明,游离细胞适宜于转化反应的缓冲液浓度有60~80 mmol/L,固定化之后其最适的缓冲液浓度增加至150 mmol/L,最适浓度增加的原因可能与细胞被高分子材料包埋、材料中细胞局部位置与反应液间存在浓度差有关。进一步增大缓冲液浓度,催化活性受到抑制。

图4 聚丙烯酰胺固定化细胞合成dA的最适pHFig.4 Optimal pH of dA synthesis using polyacrylamide immobilized cells

图5 磷酸盐浓度对聚丙烯酰胺固定化细胞合成dA的影响Fig.5 Effectof reaction phosphate concentrations to dA synthesis using polyacrylamide immobilize cells
3.3.4 固定化细胞浓度 其它条件不变,改变包埋材料中菌体细胞的量,考察对转化率的影响(图6)。结果表明,菌体浓度从2.5%增加到10%时转化率也随之增加,超过10%时,转化率不再有明显增加。因此细胞的适宜包埋浓度以10%为宜。
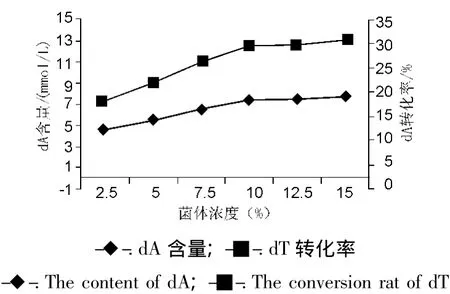
图6 聚丙烯酰胺固定化细胞合成dA的最适菌体浓度Fig.6 Optimal cells concentration of polyacrylamide immobilized cells for dA synthesis
3.3.5 条件优化后固定化转化效果 根据上述单因子实验,调整反应条件:温度52℃、pH 6.5、磷酸盐浓度150 mmol/L、菌细胞量10%,进行dA转化反应试验(图7)。结果表明,产物浓度在6 h达到最大值,最高转化率可达58%,是游离细胞反应的110%。在此条件下进行多次连续反应(图8),第2次反应仍保持较高的转化率(55%),第3次催化效果有明显下降,之后每次反应的转化率有呈逐渐缓慢下降趋势,10次反应后,其转化率仍高于30%。

图7 优化条件下聚丙烯酰胺固定化细胞合成dA的时间-转化率曲线Fig.7 The t-conversion rate curve of polyacrylamide immobilized cells to synthesize dA in optimal condition

图8 优化条件下聚丙烯酰胺固定化细胞重复反应的转化率变化Fig.8 Change of conversion rate of polyacrylamide immobilized cells in repeat reactions in optimizing condition
4讨论
通过海藻酸钠、聚丙烯酰胺等6种材料固定化AEM0957细胞进行dA生物合成实验,证明采用聚丙烯酰胺、明胶和聚乙烯醇制备的固定化材料比较适合于该转化反应条件下的dA合成,其中聚丙烯酰胺固定化细胞的转化率最高,通过条件优化,其转化率可达57%,重复进行10次反应后仍能够保持较高的催化活性,转化率在32%左右。本研究细胞固定化材料的筛选及转化反应条件的优化为dA的工业化生产奠定了重要基础。
[1]Agnieszka B,Ewa K,David S.Purine nucleoside phosphorylases:properties,functions,and clinicat,aspects [J].Pharmacol Ther,2000,88:349-425.
[2]汤雁波,李卓荣.核苷类抗病毒药物研究进展[J].中国生化药物杂志,2004,25(1):88-90.
[3]邱蔚然,丁庆豹.酶法合成核苷类抗病毒药物[J].中国医药工业杂志,1999,30(10):474-479.
[4]樊华伟,傅绍军,邵志宇,等.核苷类药物酶法合成研究进展[J].生物技术通讯,2005,16(6):690-692.
[5]路有昌,张换平.2'-脱氧腺苷的合成[J].应用化工,2006,35(7):564-568.
[6]蒋忠良,李乾坤,齐湘兵,等.2'-脱氧腺苷全合成研究[J].同济大学学报,2007,35(9):1264-1268.
[7]洪云海,丁庆豹,欧 伶,等.应用乙酰短杆菌酶法合成2'-脱氧腺苷[J].工业微生物,2006,31(6):30-33.
[8]刘国生,刑善涛,王建琨,等.埃希菌全细胞转化阿糖尿苷合成阿糖腺苷[J].中国医药工业杂志,2010,41(6):416-419.
[9]乔春楠,刘 萍,孙君社.海藻酸钠法固定化谷氨酸脱羧酶的研究[J].中国生化药物杂志,2008,29(1):16-22.
[10]曹祥薇,严海彪.明胶/卡拉胶复配凝胶的特性研究[J].河南工业大学学报:自然科学版,2010,31(5):22-24.
[11]郑一敏,胥秀英,傅善全,等.阿糖腺苷生物合成的研究[J].生物学杂志,2002,19(6):20-21.
[12]沈立新,魏东芝,张嗣良,等.固定化E.coli BL21(pTrc-gsh)细胞催化合成谷胱甘肽[J].华东理工大学学报,2002,28(1):24-28.
[13] 牛卫宁,左晓佳,尚晓娅,等.固定化 E.coli JM109(pBR322-MAT)细胞催化合成 S-腺苷蛋氨酸[J].现代化工,2009,29(3):38-43.
[14]刘国生,王建琨,邢善涛,等.纸色谱-分光光度法测定生物转化体系中脱氧腺苷含量[J].中国生化药物杂志,2012,33(2):132-135.
Synthesis ofβ-2'-deoxyadenosine from β-2'-deoxythym idine by immobilized cells
LIU Guo-sheng1,CHEN Lin1,XING Shan-tao2,WANG Jian-kun1,JIAO Lu1,WEICong1
(1.School of Life Sciences,Henan Normal University,Xinxiang 453007,China;
2.Xinxiang Tuoxin Biochemical and Technology & Science Co.,Ltd.,Xinxiang 453000,China)
Purpose Choose the best carrier of immobilized AEM0957 cell for the enzymatic synthesis of deoxyadenosine from thymidine and adenine.M ethods Agar,polyacrylamide,gelatin,carrageenan,sodium alginate and polyvinyl alcohol were used as immobilization materials to encapsulate bacteria AEM0957 cells,and these immobilized cells were used as catalyst to synthesize 2'-deoxyadenosine from 2'-deoxythymidine.Results By optimizing the reaction conditions,the conversion rat of deoxythymidine catalyzed by immlbilized cellswith polyacrylamide achieved 57%,which was higher than that of by free cells.After 9 batches of repeated reaction,the conversion rate was remained at about 32%.Conclusion Polyacrylamide was better than othermaterials in stability and catalytic efficiency.The study laid an important foundation for the industrial production of deoxyadenosine.
2'-deoxyadenosine;2'-deoxythymidine;biosynthesis;immobilized cells;polyacrylamide
TQ464.6;TQ929
:A
:1005-1678(2012)05-0563-05
2011-12-26
国家科技部科技人员服务企业行动项目(2009GJD-00044);河南省教育厅自然科学基金项目(2011B180032)
刘国生,男,博士,教授,从事工业微生物研究,Tel:15937310368,E-mail:hnliugs@163.com。
