单核细胞增生李斯特菌复合抑菌剂的研究
2012-11-02潘利华刘竹青陈有亮
潘利华,刘竹青,于 荟,陈有亮
(浙江大学动物科学学院,浙江杭州310058)
单核细胞增生李斯特菌复合抑菌剂的研究
潘利华,刘竹青,于 荟,陈有亮*
(浙江大学动物科学学院,浙江杭州310058)
单核细胞增生李斯特菌(Listeria monocytogenes,LM)在0~4℃也能生长,为确保冷却肉卫生安全,必须阻止肉中污染的LM的生长繁殖。本实验通过研究不同抑菌剂对3株LM的最小抑菌浓度(MIC),选取了ε-聚赖氨酸、Nisin、曲酸三种抑菌剂,利用响应面法找出最佳组合。结果表明:ε-聚赖氨酸、Nisin、曲酸对单核细胞增生李斯特菌的最小抑菌浓度分别为50μg/mL、200μg/mL、6.4mg/mL。当ε-聚赖氨酸、Nisin、曲酸的浓度分别为20.5μg/mL、184.6μg/mL、4.37mg/mL时对单核细胞增生李斯特菌的抑制作用最佳。
ε-聚赖氨酸,Nisin,曲酸,响应面,单增李斯特菌
单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种人畜共患的致病菌,能引起人类脑膜炎、败血症等疾病,尤其对孕妇、新生儿、老年人以及免疫功能缺陷者具有较高的感染风险[1]。虽然发病率不高,但致死率(20%~30%)[2]远高于其他常见食源性病原菌。LM已被WHO列为重点监测的食源性致病菌之一[3]。冷却肉,是指严格执行检疫制度宰杀后的温热畜肉,经过各种方法使其温度迅速降至0~4℃,并在后续的分割加工、流通过程中始终处于0~4℃,不超过7℃的冷却链控制下的生鲜肉[4]。在冷链条件下,酶的活性和大多数腐败微生物的生长受到抑制,与其他微生物不同,LM在0~4℃也能生长[5]。冷却肉要想达到卫生安全的目的,必须阻止冷却肉中污染的LM的生长繁殖,而添加防腐剂是一种简单、有效的方法。目前防腐剂分化学合成防腐剂和天然防腐剂,但经过长期的研究发现,一些合成防腐剂有致癌和致突变等问题,因此,开发高效、安全、稳定的天然防腐剂成为防腐剂研究的重要方向[6-7]。本实验研究了ε-聚赖氨酸、Nisin、曲酸、溶菌酶、乳铁蛋白、乳酸钠6种抑菌剂对3株LM的最小抑菌浓度(MIC),筛选出3种抑菌效果较好的抑菌剂,对3种抑菌剂在肉汤中进行三元二次旋转回归实验设计,通过响应面法找出最佳抑菌剂浓度组合,旨在为其进一步在冷却肉中应用提供科学依据。
1 材料与方法
1.1 实验材料
单增李斯特菌(EGDA、0013、10403S) 浙江大学动物预防医学研究所提供;培养基 脑心浸液(Brain Heart Infusion,BHI)干粉培养基;ε-聚赖氨酸和Nisin 食品级,浙江银象生物工程有限公司;乳酸钠 分析纯,上海展云化工有限公司;曲酸 食品级,成都拉克生物工程有限公司;溶菌酶 食品级,杭州中香化学有限公司;乳铁蛋白 食品级,南京纽瑞氏食品有限公司。
1.2 实验方法
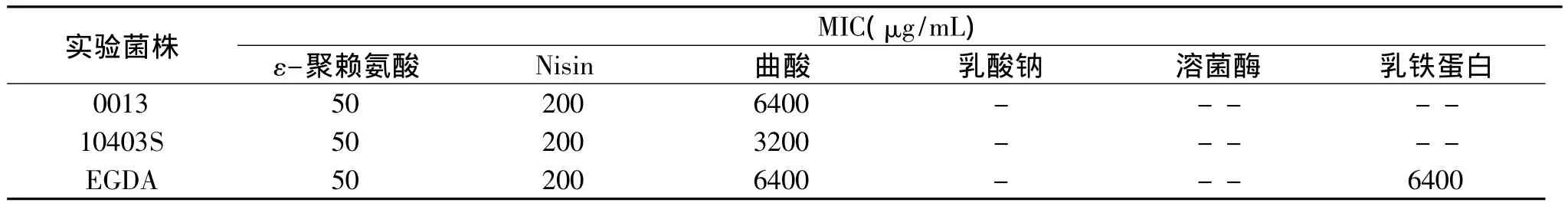
表2 不同抑菌剂对单增李斯特菌的MICTable 2 MICs of different bacteriostatic agents against LM
1.2.1 最小抑菌浓度(MIC)测定[8]
1.2.1.1 抑菌剂母液的配制及其倍比稀释 抑菌剂母液的配制:用无菌蒸馏水配制12.8mg/mL的Nisin、溶菌酶、ε-多聚赖氨酸、乳铁蛋白;配制25.6mg/mL的曲酸和乳酸钠,摇匀,放于冰箱备用。
倍比稀释:将抑菌剂母液用无菌水以1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256、1∶512、1∶1024、1∶2048倍稀释。
1.2.1.2 菌悬液的制备 取细菌37℃摇床培养10~12h。用 BHI液体培养基调整浓度至108CFU/mL (OD600=0.15),将菌液稀释至107CFU/mL,振荡混匀,4℃备用。
1.2.1.3 MIC的测定 将倍比稀释后不同浓度的抑菌液分别加到无菌的96孔酶标板中,第1至第11孔加抑菌液,每孔加100μL,第12孔不加抑菌液作对照组,再向每孔中加100μL制备的菌悬液,密封后置37℃培养。用酶标仪从0h开始每隔2h测量菌液的OD630,检测至第12h。做OD-t生长曲线,通过观察曲线,以单增李斯特菌不生长的最低浓度为MIC。
1.2.2 响应面法优化实验
1.2.2.1 菌悬液的制备 取三株单增李斯特菌(10403S、EGD、0013)37℃过夜培养物,调整菌液浓度至108CFU/mL(OD600=0.15),将三株单增李斯特菌振荡均匀,4℃备用。
1.2.2.2 实验设计 按照三元二次回归通用旋转组合设计添加ε-多聚赖氨酸、Nisin和曲酸的用量,实验因素水平表见表1,同时设空白对照组,共21组实验。然后取制备好的菌液分装于各组试管,每个试管50μL,最后用BHI营养肉汤补足5mL,初始菌液浓度为106CFU/mL。将试管于10℃下冷藏放置5d,从0d起,每天每组取2个试管进行计数。
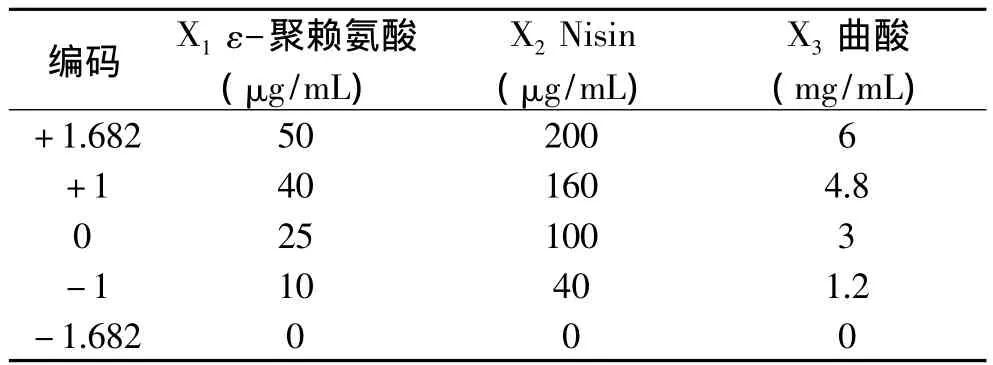
表1 响应面实验因素水平表Table1 Factors and levels of RAS test
1.2.3 数据统计与分析 所得数据用SAS软件(8.2版)进行分析,拟合出模型,并通过降维分析各因素间的交互作用[9]。
2 结果与分析
2.1 不同抑菌剂对单增李斯特菌的MIC
不同抑菌剂对单增李斯特菌的MIC见表2。由表2可知,抑菌效果最好的是ε-聚赖氨酸,对3株单增李斯特菌的MIC均为50μg/mL,抑菌效果次之的是Nisin和曲酸,其MIC分别为200和6400μg/mL以下。而乳酸钠、溶菌酶、乳铁蛋白的抑菌效果不明显。本实验中,虽然ε-聚赖氨酸和Nisin的抑菌效果较好,但是ε-聚赖氨酸和Nisin的价格较高,曲酸价格便宜,因此,选取ε-聚赖氨酸、Nisin和曲酸作为回归实验的抑菌剂,以期得到复合抑菌剂。
2.2 各组5d内菌落总数的变化
对在10℃下冷藏的21组BHI营养肉汤以5d为周期进行菌落总数的检测,其中第21组为对照组,结果见表3。由表3可以看出,除第13处理组是缓慢增长外,其他处理组单增李斯特菌的生长基本都被抑制,第8组是菌数降低最快的一组。对照组明显增加,菌落总数从106CFU/mL增长到109CFU/mL。
2.3 三元二次回归通用旋转组合设计实验结果
三元二次回归通用旋转组合实验设计及第3d菌落数的对数值如表4所示。
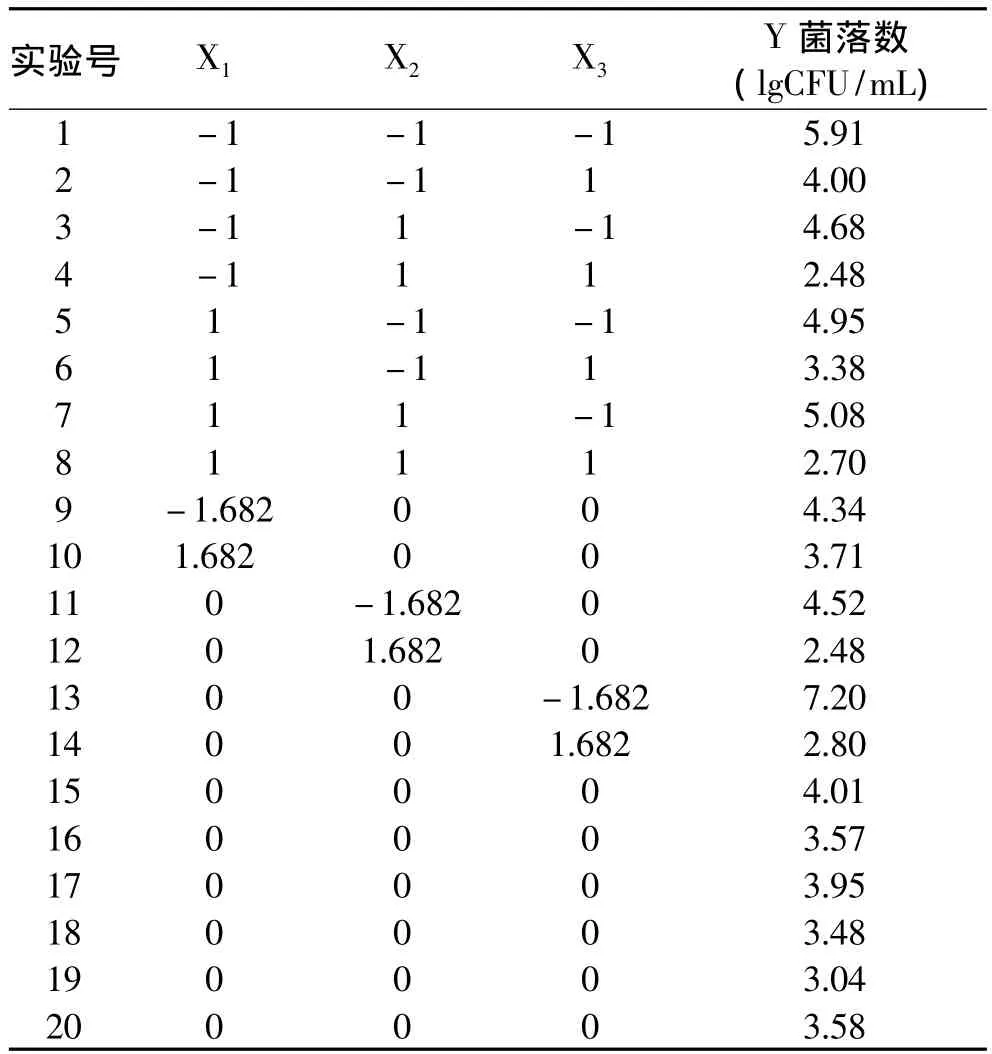
表4 实验设计及结果Table 4 Experimental design and results
2.3.1 回归模型与统计检验 用SAS(8.2版)软件的RSREG过程对表4中数据进行多元回归分析。所得二次回归方程:
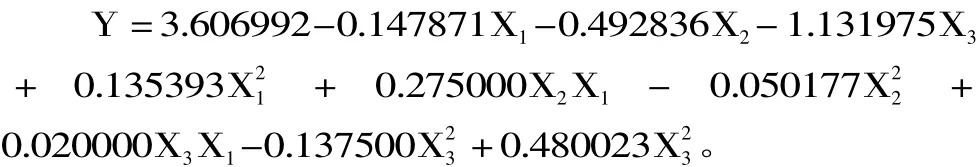
表3 各组在10℃下冷藏5d内菌落总数的变化(CFU/mL)Table 3 Changes in total bacteria counts of 21 samples stored at 10℃(CFU/mL)
为了说明模型的有效性和各因素对抑菌效果影响的重要程度,对二次回归方程模型进行方差分析,结果见表5。由方差分析表可知,失拟项的F=0.78,P=0.6029>0.05,表明失拟项不显著,说明未知因子对实验结果干扰很小;回归模型的F=25.62,P<0.0001,表明回归方程模型极显著,说明该模型与实际情况拟合效果很好,可以正确反映菌落数与ε-聚赖氨酸、Nisin、曲酸三因素间的关系。为了说明各因素对抑菌效果的贡献大小,对各偏回归系数进行了显著性检验,结果见表6。表6表明,在编码区间内,Nisin、曲酸的添加量对菌落数有极显著影响,ε-聚赖氨酸的添加量对菌落数无显著影响,但ε-聚赖氨酸和Nisin添加量的交互项对菌落数有显著影响。

表5 回归模型方差分析表Table 5 ANOVA for quadratic model
2.3.2 单因子效应分析 观察某因子变化对Y值的影响,可采用降维分析的方法,将其它因子固定在0水平,3个因子的单因子效应方程如下:

根据以上方程,可得到单因子效应曲线如图1所示。
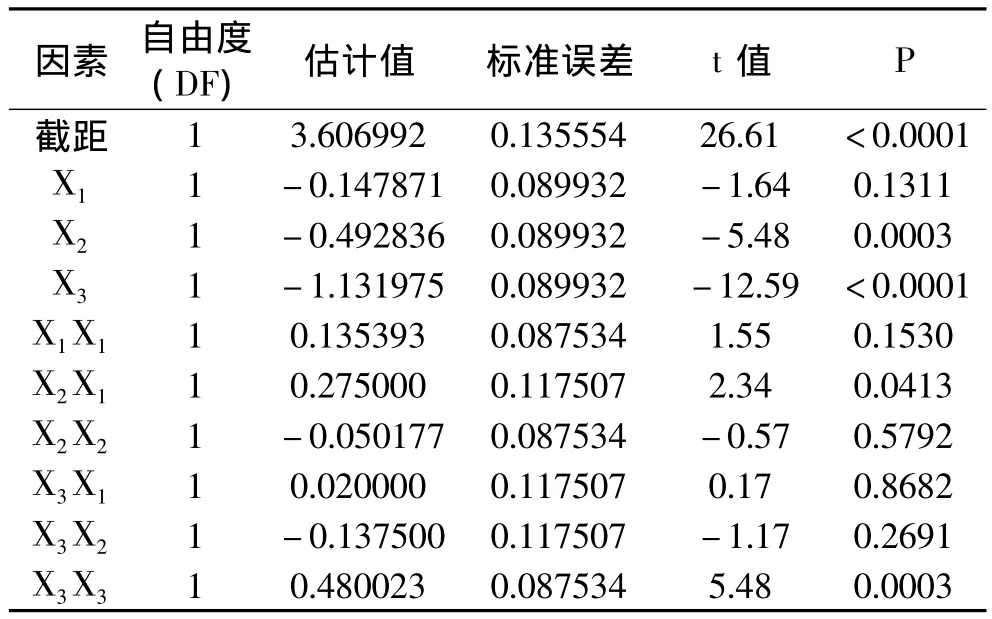
表6 回归系数显著性检验表Table 6 Significance test of regression coefficient
由图1可知,当X1编码为+0.55,即ε-聚赖氨酸添加量为33.2μg/mL;X2编码为+1.682,即Nisin添加量为200μg/mL;X3编码为+1.18,即曲酸添加量为5.12mg/mL,菌落总数分别为极小值。在取得极小值之前,菌落总数与防腐剂的百分比均为负相关;取得最小值之后,菌落总数与防腐剂的百分比均为正相关。
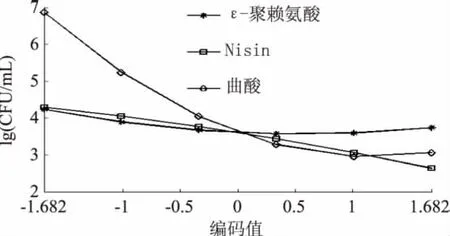
图1 单因子效应曲线Fig.1 Effect of single factor on the colony count
2.3.3 交互效应分析 采用降维分析,令某因素水平值为0,就可以得到其他两个因素对菌落数的二元二次方程。根据回归方程绘制ε-聚赖氨酸、Nisin、曲酸3个因素对菌落数Y影响的响应面图,见图2~图4。

图2 ε-聚赖氨酸和Nisin的响应面曲线Fig.2 The response surface of ε-polylysine and Nisin
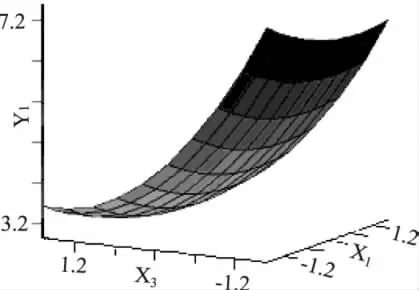
图3 ε-聚赖氨酸和曲酸的响应面曲线Fig.3 The response surface of ε-polylysine and kojic acid
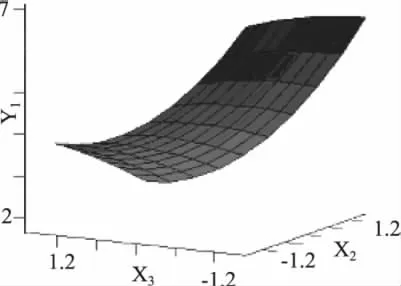
图4 Nisin和曲酸的响应面曲线Fig.4 The response surface of Nisin and kojic acid
响应面图可反映响应值对于处理条件改变的敏感性,从另一个方面也说明因素间交互作用的强弱。由图2~图4可知ε-聚赖氨酸和Nisin的之间交互作用相对于其他因素之间的交互作用最大,而ε-聚赖氨酸和曲酸之间的交互作用最小。
2.3.4 最佳配比的确定 为确定各因素的最佳取值,利用SAS软件进行岭脊分析[10],根据分析可得菌落总数得到最低水平时3种抑菌剂的各自编码值,即X1=-0.30,X2=1.41,X3=0.76。换算成实际值,即当聚赖氨酸添加量为 20.5μg/mL,Nisin添加量为184.6μg/mL,曲酸添加量4.37mg/mL时,单增李斯特菌的对数值可达最小值1.95,此时抑菌效果最佳。
3 讨论
3.1 不同抑菌剂对单增李斯特菌的MIC
本实验中,抑菌效果最好的是ε-聚赖氨酸,对3株单增李斯特菌的MIC均为50μg/mL,抑菌效果次之的是Nisin和曲酸,而乳酸钠、溶菌酶、乳铁蛋白的抑菌效果不明显。倪清艳[11]等人采用牛津杯法和平板稀释法测定了ε-多聚赖氨酸对常见菌的抑菌特性;探讨了其经高温处理后及与其它防腐剂复合后的抑菌特性,结果显示,ε-多聚赖氨酸对大肠杆菌、金黄色葡萄球菌、沙门氏菌的最小抑菌浓度分别为40、45、450mg/L;不同温度处理后的抑菌效果基本没有变化。说明其具有较好的热稳定性能。郭良辉[12]等人研究了Nisin与溶菌酶复合生物保鲜剂对蚌肉的保鲜效果,通过对感官指标、挥发性盐基氮和细菌总数等指标进行考察,从实验结果来看,溶菌酶和Nisin等对蚌肉的防腐保鲜效果都好于对照组,而且Nisin与溶菌酶复配后效果更好,从实验中还得出Nisin具有一定的抑制脂肪酸败的效果。苏国成[13]等人针对曲酸对于食品中常见污染菌的抑制作用进行系统研究,确定了曲酸对各种供试菌最小抑菌浓度,即曲酸对大肠杆菌、猪伤寒沙门氏菌、铜绿假单胞菌、枯草芽孢杆菌、产朊假丝酵母菌和啤酒酵母菌的MIC分别是0.3%、0.4%、0.2%、0.4%、0.2%和0.5%。国内外关于ε-聚赖氨酸、Nisin、曲酸、乳酸钠、溶菌酶、乳铁蛋白针对单增李斯特菌的MIC的文献报道较少,本实验明确了不同抑菌剂对单增李斯特菌的MIC。
3.2 复合抑菌剂对单增李斯特菌的影响
加了抑菌剂的各组BHI营养肉汤,其微生物的生长基本受到抑制,而未加抑菌剂的对照组,微生物数明显增加,从106CFU/mL增长到109CFU/mL。说明本实验的处理对单增李斯特菌的生长有明显的抑制效果,可为进一步在冷却肉中应用提供科学依据。
以菌落总数作为指标来看各抑菌剂的抑菌效果,结果依次是曲酸、Nisin和ε-聚赖氨酸。说明在编码区间内,曲酸的添加量对抑菌效果的影响最为显著。1947年,Mattick和Hirsch证明Nisin可抑制许多革兰氏阳性菌[14],本实验中,单增李斯特菌为革兰氏阳性菌,Nisin对其抑制效果达到极显著水平(P<0.01),这与前人的报道相一致。李凤梅[15]采用圆滤纸片法研究曲酸与ε-聚赖氨酸复合抑菌效果。结果显示,复合后对金黄色葡萄球菌抑菌效果具有协同增效作用。本实验中,从ε-聚赖氨酸与曲酸的响应曲面图可知,两者的交互作用显著。
4 结论
4.1 抑菌效果最好的是ε-聚赖氨酸,对3株单增李斯特菌的MIC均为50μg/mL,抑菌效果次之的是Nisin和曲酸,其MIC分别为200和6400μg/mL以下。
4.2 当ε-聚赖氨酸添加量为20.5μg/mL,Nisin添加量为184.6μg/mL,曲酸添加量4.37mg/mL时,对数值可到达最小值1.95,此时抑菌效果为最佳。ε-聚赖氨酸和Nisin有交互作用。
[1]Mook P,O'Brien SJ,Gillespie IA.Concurrent conditions and human Listeriosis,England,1999-2009[J].Emerging Infectious Diseases,2011,17(1):38-43.
[2]MarcusR.New information aboutpediatricfoodborne infections:the view from FoodNet[J].Current Opinion in Pediatrics,2008,20(1):79-84.
[3]吴蜀豫,李迎惠,冉陆,等.中国2001年11省市食品中李斯特菌污染状况的主动监测[J].中华流行病学杂志,2003,24 (8):657-659.
[4]孔保华.畜产品加工[M].北京:科学出版社,2007.
[5]李波,乔凤,方丽,等.PCR方法检测食品中单核细胞增生李斯特氏菌[J].吉林大学学报:医学版,2006,32(1): 154-156.
[6]Patricia L P,Cristina S,Ramon B,et a1.Vapor—phase activities of cinnamon,thyme,and oregano essential oils and key constituents against foodborne microorganisms[J].Journal of Agricultural and Food Chemistry,2007,55:4348-4356.
[7]Shan B,Cai Y Z,Brooks J D,et al.Antibacterial properties and major bioactive components of cinnamon Stick(Cinnamomum burmannii):activity against foodborne pathogenic bacteria[J]. Journal of Agricultural and Food Chemistry,2007,55:5484-5490.
[8]陈南南,徐歆,商丰才,等.不同防腐剂对3种模式腐败菌抑菌效果的比较[J].食品科学,2011,32(1):14-18.
[9]朱世武.SAS编程技术教程[M].北京:清华大学出版社,2007:75-78.
[10]Shieh C J,Liao H F,Lee C C.Optimization of lipasecatalyzed biodieselby response surface methodology[J]. Bioresource Technology,2003,88(2):103-106.
[11]倪清艳,李燕,张海涛.ε-多聚赖氨酸的抑菌作用及在保鲜中的应用[J].食品科学,2008,29(9):102-105.
[12]郭良辉,许巧情,许永久.溶菌酶与Nisin复合生物保鲜剂对蚌肉的保鲜效果[J].水利渔业,2007,27(4):112-114.
[13]苏国成,汤凤霞,杨秋明.曲酸对常见食品污染菌的抑制作用[J].食品与发酵工业,2005,31(3):47-51.
[14]Rutt Suttisri,IK-Soo Lee,A Douglas Kinghorn.Plantderived triterpenoid sweettness inhibitors[J].Journalof Ethnopharmacology,1995,47:9-26.
[15]李凤梅.曲酸对大肠杆菌和金黄色葡萄球菌的抑制作用研究[J].食品研究与开发,2008,29(6):190-192.
Study on composite antibacterial agents for Listeria monocytogenes
PAN Li-hua,LIU Zhu-qing,YU Hui,CHEN You-liang*
(College of Animal Science,Zhejiang University,Hangzhou 310058,China)
We had to prevent the growth and proliferation of LM which contaminated the meat to ensure the safety of chilled meat,as Listeria monocytogenes can grow at 0~4℃.We studied the minimum inhibitory concentration(MIC) of different bacteriostatic agents against LM,selected ε-polylysine,Nisin and kojic acid,and found their best combination by response surface method.The results showed that the MIC of ε-polylysine,Nisin,kojic acid against LM was 50μg/mL,200μg/mL and 6.4mg/mL.The best bacteriostatic effect of LM under the concentration of ε-polylysine,Nisin,kojic acid was 20.5μg/mL,184.6μg/mL and 4.37mg/mL.
ε-polylysine;Nisin;kojic acid;response surface;Listeria monocytogenes
TS202.3
A
1002-0306(2012)08-0344-05
2011-08-12 *通讯联系人
潘利华(1987-),女,硕士,研究方向:食品安全。
“十一五”国家科技支撑计划(2009BADB09-5)。
