银杏类黄酮O-甲基转移酶活性的高效液相色谱分析
2012-11-02仲月明张传丽沈丹红吴秋月周长远
仲月明,张传丽,陈 鹏,*,沈丹红,吴秋月,周长远
(1.扬州大学园艺与植物保护学院,江苏扬州225009; 2.扬州大学生物科学与技术学院,江苏扬州225009)
银杏类黄酮O-甲基转移酶活性的高效液相色谱分析
仲月明1,张传丽2,陈 鹏1,*,沈丹红1,吴秋月1,周长远1
(1.扬州大学园艺与植物保护学院,江苏扬州225009; 2.扬州大学生物科学与技术学院,江苏扬州225009)
首次明确了银杏叶片类黄酮生物代谢关键酶O-甲基转移酶(flavonoid O-methyltransferase,FOMT)活性的HPLC测定技术与方法。采集扬州大学银杏种质资源圃银杏雄株成熟叶片,提取粗酶液,根据FOMT催化反应生成S-腺苷-L-高半胱氨酸(SAH)的原理,以山奈酚、槲皮素和异鼠李素等3种黄酮苷元为反应底物,采用优化的HPLC体系检测样品中FOMT催化反应生成的SAH峰面积,通过标准曲线求得不同反应底物的FOMT相对活性。FOMT活性反应生成物SAH在1.5~20μg/mL内呈良好的线性关系,RSD为2.1%(n=5),建立了FOMT活性测定优化体系。不同反应底物的FOMT活性表现不同,山奈酚与异鼠李素显著高于槲皮素。FOMT活性HPLC测定方法准确、快速、可靠、灵敏度高。
银杏,雄株,叶片,类黄酮O-甲基转移酶(FOMT)活性,高效液相色谱
银杏(Ginkgo biloba L.)素有“活化石”之称,集食用、保健、药用、生态和观赏等价值于一体。其叶片已得到规模化开发利用并发展成为集约化、标准化经营的国际性重大产业[1-3]。银杏叶中类黄酮是次生代谢产物,是银杏叶的主要功能性成分。其主要包括单黄酮、双黄酮和儿茶素等3类。其中具有生物活性的单黄酮类化合物主要由山奈酚(kaempferol)、槲皮素(quercetin)和异鼠李素(isorhamnetin)等黄酮苷元及其与有关糖类结合而成的糖苷组成(图1)。其可以改善心脑血管循环,清除体内自由基,具有提高自身免疫力和抗氧化、抗衰老、抗癌、抗菌、抗过敏及保护肌肤等功效。上述三种黄酮苷元是黄酮类化合物的主要成分,也是银杏叶提取物(Ginkgo biloba extract,GBE)质量控制的主要检测对象。FOMT是类黄酮合成的关键酶,其催化S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)中-CH3以O-C键方式转移到类黄酮的A、B环上,生成类黄酮甲基衍生物和S-腺苷-L-高半胱氨酸(S-adenosyl-L-homocysteine,SAH)(图2),这不仅可以降低类黄酮的化学反应活性,而且可以增加其脂溶性,扩大其在细胞内的分布范围[4],赋予类黄酮更多的生理生化特性。酶活性测定有定时、连续监测和平衡等方法,由于受到反应浓度、反应时间、反应温度及试剂等的影响,且有的方法费时费工,因而其在应用中受到一定限制。近年来采用高效液相色谱 法 (High PerformanceLiquid Chromatography,HPLC)高效、快速测定酶活性的研究较多[5-7]。本研究首次以银杏雄株叶片为实验材料,根据其催化反应底物黄酮苷元生成SAH的原理,采用HPLC检测分析,从而确定FOMT的活性,为银杏优质叶用资源的选育提供理论依据和技术支撑。
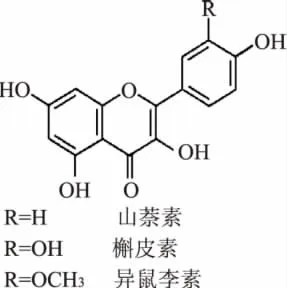
图1 银杏单黄酮基本结构Fig.1 Basic structure of single flavones of Ginkgo
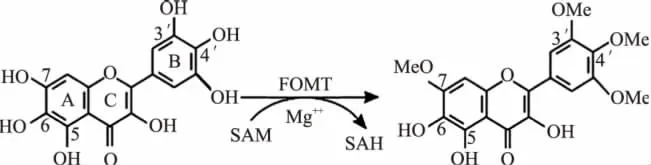
图2 植物类黄酮甲基化模式图Fig.2 The pattern of plant flavones methylation
1 材料与方法
1.1 材料与仪器
5株银杏雄株叶片 扬州大学银杏种质资源圃,液氮研磨、加提取缓冲液(1∶5,w/v)、过滤、离心、粗酶提取;槲皮素、异鼠李素、山奈酚 上海同田生物有限公司,纯度>98%;S-腺苷-L-高半胱氨酸SAH标准品、S-腺苷-L-甲硫氨酸SAM 美国Sigma公司,纯度 >98%;辛烷磺酸钠 美国 Alfa公司; 25mmol/L MgCl2Takara公司;甲酸铵、甲酸、DMSO、甲醇(色谱纯) 上海生物工程有限公司;怡宝水 南京大吉泉水饮料有限公司。
LC-10AT高效液相色谱仪 配有岛津LC-10A泵、SPD-10A紫外检测器、77251进样阀,日本岛津仪器有限公司;水浴锅(SHA-C) 国华仪器有限公司;多用循环水真空泵 上海亚荣生化仪器有限公司;3K-15型高速冷冻离心机 Sigma公司;KQ-500B超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 FOMT活性HPLC测定分析的技术路线 银杏雄株叶片FOMT活性HPLC测定的技术流程如图3所示。在HPLC检测前,整个过程需要在低温条件下进行,从而保证酶的活性。

图3 银杏雄株叶片FOMT活性HPLC测定分析流程图Fig.3 Flowchart of analysis on FOMT activity by HPLC for the male leaves in Ginkgo
1.2.2 色谱条件 色谱柱:采用DiamonsilTM(钻石) C18柱(4.6mm×150mm,5μm);流动相为甲酸铵-甲醇溶液(7∶40)[8-9],称取甲酸铵5.04g,辛烷磺酸钠0.8g,加水溶解,甲酸调节 pH至3.48,加水稀释至800mL,加甲醇140mL,混匀,流速为1.0mL/min,紫外检测波长为258nm,柱温为28℃;进样15μL。
1.2.3 标准曲线 精密量取SAH先溶于少量50%的DMSO中,然后用流动相将其配制为母液,母液再进行逐级稀释,分别配制成标准溶液为20、15、10、5、2.5、1.5μg/mL,0.45μm滤膜过滤,进样15μL,记录色谱图,以SAH峰面积(A)为横坐标,SAH浓度(C)为纵坐标绘制标准曲线。
1.2.4 酶活性单位 酶活性单位的定义为:在下述测定条件下,每30min生成SAH 1pmoL的酶量为1个活性单位U。
1.2.5 FOMT粗酶液提取 参照Paolo、Sabrina等文献[5-6,10-11]确定FOMT粗酶提取方法:取银杏雄株新鲜叶片20g,液氮研磨,加入100mL提取缓冲液(1∶5,w/v);过滤,离心,取上清液。
1.2.6 FOMT活性测定体系优化
1.2.6.1 温度影响酶活性变化曲线 酶量恒定(200μL),反应30min,山奈酚为底物,反应温度设定为20、25、30、35、40、45℃。0.45μm滤膜过滤,进样15μL,记录色谱图,保留时间定性,峰面积定量。
1.2.6.2 pH影响酶活性变化曲线 酶量恒定(200μL),反应30min,山奈酚为底物,缓冲液pH设为5、6、7、7.5、8、9、10。0.45μm滤膜过滤,进样15μL,记录色谱图,保留时间定性,峰面积定量。
1.2.6.3 底物浓度影响酶活性变化曲线 酶量恒定(200μL),反应30min,山奈酚为底物,底物浓度分别为20、50、100、200、400μmol/L。0.45μm滤膜过滤,进样15μL,记录色谱图,保留时间定性,峰面积定量。
1.2.7 不同底物FOMT活性测定比较 将5株雄株叶片混合,分别以山奈酚、异鼠李素、槲皮素为底物,应用优化的酶活反应体系测定FOMT活性。
2 结果与讨论
2.1 FOMT粗酶液提取及其反应底物的选用
参照Paolo、Sabrina等文献[5-6,10-11]确定提取缓冲液为Tris-Hcl(8.0)50mmol/L,EDTA 1mmol/L,PMSF 1mmol/L,NaCl 50mmol/L,Triton X-100 0.1% (v/v);4层纱布过滤,4℃,11000r/min离心30min,取上清液。粗酶液保存于-20℃备用。粗酶提取过程需在低温下进行,本实验的整个过程选择在冰上完成。
山奈酚、槲皮素和异鼠李素是具有生物活性的黄酮苷元,也是GBE质量检测的主要指标,因此本实验选择其分别作为酶活反应底物。
2.2 HPLC条件的选择与优化
选取不同比例的甲醇-甲酸铵溶液进行分离度实验,结果显示甲醇和甲酸铵溶液的比例为7∶40时,出峰效果最好。流动相的pH对杂质的分离度有较大影响,pH越小,杂质分离度越大。考虑到pH过低容易对色谱柱产生损害,实验选取pH 3.0~4.0范围进行实验,多次实验结果表明pH为3.48时,SAH的出峰及保留时间都较稳定,可以满足含量测定的要求。本文选择不同柱温进行了实验,结果显示温度对测定结果影响较大,温度越高保留时间越短,本实验选择接近室温的28℃为柱温,容易确保实验条件的一致性。SAH的保留时间为14min左右。具体色谱图见图4、图8~图10。
2.3 SAH溶液标准曲线绘制及色谱图
以SAH峰面积(A)为横坐标,SAH浓度(C)为纵坐标进行线性回归,得到SAH浓度相应于SAH峰面积的线性回归方程为:y=6E-07x+0.3135,r= 0.9991(n=6);即SAH浓度1.5~20μg/mL内,其峰面积与浓度呈良好的线性关系。由图4得知,采用SAH对照品进样分析,确定 SAH的保留时间为14min左右。
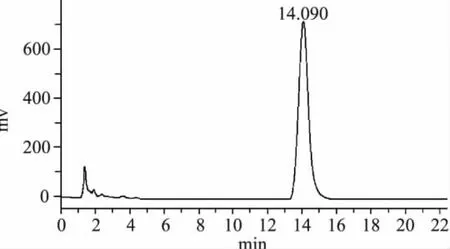
图4 SAH标准溶液色谱图Fig.4 HPLC chromatogram of SAH in standard solution
2.4 HPLC检测精密度实验
取SAH对照品20μg/mL溶液,重复进样5次,记录峰面积和保留时间并计算相对标准偏差(RSD),结果表明 SAH的RSD为2.1%,精密度良好。
2.5 HPLC检测回收率实验
取样品20μL,加入对照品20μg/mL溶液20μL,混匀,取15μL上样,重复进样3次。计算SAH的加样回收率,结果为100.7%。
2.6 FOMT活性的HPLC测定
2.6.1 酶活反应体系优化
2.6.1.1 酶促反应随温度的变化 本研究设定6个温度值来探明银杏中FOMT活性反应的最适温度条件,由图5可知,银杏FOMT活性反应最适温度为25℃。不同植物FOMT活性反应的最适温度稍有不同,康乃馨FOMT活性反应温度为25℃[10],菊科麻花FOMT为30℃[5],大麦中 FOMT为20℃[12],结果表明,银杏FOMT活性反应最适温度与其他植物的比较接近。
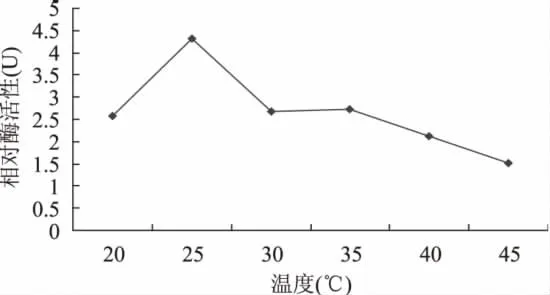
图5 酶促反应随温度的变化Fig.5 Changes of enzymatic reaction in the different temperatures
2.6.1.2 酶促反应随pH变化 FOMT维持活性的最适pH为7.0~8.0,不同来源稍有差异。本研究选取6个pH进行实验,结果显示银杏FOMT活性反应的最适pH范围为7.5~8.0。说明银杏FOMT维持活性的pH在正常范围内。与其他植物差异不大,如康乃馨FOMT最适pH为中性范围,麻花FOMT为7.6,鸢尾FOMT为7.5~8.0[13]。
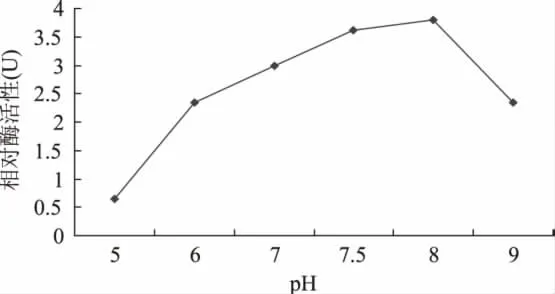
图6 酶促反应随pH变化Fig.6 Changes of enzymatic reaction in the different pH
2.6.1.3 酶促反应随底物浓度变化 底物浓度在酶活性反应中也具有非常重要的作用,本实验设定5个底物浓度梯度,实验结果表明,底物浓度为100μmol/L时,酶活性最高,因此本实验确定100μmol/L为FOMT活性反应的最佳浓度。
因此,酶促反应的最适温度为25℃,最适pH范围在7.5~8.0,最适底物浓度为100μmol/L。得出FOMT活性反应的优化体系:Tris-Hcl(7.5)50mmol/L,β-巯基乙醇 14mmol/L,底物 100μmol/L,SAM 40μmol/L,Mg2+12.5mmol/L,25℃水浴反应30min,沸水浴5min终止反应。
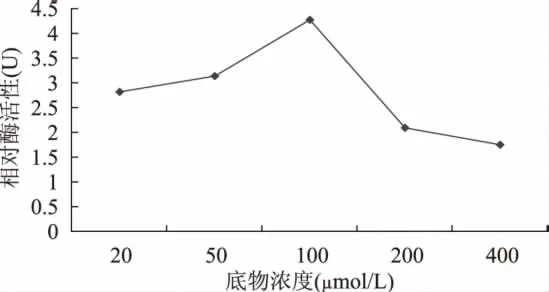
图7 酶促反应随底物浓度变化Fig.7 Changes of enzymatic reaction on the different substrate concentrations
2.6.2 不同底物样品FOMT活性测定比较 根据2.6.1酶活测定体系优化的结果,采取pH 7.5,底物浓度100μmol/L,温度25℃水浴孵育30min,检测FOMT活性。图8为不加类黄酮底物的空白实验,酶液中SAH含量较低,检测不到数值。色谱图图9~图11分别为以槲皮素、山奈酚、异鼠李素为底物的FOMT活性反应生成物SAH测定的HPLC图谱。不同底物样品FOMT活性测定比较结果见表1。
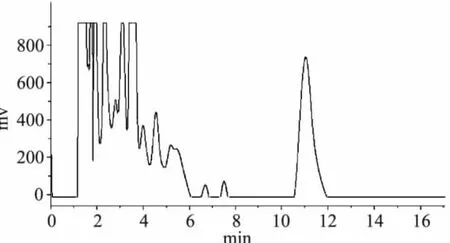
图8 空白实验(不加类黄酮底物)样品的HPLC色谱图Fig.8 HPLC chromatogram of blank test sample (without flavonoid substrates)

图9 槲皮素为底物的FOMT活性反应生成物SAH色谱图Fig.9 HPLC chromatogram of SAH derived from FOMT catalytic reaction on the quercetin

表1 三种底物FOMT相对活性比较(n=3)Table 1 Comparative of FOMT activity on there different substrates(n=3)
由表1可以得出,不同反应底物的FOMT活性表现有所差异:山奈酚与异鼠李素差异不显著,槲皮素分别与山奈酚和异鼠李素都有显著性差异,槲皮素为底物的酶活性显著较低。说明FOMT对山奈酚和异鼠李素的底物亲和性显著高于槲皮素。
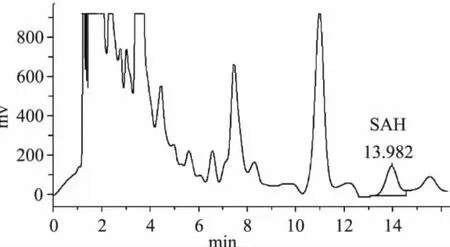
图10 山奈酚为底物的FOMT活性反应生成物SAH色谱图Fig.10 HPLC chromatogram of SAH derived from FOMT catalytic reaction on the kaempferol
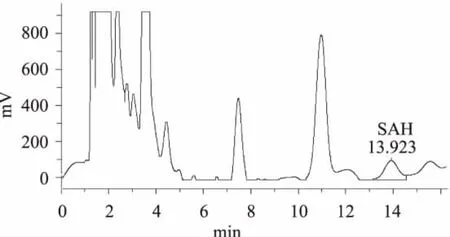
图11 异鼠李素为底物的FOMT活性反应生成物SAH色谱图Fig.11 HPLC chromatogram of SAH derived from FOMT catalytic reaction on the isorhamnetin
3 讨论
本研究首次采用HPLC方法测定银杏叶片中FOMT酶活性,所获得的HPLC方法快速、灵敏、准确、重现性好,精确度良好,耗费药品较少,节省成本,可有效测定FOMT活性反应产物的含量,从而更加准确地测出酶的活性。由于酶活反应受到反应温度,反应浓度,试剂等的影响,本实验对酶活反应体系进行优化,使得酶活测定的结果更具代表性。选择山奈酚、槲皮素和异鼠李素作为反应底物能够更好地说明FOMT的活性,因为这三种底物是具有生物活性的黄酮苷元,也是GBE质量检测的主要指标。本研究为探究银杏雄株叶片类黄酮含量与FOMT活性相关性奠定基础,从而为银杏优质叶用资源的选育提供理论依据和技术支撑。
[1]Chen P,He FR,Tao J,et al.Female plant types of Ginkgo biloba L.in China[J].Forestry Studies(in China),2003(5): 17-22.
[2]陈鹏,宋朝枢,严宏生,等.中华人民共和国国家标准《银杏种核质量等级》[S].中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会,中国标准出版社,2006.
[3]陈鹏.银杏资源优化配置及高效利用[M].北京:中国农业出版社,2007:379.
[4]Yang H,Ahn JH,Ibrahim RK,et al.The three-dimensional structure of Arabidopsis thaliana O-methyltransferase predicted by homologybased modeling[J].Journal of Molecular Graphics and Modelling,2004,23:77-87.
[5]Huang TS,Anzellotti D,Dedaldechamp F,et al.Partial purification,kinetic analysis,and amino acid sequence information of a flavonol 3-O-methyltransferase from serratula tinctoria[J]. Plant Physiology,2004,134:1366-1376.
[6]Kim BG,Lee HJ,Park Y,et al.Characterization of an O-methyltransferase from soybean[J].Plant Physiology and Biochemistry,2006,44:236-241.
[7]李旭晖,朱明军,郭启军.一种测定粗纤维素酶中β-葡萄糖苷酶酶活方法的建立[J].现代食品科技,2010,26(3): 323-325.
[8]林秋婕,陈赞民.HPLC法测定丁二磺酸腺苷蛋氨酸中的有关物质[J].中国热带医学,2007,7(8):1434-1436.
[9]赵鹏,王东凯,仲静洁,等.注射用腺苷蛋氨酸3种有关物质的HPLC测定[J].药物分析杂志,2006,26(8):1118-1119.
[10]Curir P,Lanzotti V,Dolci M,et al.Purification and properties of a new S-adenosyl-L-methionine:Flavonoid 4’-O-methyltransferase from carnation(Dianthus caryophyllus L.)[J]. Eur J Biochem,2003,270:3422-3431.
[11]Cacacea S,Schrödera G,Wehingera E,et al.A flavonol O-methyltransferase from Catharanthus roseus performing two sequential methylations[J].Phytochemistry,2003,62:127-137.
[12]Christensen AndersB,Gregersen Per L,Olsen CarlE,et al.A flavonoid 7-O-methyltransferase is expressed in barley leaves in response to pathogen attack[J].Plant Molecular Biology,1998,36:219-227.
[13]Noriko Y,Masako FM,Hiroaki O,et al.Molecular cloning and characterization of O-methyltransferases from the flower buds of iris hollandica[J].Journal of Plant Physiology,2008,165: 415-422.
Analysis on flavonoid O-methyltransferase activity in Ginkgo by high performance liquid chromatography
ZHONG Yue-ming1,ZHANG Chuan-li2,CHEN Peng1,*,SHEN Dan-hong1,WU Qiu-yue1,ZHOU Chang-yuan1
(1.College of Horticulture and Plant Protection,Yangzhou University,Yangzhou 225009,China; 2.College of Bioscience and Biotechnology,Yangzhou University,Yangzhou 225009,China)
To research and geta technique and method fordetermination on theactivityofflavonoid O-methyltransferase(FOMT),a key-enzyme of flavonoid biosynthesis in Ginkgo leaves,by RP-HPLC for the first time.The adult leaves of male plants,were obtained from Ginkgo germplasm resources garden of Yangzhou university,then that were used to extract the crude enzyme solution.Based on the principle of S-adenosyl-L-homocysteine(SAH)derived from FOMT catalytic reaction and the correlationship between content and peak area of SAH,the relative activities of FOMT on the different substrates such as kaempferol,quercetin and isorhamnetin,were determined,the standard curve detected by optimized high performance liquid chromatography(HPLC) system in which there was a significant linear relationship within the range of 1.5~20μg/mL,RSD=2.1%(n=5),so the optimized system for assaying FOMT activity had been established.FOMT activities of the different substrates showed different,kaempferol and isorhamnetin significiantly higher than quercetin.This HPLC system for determination on FOMT activity could be considered as a method which was accuracy,fastness,reliability and high sensitivity.
Ginkgo;male plant;leaf;flavonoidO-methyltransferase(FOMT)activity;high performance liquid chromatography
TS207.3
A
1002-0306(2012)08-0095-05
2011-07-20 *通讯联系人
仲月明(1985-),女,硕士研究生,研究方向:银杏保健药用资源的开发利用。
国家农业综合开发项目(GH32311002);江苏省林业三项工程项目(lxsx[2008]02)。
